Spectral Reflectometric mikroskopi på myelinerede axoner In Situ
Summary
Vi præsenterer her, en trinvis protokol for imaging myelinerede axoner i en fast hjernen skive ved hjælp af en etiket-fri nanoskala imaging teknik baseret på spektral reflectometry.
Abstract
I et pattedyr nervesystemet giver myelin en elektrisk isolering af enwrapping axon fibre i en flerlaget spiral. Inspireret af sin meget organiseret subcellulært arkitektur, vi for nylig udviklet en ny imaging modalitet, opkaldt spektral reflectometry (SpeRe), som giver mulighed for hidtil uset etiket-fri nanoskala billeddannelse af levende myelinerede axoner in situ. Det underliggende princip er at opnå nanostructural oplysninger ved at analysere Reflektionsgraden spektrum af flerlaget subcellulært struktur. I denne artikel vil beskrive vi en detaljeret trin for trin-protokol til at udføre en grundlæggende SpeRe billeddannelse af nervøs væv ved hjælp af en kommerciel Konfokal mikroskopiske system, udstyret med en hvid-lys laser og en afstemmelige filter. Vi dækker procedurer for prøveforberedelse, erhvervelse af spektrale data og billedbehandling for at opnå nanostructural oplysninger.
Introduction
I pattedyr nervesystemet giver myelin hurtig nerve varmeledning og cytoskeletale integritet af enwrapping axon fibre med flerlaget hindeagtige skeder. Dens lag struktur er sammensat af skiftevis nanoskala tynd-film sammensat af plasma membraner (~ 5 nm), cytosol (~ 3 nm), og ekstracellulære rum (~ 7 nm)1,2. Optisk mikroskopi, herunder den seneste Super-resolution mikroskopi, er ikke egnet til observere nanoskala myelin dynamikken på grund af deres utilstrækkelige opløsning på grund af optisk diffraktion3,4,5. Selvom elektronmikroskopi kan give fine detaljer af myelin nanostrukturer, er den ikke kompatibel med de levende biologiske systemer på grund af stærkt invasive prøve forberedelserne involverer kemiske fiksering og ultrasectioning6,7 . Indtil for nylig, er der ingen teknik gældende at observere nanoskala dynamics af myelinerede axoner in situ.
Schain et al. rapporterede tidligere, at myelinerede axoner udviser farverige lys Reflektionsgraden8. Ved at vedtage spektroskopisk analyse på det reflekterede lys, har vi udarbejdet en ny imaging modalitet for nanoskala billeddannelse af myelinerede axoner, opkaldt spektral reflectometry (SpeRe)9. SpeRe er baseret på de tynd-hinde interferens forekommer i den multi-lag struktur af myelinskeden (figur 1). Af fiberoptiske simulering på forskellige axoner, vi har afsløret at Reflektionsgraden spektrum er en periodisk funktion af wavenumber og dens hyppighed (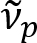 ) er omvendt proportional med axon diameter (d). Denne simple relation (
) er omvendt proportional med axon diameter (d). Denne simple relation (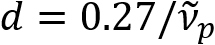 ) tilbyder facile kvantificering af axon diameter fra SpeRe data. Udnytte dette, afslørede vi den fremherskende axon svulmende under mild traumatisk hjerneskade i vores tidligere rapport.
) tilbyder facile kvantificering af axon diameter fra SpeRe data. Udnytte dette, afslørede vi den fremherskende axon svulmende under mild traumatisk hjerneskade i vores tidligere rapport.
SpeRe systemet er baseret på Konfokal mikroskopi og består af en specialiseret Laserkilde og filtre (figur 2). Input-kilde er en hvid-lys laser, leverer bredbånd spektrale output synlige infrarøde regioner. For den spektrale scanning, systemet er udstyret med to akustisk-optiske enheder: en akustisk-optisk afstemmelige filter (AOTF) for at levere en valgte bølgelængde fra bredbånd indgangskilden og en akustisk-optisk stråledeler (AOBS) til vejlede den valgte afspejles bølgelængde til detektoren. Software til hyperspectral Konfokal mikroskopi giver (Se Tabel af materialer) en tilpasselig spektrale scan valgmulighed sekventielt erhverve Reflektionsgraden billeder på forskellige input bølgelængder. Derudover kromatisk aberration kritisk kan blande sig i den spektrale måling; Derfor anbefales brug af en apochromat mål linse.
Bemærk, hvid-lys lasere producere en ujævn spektrale output og de optiske komponenter også påvirke den spektrale profil. De erhvervede spectra skal derfor være kalibreret til den efterfølgende kvantitativ analyse. En beskyttet Sølv spejl bruges typisk som en reference, der giver en næsten konstant Reflektionsgraden (> 97%) over regionen fuldt synlige. De erhvervede spectra er derefter divideret med reference spektre fra spejlet.
Den spektrale trin størrelse for den spektrale scan bestemmer erhvervelse hastighed; Det skal således være optimeret. Som en større axon har en højere spektrale periode, kræver det finere spektrale prøveudtagning. For eksempel, en axon med en diameter på 10 µm, en af de største fysiologisk axoner, har en spektral periode af ~ 8 nm. Ved at anvende Nyquist prøveudtagning kriterier, vi ansat den spektrale prøveudtagning interval af 4 nm til at dække alle de fysiologiske axoner i mus nervøs væv. Denne tilgang tager typisk over flere sekunder for en fuld spektrale scanning og er således ikke egnet til i vivo applikationer, hvor fysiologisk bevægelse (f.eks. åndedræt og hjerterytme) griber stabil spektrale erhvervelse. Vi tidligere løst problemet ved instrumentering tilpassede opretstående mikroskop, designet til at erhverve den fulde spektrum for hver punkt ved hjælp af en array spectrometer (erhvervelse hastighed ≈ 30 ms per pixel).
I denne betænkning beskriver vi en detaljeret protokol på SpeRe imaging på en fast hjernen skive, som kan udføres i en kommerciel hyperspectral mikroskop (Se Tabel af materialer). Protokollen kan således udføres af eksperimentatorer uden ekspertise i optisk instrumentation. Vi dækker også de potentielle problemer og fejlfinding i forbindelse med erhvervelse og analyse af SpeRe data.
Protocol
Representative Results
Discussion
SpeRe er en ny label-fri imaging modalitet baseret på spektrale interferometri, som for første gang tilbyder nanoskala oplysninger i live myelinerede axoner. I den nuværende protokol, erhvervelse, den rumlige opløsning for axon diameter er ca. 10 nm. Desuden udnytter SpeRe ordrer af størrelsesorden lavere lys dosis i forhold til andre super-opløsning microscopies; Det er således fri for fototoksicitet og photobleaching. SpeRe vil give en ny avenue for at studere nanoskala dynamics af myelinerede axoner.
<p cla…Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af Institute for grundlæggende videnskab (IBS-R015-D1) og grundlæggende videnskab forskningsprogram gennem National Research Foundation af Korea (NRF) finansieret af Undervisningsministeriet (2017R1A6A1A03015642).
Materials
| Glass cutter | – | – | Can be purchased in a local convenience store or online stores. |
| Nail polish | – | – | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | – |
| Matlab | MathWorks | – | – |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | – |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | – |
| Vibratome | Leica Biosystems | VT1200S | – |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
References
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).

