Spectral Reflectometric mikroskopi på Myelinated Axons In Situ
Summary
Her presenterer vi en trinnvis protokoll for imaging myelinated axons i en fast hjernen stykke ved hjelp av en etikett-fri nanoskala tenkelig teknikk basert på spectral reflectometry.
Abstract
I et pattedyr nervesystemet gir myelin en elektrisk isolasjon av enwrapping axon fibrene i en flerlags spiral. Inspirert av sin svært organisert subcellular arkitektur, vi nylig utviklet en ny tenkelig modalitet, kalt spectral reflectometry (SpeRe), som gir enestående etikett-fri nanoskala avbilding av live myelinated axons i situ. Underliggende prinsippet er å få nanostructural informasjon ved å analysere refleksjon spekteret av flerlags subcellular strukturen. I denne artikkelen beskriver vi en detaljert trinnvise protokoll for å utføre et grunnleggende SpeRe bildebehandling av nervøs vev ved å bruke en kommersiell AC confocal mikroskopiske, utstyrt med en hvit lys laser og en tunable filter. Vi dekker prosedyrene for eksempel forberedelse, oppkjøp av spektraldata og bildebehandling for å få nanostructural informasjon.
Introduction
I pattedyr nervesystemet gir myelin rask nerve ledning og axonal integritet ved enwrapping axon fibrene med flere lag membranous hylser. Flerlags strukturen består av vekslende nanoskala tynn-filmer består av plasma membraner (~ 5 nm), stoffer (~ 3 nm), og ekstracellulære mellomrom (~ 7 nm)1,2. Optisk mikroskopi, inkludert den siste super-oppløsning mikroskopi, er ikke egnet for å observere nanoskala myelin dynamikken på grunn av sin lav oppløsning på grunn av optisk Diffraksjon3,4,5. Selv om elektronmikroskop kan gi fine detaljer av myelin-nanostructure, er det ikke forenlig med levende biologiske systemer på grunn av svært invasiv eksempel preparater som involverer kjemiske fiksering og ultrasectioning6,7 . Inntil nylig har det vært ingen teknikk gjelder observere nanoskala dynamikken i myelinated axons i situ.
Schain et al. tidligere rapportert at myelinated axons viser fargerike lys refleksjon8. Ved å vedta spectroscopic analysen på det reflekterte lyset, har vi utviklet en ny tenkelig modalitet ved nanoskala avbildning av myelinated axons, kalt spectral reflectometry (SpeRe)9. SpeRe er basert på tynn-film forstyrrelser forekommer i flerlags strukturen av myelin-skjeden (figur 1). Av optikk simulering på ulike axons, vi har avdekket at refleksjon spekteret er en periodisk funksjon av wavenumber og dens periodisitet (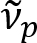 ) er omvendt proporsjonal med axon diameter (d). Dette forholdet (
) er omvendt proporsjonal med axon diameter (d). Dette forholdet (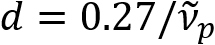 ) tilbyr lettvinte kvantifisering av axon diameter fra SpeRe data. Utnytte dette, avslørte vi utbredt axon svulmende under mild traumatisk hjerneskade i vår forrige rapport.
) tilbyr lettvinte kvantifisering av axon diameter fra SpeRe data. Utnytte dette, avslørte vi utbredt axon svulmende under mild traumatisk hjerneskade i vår forrige rapport.
SpeRe systemet er basert på AC confocal mikroskopi og består av en spesialisert laser kilde filtre (figur 2). Kilde er et hvitt lys laser, gir bredbånd spectral utgang synlig for infrarød regioner. Spectral skanningen, systemet er utstyrt med to acousto-optisk enheter: et acousto-optisk tunable filter (AOTF) for å levere en valgte bølgelengde fra bredbånd inngangskilde og en acousto-optisk strålen splitter (AOBS) for guiding valgt reflektert Bølgelengden til detektoren. Programvaren for hyperspektral AC confocal mikroskopi gir (se Tabell for materiale) en passelig spectral scan alternativ sekvensielt hente refleksjon bilder med forskjellige input bølgelengder. I tillegg kan kromatisk aberrasjon kritisk påvirke i spektral målingen; Det anbefales derfor bruk av en apochromat linsen.
Av notatet, hvitt lys lasere produserer en ujevn spectral utgang og optisk komponentene påvirke spectral profilen. Derfor må til ervervet spectra kalibreres for påfølgende kvantitativ analyse. Et beskyttet sølv speil er vanligvis brukt som en referanse, som gir en nesten konstant refleksjon (> 97%) over regionen fullt synlig. De ervervet spectra deles deretter av til referanse spectra fra speilet.
Spectral trinn størrelsen på spectral skanning bestemmer oppkjøpet hastighet; Dermed må optimaliseres. Som en større axon har en høyere spectral periode, krever det finere spectral prøvetaking. En axon med en diameter på 10 µm, en av de største fysiologiske axons, har for eksempel en spektral periode ~ 8 nm. Bruker Nyquist prøvetaking kriterier, vi ansatt spectral prøvetaking tidsintervallet 4 nm å dekke alle fysiologiske axons i musen nervøs vev. Denne tilnærmingen vanligvis tar over flere sekunder for en full spectral skanning og dermed er ikke egnet for i vivo programmer, hvor fysiologiske bevegelse (f.eks åndedrett og hjerteslag) griper stabil spectral oppkjøpet. Vi har tidligere løst problemet ved instrumenting tilpasset oppreist mikroskop, utformet for å skaffe hele spekteret for hvert punkt ved hjelp av en matrise spectrometer (oppkjøpet hastighet ≈ 30 ms per piksel).
I denne rapporten, beskriver vi en detaljert protokoll om SpeRe bildebehandling på en fast hjernen skive, som kan utføres i en kommersiell hyperspektral mikroskop (se Tabell for materiale). Protokollen kan derfor fullføres av forskere uten ekspertise innen optisk instrumentering. Vi dekker også den potensielle problemer og feilsøking for oppkjøp og analyse av SpeRe data.
Protocol
Representative Results
Discussion
SpeRe er en ny etikett uten tenkelig modalitet basert på spectral interferometry, som for første gang, tilbyr nanoskala informasjonen i live myelinated axons. I gjeldende oppkjøpet protokollen, romlig oppløsning for axon diameter er av 10 nm. Videre benytter SpeRe bestillinger av omfanget lavere lys dose sammenlignet med andre super-oppløsning microscopies; Dermed er det fri fra Phototoksisitet og photobleaching. SpeRe vil gi en ny vei for å studere nanoskala dynamikken i myelinated axons.
<p class="jove_conten…Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av Institutt for grunnleggende vitenskap (IBS-R015-D1) og av grunnleggende Science Research Program gjennom National Research Foundation av Korea (NRF) finansiert av departementet for utdanning (2017R1A6A1A03015642).
Materials
| Glass cutter | – | – | Can be purchased in a local convenience store or online stores. |
| Nail polish | – | – | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | – |
| Matlab | MathWorks | – | – |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | – |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | – |
| Vibratome | Leica Biosystems | VT1200S | – |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
References
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).

