細胞の Cardiomyogenic の可能性を高めるに同時電気的・機械的刺激
Summary
ここで心臓の生理学をエミュレートする電気的・機械的刺激を用いたセル人口をトレーニングするためのプロトコルを提案する.この電気刺激は扱われた細胞の cardiomyogenic の可能性を高めるもの、さらに細胞療法、疾患モデル作製、および創薬スクリーニングの有望な戦略です。
Abstract
心血管疾患は、先進国の主要な死因です。その結果、効果的な心臓の細胞療法のための要求は基礎研究と臨床応用のための in vitro忠実度の高いひと心筋を開発する幹細胞とバイオ エンジニア リング分野の研究者に動機を与えた。ただし、心筋細胞の未熟な表現型は機能的模倣は機械的および電気的信号によって主に特徴付けられる大人の心筋組織の取得に制限です。したがって、このプロトコルの目的を準備し、生理学的パラメーターをさた電気刺激による標的細胞のポピュレーションを成熟です。心臓ティッシュ エンジニア リングの進化のより多くの生物学的アプローチ、方向、したがって、生物の刺激に基づく戦略が勢いを増しています。この目的のために開発した装置は、ユニークで個別または同時電気的・機械的刺激、慎重に検証し、特徴をことができます。さらに、方法論はこの刺激と特定のセル人口のために最適化されているが簡単にこと他のデバイスおよび細胞ラインに適応です。ここでの結果は、電気刺激後の細胞集団の心臓のコミットメントの増加の証拠を提供しています。基づかせ刺激細胞は初期・構造・ カルシウム調節遺伝子を含むメインの心臓マーカーの発現の増加を表示します。この携帯エアコンはさらに再生細胞療法、疾患モデル作製、高スループットの薬剤のスクリーニングに役に立つかもしれません。
Introduction
心臓の機能は、電気刺激や機械的収縮の結合に基づいています。簡潔に、心筋細胞間の接合は、全身および肺システムを介して血液を送り出す心臓のほぼ同期の収縮を生成への電気信号の伝達を許可します。心筋細胞は、したがって、遺伝子発現と細胞機能を調節する電気と機械の両方の力を受けます。したがって、多くのグループが機械的・電気的刺激が心臓の開発、機能、および成熟の役割を理解する心の生理環境を模倣文化のプラットフォームを開発しようとしています。In vitro電気的・機械的刺激個別に適用されている広範囲機能特性を高める細胞の成熟を増やすか、細胞間結合とカルシウムの処理1を改善する心臓組織工学,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21. それにもかかわらず、同期電気機械式エアコン残る未踏刺激およびプロトコルの開発の挑戦のため、必須の最適化22のため。
予備的な作業対応電気刺激電気刺激および灌流; の組み合わせとしてしかし、流れは心室充填23,24,25の典型的な歪みベースの変形を伴わない。多くの生理学的アプローチが物理的な変形と等容収縮26,27,28,29,30 を模倣するストレッチ電気刺激を併用後、 ,31。風水ら 2005、心筋収縮と26を強化されたレポートにおける電気刺激の最初のデモンストレーションを説明しました。王ら 5-アザシチジンと間葉系幹細胞を前処理し、同時の電気的・機械的エアコン、recellularization、細胞生存率、心筋分化と改造27組織改善を適用します。これらの出版物以来より多くのグループが細胞の電気刺激に関する報告または設計組織 (例えば、黒28、Vunjak ノバコビチ29,31, と私たちのグループの30)、最初の調節された細胞は、生体内で30をテストしました。簡単に言えば、モーガンと黒いくつかの組み合わせをテスト電気的・機械的刺激の刺激間のタイミングあった重要なため遅延結合された電気刺激が最高の結果28を得られたことを報告します。次に、Godier Furnémont との共同研究ラット新生児心筋細胞から人工心臓の筋肉構造のため電気刺激プロトコルを最適化し、肯定的な力周波数関係29を最初に達成。その後、私たちのグループ報告、電気機械的前処理細胞主な心臓マーカーの in vitro発現の増強、その広範な有益な生体内での効果など心機能を改善または、梗塞で血管密度を増加国境地域30。最も最近の出版物を示した心筋組織幹細胞由来心筋細胞からは受ける成熟レベル人間に近い成人心臓の構造と機能31に達した電気機械をご利用いただけます。また、代替三次元刺激プラットフォーム構成には、電気、機械、ゲルロボット足場、32がセルに地形のキューに接続されています。また、機械的変形 (細胞膜のストレッチと圧縮) は、極端な条件33と同様に、通常の生理学的条件を模倣した伸縮性電極を用いた誘導もことができます。
したがって、理論的根拠は生理学的条件に基づく in vitro における電気刺激が細胞の cardiomyogenic の可能性を高めることができます。確かに、この刺激がさらに臨床シナリオで心筋に治療用細胞の統合の恩恵を受けるか薬剤スクリーニング用組織の成熟を増やします。
また、孤立し、心のひと脂肪組織由来神経前駆細胞の人口を特徴と起源 (心臓 ATDPCs)34。これらの細胞は、心外膜脂肪にあります。これらの細胞は心筋梗塞の治療に有益な病理組織学的、機能的な効果を表示、また潜在的な心臓と血管内皮分化を維持します。30,35です。 これらの利点が生物物理刺激後増加を。
その結果、デバイスと興味のセル人口のための刺激体制を開発し、効果を検討した.このメカニカル プロトコルをアクティブ セルの滅菌方法でストレッチを誘発する新たな戦略して前出版物36, 電場刺激との組み合わせと比較して非侵襲的です。技術がここに報告は、装置と細胞の電気、機械、および電気刺激の使用方法の詳細について説明します。
このデバイスは、個別または同時に電気的・機械的刺激を提供することができます。刺激は、presterilized セル サポート、標準培養プレート、機械的および電気的力 (図 1) を誘導するプラットフォーム内部電極を含む非侵襲的かつ無菌の新たなアプローチで実行されます。
プラットフォームは、プレート、サンドイッチ構造レーザー カット poly(methyl methacrylate) ・ プリント基板部分成っている六つの文化まで保持できます。プラットフォーム プロトタイプは、単相性プログラム可能なコンピューター制御電気刺激装置、電極、および配置 6 10 mm x 10 mm x 5 mm ニッケル メッキ ネオジム固定磁石の堅牢な接続のため、プリント回路基板の組み合わせに依存しています。培養皿の片側に近い6 駆動磁石 (同じモデル) 前培養皿の反対側に置かれ、リニア サーボモータと移動とアルミのバーもあります。電動モーター コント ローラー、RS-232 ポートを通じて商業ソフトウェアが運営によって (材料の表を参照してください)。ユーザー インターフェイスとプログラミング可能な刺激、電気的強度、脈拍の持続期間、頻度、機械的刺激、そのデューティ サイクル、パルス振幅 (磁石遠足)、パルス数の周波数をプログラムすることが可能です。斜面。
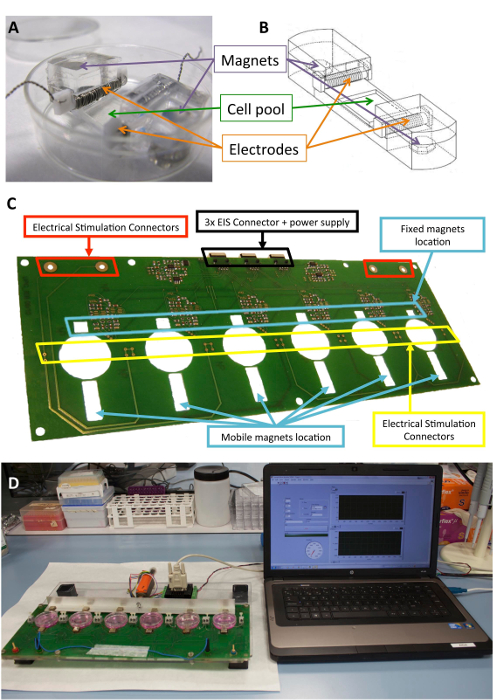
図 1: 電気刺激装置。(A) PDMS 構造細胞調節のために使用されます。(B) 電極と磁石を含む PDMS コンストラクトの図面。(C) 電気機械の調節を行うためのプリント回路基板 (プラットフォーム) の詳細。このパネルは、Llucià Valldeperas から変更されているら30。(D) 電気刺激プラットフォームとユーザー インターフェイス (コンピューター) の画像。この図の拡大版を表示するのにはここをクリックしてください。
刺激と電気エアコンのメソッドは、2 つの国際特許 WO 2013185818 A137ヲ 2017125159 A138で詳しく説明します。
構成要素のセル、電極、および磁石に構造サポートを提供するように設計されている生体適合性シリコーンは前述10,21。簡単に言えば、彼らはポリジメチルシロキサン (PDMS) 成形し、生理学的レベルに近い、1.3 MPa のヤングと常温で硬化ので構成されます。構築には柔軟な地区 (10 × 10 × 2 mm) 細胞培養プールが含まれて、電極を保持するために 2 つの内側横スロットと 2 つに 6 mm × 2 mm × 4 mm ニッケル メッキのネオジム磁石が埋め込まれています。電極は 0.2 mm プラチナ線 2 mm × 3 mm x 12 mm ポリテトラフルオロ エチレン (PTFE) に巻きつけて (電極、約 23 ターンごと 21 cm) バー コアし、誘導電界を作成する柔軟なエリアの反対側に配置で構築されて電気刺激。メカニカル ストレッチ サポートに埋め込まれた磁石と培養プレートの横にある、および移動のアルミ製アームに外部の磁石の磁力によって実現されます。このように、無菌バリアを壊すことがなく細胞サポートを拡張できます。このアプローチは、細胞膜に適していますが、三次元構造体に適応することができます。
さらに、規則的なパターンされない可能性があります、セルがシードされて印刷ルールド回折格子 (1,250 溝/mm) を使用します。その透明性と 0.5 mm 厚のため明視野と蛍光顕微鏡下で PDMS 構築する上で培養した細胞の直接可視化が可能です。PDMS 培養プールがある現在のケースでは、セル間の電場勾配を最小化する電界に垂直にセルを配置する、伸縮力に垂直な垂直面パターン。
図 1は、構成や刺激のために使用されるデバイスの詳細な説明を示します。PDMS を構築し、ストレッチ (図 1 a, B) のセルの特性が最適化されています。刺激は、PDMS の構成要素に接続されているセルに必要な電気的・機械的刺激の効果的なアプリケーションの検証します。このプロセスでは、ソフトウェアのインターフェイス (図 1、D) を通じて良い接続とユーザー操作性を確保する含まれています。
細胞刺激このカスタムメイドのデバイスを使用するための手順はプロトコル」に記載されています。
Protocol
Representative Results
Discussion
電気刺激は、敵対心環境の細胞を準備および心臓のコミットメントの強化の安全な代替案のように見えます。ここでは、プロトコルの主な心臓マーカーの発現を増加され、心臓前駆細胞で説明報告梗塞マウス心筋30次の注入のために有益であること。一般に、電気機械的刺激の心臓 ATDPCs は早期に関連、構造解析、遺伝子やカルシウム調節前の電気的または機械的刺激と個別…
Disclosures
The authors have nothing to disclose.
Acknowledgements
著者は、ICREC 研究プログラム (IGTP、バダロナ) と電子と生体計測グループ (UPC、バルセロナ)、特に教授 J. Rosell ・ フェレールのメンバーに感謝したいです。さらに、著者認める幹細胞トランスレーショナル医学ジャーナルと以前公表数値 (Llucià Valldeperas、らの適応を許可するための AlphaMed プレス30). このプロトタイプの開発とプロトコルのデザインは Ministerio デ Educación y サイエンス (SAF 2008-05144) Ministerio デ Economía y Competitividad (SAF 2014 59892)、欧州委員会によって支えられた第 7 フレームワーク プログラム (RECATABI、NMP3-SL-2009-229239)、読書用ラ Marató デ TV3 (080330、201516、201502)、フンダシオン ・ パラ ・ ラ Innovación y ラ Prospectiva en サラッド en エスパーニャ (FIPSE; 06 00001396 15)。
Materials
| Stimulator | |||
| nickel plated neodymium magnets | Supermagnete | Q-10-10-05-N | |
| nickel-plated neodymium magnets | Supermagnete | Q-06-04-02-HN | |
| polydimethylsiloxane (PDMS) SYLGAR 184 Silicone Elastomer Kit | Dow Corning Corp | 184 | |
| ruled diffraction grating (1250 grooves/mm) | Newport | 05RG150-1250-2 | |
| Motor controller | Faulhaber | MCLM-3006-S | |
| Labview | National Instruments | ||
| Cell culture | |||
| phosphate-buffered saline (PBS) | Gibco | 70013-065 | |
| 0.05% trypsin-EDTA | Gibco | 25300-120 | |
| 35 mm cell culture dish | BD Falcon | 45353001 | |
| fetal bovine serum (FBS) | Gibco | 10270-106 | |
| L-Glutamine 200 mM, 100x | Gibco | 25030-024 | |
| Penicilina/Streptomicine, 10.000 U/mL | Gibco | 15140-122 | |
| Minimum essential medium eagle (alfa-MEM) | Sigma | M4526-24x500ML | |
| Protein & RNA analyses | |||
| protease inhibitor cocktail | Sigma | P8340 | |
| QIAzol Lysis Reagent | Qiagen | 79306 | |
| AllPrep RNA/Protein Kit | Qiagen | 50980404 | |
| Rneasy mini kit | Qiagen | 74104 | |
| iTaq Universal Probes One-Step Kit | Bio-Rad Laboratories | 172-5140 | |
| Random hexamers | Qiagen | 79236 | |
| TaqMan PreAmp MasterMix 2X | Applied Biosystems | 4391128 | |
| TaqMan Universal PCR MasterMix | Applied Biosystems | 4324018 | |
| Immunostaining | |||
| 10% formalin | Sigma | HT-501128-4L | |
| horse serum | Sigma | H1138 | |
| Triton X-100 | Sigma | X100-500ML | |
| Bovine Serum Albumina (BSA) | Sigma | A7906-100G | |
| PARAFILM | Sigma | P6543 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| Phalloidin Alexa 568 | Invitrogen | A12380 | |
| sodium azide | Sigma | S8032-100g | |
| Hoechst 33342 | Sigma | 14533 | |
| Connexin-43 rabbit primary antibody | Sigma | C6219 lot#061M4823 | |
| sarcomeric α-actinin mouse primary antibody | Sigma | A7811 lot#080M4864 | |
| GATA-4 goat primary antibody | R&D | AF2606 VAZ0515101 | |
| MEF2 rabbit primary antibody | Santa Cruz | sc-313 lot#E0611 | |
| SERCA2 goat primary antibody | Santa Cruz | sc-8095 lot#D2709 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 711-165-152 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 715-165-151 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 712-165-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 715-225-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 711-225-152 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 705-225-147 |
References
- McDonough, P. M., Glembotski, C. C. Induction of atrial natriuretic factor and myosin light chain-2 gene expression in cultured ventricular myocytes by electrical stimulation of contraction. Journal of Biological Chemistry. 267, 11665-11668 (1992).
- Tandon, N., et al. Electrical stimulation systems for cardiac tissue engineering. Nature Protocols. 4, 155-173 (2009).
- Serena, E., et al. Electrical stimulation of human embryonic stem cells: cardiac differentiation and the generation of reactive oxygen species. Experimental Cell Research. 315, 3611-3619 (2009).
- Tandon, N., et al. Optimization of electrical stimulation parameters for cardiac tissue engineering. Journal of Tissue Engineering and Regenerative Medicine. 5, 115-125 (2011).
- Zhang, X., Wang, Q., Gablaski, B., Lucchesi, P., Zhao, Y. A microdevice for studying intercellular electromechanical transduction in adult cardiac myocytes. Lab on a Chip. 13, 3090-3097 (2013).
- Chan, Y. C., et al. Electrical stimulation promotes maturation of cardiomyocytes derived from human embryonic stem cells. Journal of Cardiovascular Translational Research. 6, 989-999 (2013).
- Pietronave, S., et al. Monophasic and biphasic electrical stimulation induces a precardiac differentiation in progenitor cells isolated from human heart. Stem Cells and Development. 23, 888-898 (2014).
- Pavesi, A., et al. Electrical conditioning of adipose-derived stem cells in a multi-chamber culture platform. Biotechnology and Bioengineering. 111, 1452-1463 (2014).
- Baumgartner, S., et al. Electrophysiological and morphological maturation of murine fetal cardiomyocytes during electrical stimulation in vitro. Journal of Cardiovascular Pharmacology and Therapeutics. 20, 104-112 (2015).
- Llucià-Valldeperas, A., et al. Electrical stimulation of cardiac adipose tissue-derived progenitor cells modulates cell phenotype and genetic machinery. Journal of Tissue Engineering and Regenerative Medicine. 9 (11), 76-83 (2015).
- Llucià-Valldeperas, A., et al. Physiological conditioning by electric field stimulation promotes cardiomyogenic gene expression in human cardiomyocyte progenitor cells. Stem Cell Research and Therapy. 5, 93 (2014).
- Radisic, M., et al. Functional assembly of engineered myocardium by electrical stimulation of cardiac myocytes cultured on scaffolds. Proceedings of the National Academy of Sciences of the United States of America. 101 (52), 18129-18134 (2004).
- Fink, C., et al. Chronic stretch of engineered heart tissue induces hypertrophy and functional improvement. FASEB Journal. 14, 669-679 (2000).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature Medicine. 12 (4), 452-458 (2006).
- Birla, R. K., Huang, Y. C., Dennis, R. G. Development of a novel bioreactor for the mechanical loading of tissue-engineered heart muscle. Tissue Engineering. 13, 2239-2248 (2007).
- Salameh, A., et al. Cyclic mechanical stretch induces cardiomyocyte orientation and polarization of the gap junction protein connexin43. Circulation Research. 106, 1592-1602 (2010).
- Galie, P. A., Stegemann, J. P. Simultaneous application of interstitial flow and cyclic mechanical strain to a three-dimensional cell-seeded hydrogel. Tissue Engineering Part C: Methods. 17 (5), 527-536 (2011).
- Leychenko, A., Konorev, E., Jijiwa, M., Matter, M. L. Stretch-induced hypertrophy activates NFkB-mediated VEGF secretion in adult cardiomyocytes. PLoS One. 6, 29055 (2011).
- Tulloch, N. L., et al. Growth of engineered human myocardium with mechanical loading and vascular coculture. Circulation Research. 109, 47-59 (2011).
- Mihic, A., et al. The effect of cyclic stretch on maturation and 3D tissue formation of human embryonic stem cell-derived cardiomyocytes. Biomaterials. 35, 2798-2808 (2014).
- Llucià-Valldeperas, A., et al. Unravelling the effects of mechanical physiological conditioning on cardiac adipose tissue-derived progenitor cells in vitro and in silico. Scientific Reports. 8, 499 (2018).
- Stoppel, W. L., Kaplan, D. L., Black, L. D. Electrical and mechanical stimulation of cardiac cells and tissue constructs. Advanced Drug Delivery Reviews. 96, 135-155 (2016).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nature Methods. 10, 781-787 (2013).
- Barash, Y., et al. Electric field stimulation integrated into perfusion bioreactor for cardiac tissue engineering. Tissue Engineering Part C: Methods. 16, 1417-1426 (2010).
- Maidhof, R., et al. Biomimetic perfusion and electrical stimulation applied in concert improved the assembly of engineered cardiac tissue. Journal of Tissue Engineering and Regenerative Medicine. 6, 12-23 (2012).
- Feng, Z., et al. An electro-tensile bioreactor for 3-D culturing of cardiomyocytes. A bioreactor system that simulates the myocardium’s electrical and mechanical response in vivo. IEEE Engineering in Medicine and Biology Magazine. 24 (4), 73-79 (2005).
- Wang, B., et al. Myocardial scaffold-based cardiac tissue engineering: application of coordinated mechanical and electrical stimulations. Langmuir. 29 (35), 11109-11117 (2013).
- Morgan, K. Y., Black, L. D. Mimicking isovolumic contraction with combined electromechanical stimulation improves the development of engineered cardiac constructs. Tissue Engineering Part A. 20 (11-12), 1654-1667 (2014).
- Godier-Furnémont, A. F., et al. Physiologic force-frequency response in engineered heart muscle by electromechanical stimulation. Biomaterials. 60, 82-91 (2015).
- Llucià-Valldeperas, A., et al. Electromechanical Conditioning of Adult Progenitor Cells Improves Recovery of Cardiac Function After Myocardial Infarction. Stem Cell Translational Medicine. 6 (3), 970-981 (2017).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Gelmi, A., et al. Direct Mechanical Stimulation of Stem Cells: A Beating Electromechanically Active Scaffold for Cardiac Tissue Engineering. Advanced Healthcare Materials. 5 (12), 1471-1480 (2016).
- Poulin, A., et al. An ultra-fast mechanically active cell culture substrate. Scientific Reports. 8 (1), 9895 (2018).
- Bayes-Genis, A., et al. Human progenitor cells derived from cardiac adipose tissue ameliorate myocardial infarction in rodents. Journal of Molecular and Cellular Cardiology. 49 (5), 771-780 (2010).
- Bagó, J. R., et al. Bioluminescence imaging of cardiomyogenic and vascular differentiation of cardiac and subcutaneous adipose tissue-derived progenitor cells in fibrin patches in a myocardium infarct model. International Journal of Cardiology. 169, 288-295 (2013).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
- Rosell Ferrer, F. X., Sánchez Terrones, B., Bragós Bardia, R., Bayés Genís, A., Llucià Valldeperas, A. Methods and devices for mechanical and electrical stimulation of stem cell monolayer and 3d cultures for tissue engineering applications. Spanish patent. , (2013).
- Bayés Genís, A., Llucià Valldeperas, A., Soler Botija, C., Bragós Bardia, R., Rosell Ferrer, F. X. Method for Conditioning Stem Cells. Spanish patent. , (2017).
- Roura, S., Gálvez-Montón, C., Bayes-Genis, A. Myocardial healing using cardiac fat. Expert Review of Cardiovascular Therapy. 16 (4), 305-311 (2018).
- Zhang, Y. M., Hartzell, C., Narlow, M., Dudley, S. C. Stem cell-derived cardiomyocytes demonstrate arrhythmic potential. Circulation. 106 (10), 1294-1299 (2002).
- Liu, J., Fu, J. D., Siu, C. W., Li, R. A. Functional sarcoplasmic reticulum for calcium handling of human embryonic stem cell-derived cardiomyocytes: insights for driven maturation. Stem Cells. 25 (12), 3038-3044 (2007).
- Wipff, P. J., et al. The covalent attachment of adhesion molecules to silicone membranes for cell stretching applications. Biomaterials. 30 (9), 1781-1789 (2009).
- Kim, C. iPSC technology–Powerful hand for disease modeling and therapeutic screen. Biochemistry and Molecular Biology Reports. 48 (5), 256-265 (2015).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A Fast Track for Engineered Human Tissues in Drug Development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Bruyneel, A. A., McKeithan, W. L., Feyen, D. A., Mercola, M. Will iPSC-cardiomyocytes revolutionize the discovery of drugs for heart disease. Current Opinion inPharmacology. 42, 55-61 (2018).
- Farley, A., Johnstone, C., Hendry, C., McLafferty, E. Nervous system: part 1. Nursing Standard. 28 (31), 46-51 (2014).
- Brotto, M., Bonewald, L. Bone and muscle: Interactions beyond mechanical. Bone. 80, 109-114 (2015).
- Park, S. J., et al. Neurogenesis Is Induced by Electrical Stimulation of Human Mesenchymal Stem Cells Co-Cultured With Mature Neuronal Cells. Macromolecular Bioscience. 15 (11), 1586-1594 (2015).
- Vianney, J. M., Miller, D. A., Spitsbergen, J. M. Effects of acetylcholine and electrical stimulation on glial cell line-derived neurotrophic factor production in skeletal muscle cells. Brain Research. 1588, 47-54 (2014).
- Shima, A., Morimoto, Y., Sweeney, H. L., Takeuchi, S. Three-dimensional contractile muscle tissue consisting of human skeletal myocyte cell line. Experimental Cell Research. 370 (1), 168-173 (2018).

