Hücrelerin Cardiomyogenic potansiyeli geliştirmek için aynı anda elektrik ve mekanik stimülasyon
Summary
Burada elektrik ve mekanik uyaranlara kardiyak Fizyoloji taklit kullanan bir hücre kesimin eğitim için bir iletişim kuralı mevcut. Bu elektromekanik stimülasyon işlem görmüş hücreleri cardiomyogenic potansiyelini artırır ve daha fazla hücre tedavisi, hastalık modelleme ve uyuşturucu taraması için umut verici bir stratejidir.
Abstract
Kalp-damar hastalıkları gelişmiş ülkelerde ölüm önde gelen nedenidir. Sonuç olarak, etkili kardiyak hücre tedavileri için talep araştırmacılar kök hücre ve Biyomühendislik alanlarında vitro yüksek sadakat insan Miyokardiyum temel araştırma ve klinik uygulamaları geliştirmek için motive vardır. Ancak, kalp hücrelerinin olgunlaşmamış fenotip işlevsel olarak esas olarak mekanik ve elektrik sinyalleri tarafından karakterize yetişkin Miyokardiyum taklit doku alma konusunda bir kısıtlamadır. Böylece, bu iletişim kuralını amacı hazırlamak ve fizyolojik parametreler recapitulating hedef hücre nüfus ile elektromekanik stimülasyon, Olgun etmektir. Kalp doku mühendisliği daha fazla biyolojik yaklaşımlar doğru gelişen ve biyofiziksel uyaranlara üzerinde böylece, temel stratejileri ivme kazanmaktadır. Bu amaçla geliştirilen cihaz benzersiz ve özenle karakterize ve doğrulanmış bireysel ya da aynı anda elektrik ve mekanik stimülasyon sağlar. Buna ek olarak, metodoloji Bu uyarıcı ve belirli hücre nüfus için optimize edilmiş olsa da, bu kolayca diğer aygıtlar ve hücre hatları için adapte edilebilir. Sonuçları buraya elektromekanik stimülasyon sonra hücre nüfusunun artan kalp taahhüt kanıtı sunuyoruz. Elektromekanik teşvik hücreleri artan bir ifade ana kardiyak Marker, erken, yapısal ve kalsiyum düzenleyen genler de dahil olmak üzere gösterir. Bu hücre Klima daha da rejeneratif hücre tedavisi, hastalık modelleme ve yüksek-den geçerek uyuşturucu tarama için yararlı olabilir.
Introduction
Kalp fonksiyonu elektrik uyarma ve mekanik daralma kaplin temel alır. Kısaca, cardiomyocyte hücreler arası kavşak neredeyse zaman uyumlu kasılma kalbin pompa kan sistemik ve pulmoner sistemi aracılığıyla üretmek için elektrik sinyali yayma izin verir. Kalp hücreleri, bu nedenle, gen ifade ve hücresel fonksiyon düzenleyen elektrik ve mekanik Kuvvetleri tabi. Buna göre birçok grup mekanik ve elektrik stimülasyon kalp geliştirme, işlev ve olgunlaşma rolünü anlamak için kardiyak fizyolojik ortamı taklit kültür platformları geliştirilmesi için çalıştılar. Vitro elektrik ve mekanik elektrodlar tek tek kapsamlı işlevsel özellikleri geliştirmek, hücre olgunlaşma artırmak veya hücre-hücre kaplin ve kalsiyum1 işleme geliştirmek için kalp doku mühendisliği uygulanan , 2 , 3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 , 19 , 20 , 21. yine de, zaman uyumlu elektromekanik Klima gelişmekte olan bir uyarıcı ve protokol bir meydan okuma ve zorunlu optimizasyonu22yüzünden unexploited kalır.
Ön çalışma olarak bir arada elektriksel stimülasyon ve medya perfüzyon elektromekanik stimülasyon hitaben; Ancak, akışı zorlanma tabanlı deformasyon ventriküler dolum23,24,25/ tipik anlamına gelmez. Daha sonra daha fazla fizyolojik yaklaşımlar elektriksel uyaranlar fiziksel deformasyon ya da isovolumetric kasılma26,27,28,29,30 taklit etmek için streç ile birlikte ,31. Feng vd açıklanan Gelişmiş cardiomyocyte boyut ve contractile özelliklerini26raporlama 2005 yılında elektromekanik uyarım ilk gösteri. Wang vd mezenkimal kök hücre ile 5-azacytidine ön işleme ve aynı anda elektrik ve mekanik Klima, recellularization, hücre canlılığı, kardiyak farklılaşma ve27remodeling doku iyileştirilmesi uygulanan. Bu yayınlar beri daha fazla grup hücre monolayers elektromekanik uyarılması bildirilen veya doku (örneğin, siyah28, Vunjak-Novakovic29,31ve bizim grup30) ile mühendislik ilk şartına hücreleri içinde vivo30test. Kısaca, Morgan ve siyah gecikmeli kombine elektromekanik stimülasyon en iyi sonuçları28vermiştir çünkü elektrodlar arasındaki zamanlama çok önemli raporlama elektrik ve mekanik uyaranlara, birkaç kombinasyon test. Ardından, Godier-Furnémont ve ortak bir elektromekanik stimülasyon Protokolü mühendislik kalp kas yapıları yenidoğan sıçan kalp hücreleri için en iyi duruma getirilmiş ve elde, ilk kez bir pozitif güç frekanslı ilişki29. Daha sonra bizim grup ana kalp işaretleri vitro ifade elektromekanik preconditioned hücreleri artmış ve geniş yararlı içinde vivo etkileri, kardiyak fonksiyon gibi geliştirilmiş veya enfarktüsü gemi yoğunluğu artmış bildirdi sınır bölgesi30. En son yayın kök hücre kaynaklı cardiomyocytes kardiyak dokulardan bir olgunlaşma düzeyi yakın insan yetişkin kalp yapısı ve fonksiyonu31ulaştı elektromekanik Klima tabi gösterdi. Buna ek olarak, alternatif üç boyutlu stimülasyon platformları sağlamak elektrik, mekanik electroactive iskele oluşturan ve32topografik cues hücrelere bağlı. Ayrıca, mekanik deformasyon (hücre monolayer germe ve sıkıştırma) ayrıca normal fizyolojik şartlarda yanı sıra dışı koşullarda33taklit gerilebilir elektrotlar ile indüklenen.
Bu nedenle, mantığı fizyolojik koşullara göre tüp bebek elektromekanik uyaranlara bir hücre cardiomyogenic potansiyelini geliştirmek. Gerçekten de, bu uyarımı daha fazla klinik senaryosunda Miyokardiyum içine terapötik hücre entegrasyonlar parası veya doku olgunlaşma uyuşturucu-perdeleme uygulamaları için-artırmak.
Buna ek olarak, izole ve kardiyak insan Yağ dokusundan elde edilen progenitör hücrelerin nüfusu ile karakterize kökenli (kardiyak ATDPCs)34. Bu hücreler epicardial yağında bulunur. Bu hücreler miyokard infarktüsü tedavisinde yararlı histopatolojik ve fonksiyonel etkileri görüntülemek ve ayrıca kalp ve endotel farklılaşması potansiyel korumak. 30 , 35. bu faydaları sonra biyofizik stimülasyon artıracak ki biz onaylanmadığına karar.
Sonuç olarak, biz bir aygıt ve stimülasyon rejimi hücre nüfus ilgi için geliştirilen ve etkileri araştırıldı. Elektromekanik bu iletişim kuralı etkin hücrenin steril bir şekilde uzanan ikna etmek için yeni bir strateji ve noninvazif önceki yayınları36, elektrik alanı stimülasyon ile birlikte karşılaştırıldığında. Rapor burada teknik cihaz ve hücreleri elektrik, mekanik ve elektromekanik uyarılması için kullanılan yöntem ayrıntılı olarak açıklanmaktadır.
Bu cihaz elektrik ve mekanik stimülasyon, bağımsız olarak veya aynı anda sağlar. Stimülasyon presterilized hücre destek, bir standart kültür plaka ve mekanik ve elektrik Kuvvetleri (Şekil 1) indükler bir platform yerleştirilen elektrotlar noninvaziv ve aseptik yeni bir yaklaşım ile gerçekleştirilir.
Platform ilâ altı kültür tabaklar ve bir sandviç yapı lazerle kesilmiş poly(methyl methacrylate) ve baskılı devre kartı parçaları oluşur tutabilir. Platform prototip bir monophasic programlanabilir bilgisayar kontrollü elektrikli uyarıcı, baskılı devre kartı elektrotlar ve yer altı 10 mm x 10 mm x 5 mm nikel kaplama Neodimyum sabit mıknatıslar sağlam bağlantı için bir arada kullanır bir tarafı kültür plakaların. Bir alüminyum çubuğu kültür plakaları öbür önüne yerleştirilir ve doğrusal bir rediktördür ile taşındı altı itici mıknatıslar (aynı modeli) da vardır. Motor bir RS-232 portu üzerinden ticari yazılım tarafından işletilen bir motor kontrolörü tarafından tahrik edilmektedir ( Tablo reçetesigörmek). Kullanıcı arabirimi ve programlanabilir Stimülatörü elektrik yoğunluğu, darbe süresi ve sıklığı, mekanik stimülasyon, onun iş hacmi, bakliyat, darbe genlik (mıknatıs gezi), sayısı sıklığını programlamak mümkün olduğunu ve yamaç.
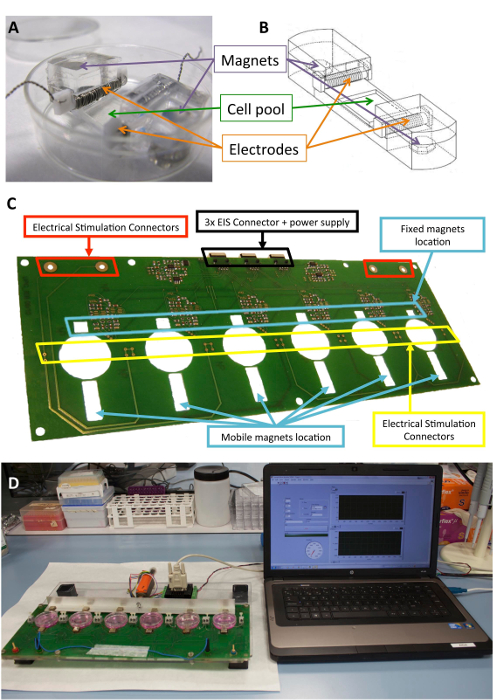
Resim 1 : Elektromekanik Stimülatörü. Hücre Klima için kullanılır (A) PDMS yapısı. (B) elektrodları ve mıknatıslar gibi PDMS yapı çiziminin. Elektromekanik Klima gerçekleştirmek için kullanılan baskılı devre kartı (platform) (C) detay. Bu panel Llucià-Valldeperas değiştirildi vd.30. (D) resmi elektromekanik stimülasyon platform ve Kullanıcı arabirimi (bilgisayar). Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Uyarıcı ve elektromekanik Klima için yöntemi tam olarak iki uluslararası patent, WO-2013185818-A137 ve WO-2017125159-A138anlatılmıştır.
Hücreler, elektrotlar ve mıknatıslar için yapısal destek sağlamak üzere tasarlanmıştır yapıları olmuştur biyouyumlu silikon daha önce açıklanan10,21. Kısaca, kalıp ve fizyolojik düzeyleri yakın 1.3 MPa, bir Young katsayısı ile Oda sıcaklığında tedavi polydimethylsiloxane (PDMS) oluşur. İki iç enine yuvaları elektrotlar tutmak için ve iki 6 x 2 mm x 4 mm nikel kaplama Neodimyum mıknatıslar gömülü, bir hücre kültür Havuzu (10 x 10 x 2 mm) esnek bir alanda inşa içerir. Elektrotlar bir 2 x 3 mm x 12 mm politetrafloroetilin (PTFE) etrafında bükülmüş mm platin tel elektrot, yaklaşık 23 döner her (21 cm) bar çekirdek ve ters tarafı ikna için bir elektrik alanı oluşturmak için esnek çevrenin yer 0,2 ile inşa edilir elektriksel stimülasyon. Mekanik germe çekmek içinde gömülü mıknatıslar ve yanındaki kültür plaka ve hareketli alüminyum kol üzerine yerleştirilmiş dış mıknatıslar arasındaki manyetik çekim yoluyla elde edilir. Bu şekilde, cep destek steril bariyer bozmadan genişletilebilir. Bu yaklaşım bir hücre monolayer için uygundur ama üç boyutlu yapıları için de adapte.
Buna ek olarak, düzenli bir desen çizgili bir kırınım ızgara (1,250 oluklar/mm) kullanarak nerede hücreleri tohumlari, baskılı olabilir. Aydınlık alan ve floresan mikroskoplar altında PDMS yapı üzerinde kültürlü hücreleri doğrudan görselleştirme olan şeffaflık ve 0,5 mm kalınlığı nedeniyle mümkündür. Geçerli durumda dikey bir yüzey deseni, dik dik hücrelere hücre boyunca elektrik alanı degrade en aza indirir elektrik alanı hizalamak için germe kuvvetleri, PDMS kültür havuzu vardır.
Şekil 1 yapı ve stimülasyon için kullanılan aygıt ayrıntılı bir açıklamasını gösterir. PDMS oluşturmak ve özellikleri (Şekil 1A, B) uzanan hücre için optimize edilmiştir. Uyarıcı geliştirilen ve istenen elektrik ve mekanik stimülasyon PDMS yapı bağlı hücrelere etkili uygulanması için doğrulanmış. Bu işlem yazılım arabirimi (Şekil 1 c, D) iyi bağlantı ve Kullanıcı işlerliğini sağlamak içerir.
Bu özel cihaz kullanarak hücre uyarılması için yordam Protokolü bölümünde anlatılan.
Protocol
Representative Results
Discussion
Elektromekanik stimülasyon hücreleri için düşman bir kardiyak ortamı hazırlama ve kardiyak bağlılıklarını artırılması için güvenli bir alternatif gibi görünüyor. Burada, kardiyak progenitör hücrelerin ana kalp işaretleri ifade ve oldu için açıklanan bir protokol hazır fare Miyokardiyum30sonraki onların Uygulanılmasından için yararlı olacağı bildirildi. Genel olarak, elektromekanik uyarılmış kardiyak ATDPCs genler ile ilgili erken, yapısal ve asla önceki elekt…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Yazarlar ICREC araştırma programı (IGTP, Badalona) ve elektronik ve Biyomedikal araçları grubu (UPC, Barcelona), özellikle Prof. J. niepyszny-Ferrer üyeleri teşekkür etmek istiyorum. Buna ek olarak, yazarlar kabul kök hücre translasyonel Tıp Dergisi ve AlphaMed daha önce yayımlanan rakamlar (Llucià-Valldeperas, et al. uyarlaması izin vermek için basın 30). bu prototip geliştirme ve tasarım iletişim kuralının “gayri resmi” de Educación y Ciencia (SAF 2008-05144), “gayri resmi” de Economía y Competitividad (SAF 2014-59892), Avrupa Komisyonu tarafından desteklenen 7. Çerçeve Programı () RECATABI, NMP3-SL-2009-229239), Fundació La Marató de TV3 (080330, 201516, 201502) ve Fundacion para la Innovación y la Prospectiva tr Salud tr España (FIPSE; 06-00001396-15).
Materials
| Stimulator | |||
| nickel plated neodymium magnets | Supermagnete | Q-10-10-05-N | |
| nickel-plated neodymium magnets | Supermagnete | Q-06-04-02-HN | |
| polydimethylsiloxane (PDMS) SYLGAR 184 Silicone Elastomer Kit | Dow Corning Corp | 184 | |
| ruled diffraction grating (1250 grooves/mm) | Newport | 05RG150-1250-2 | |
| Motor controller | Faulhaber | MCLM-3006-S | |
| Labview | National Instruments | ||
| Cell culture | |||
| phosphate-buffered saline (PBS) | Gibco | 70013-065 | |
| 0.05% trypsin-EDTA | Gibco | 25300-120 | |
| 35 mm cell culture dish | BD Falcon | 45353001 | |
| fetal bovine serum (FBS) | Gibco | 10270-106 | |
| L-Glutamine 200 mM, 100x | Gibco | 25030-024 | |
| Penicilina/Streptomicine, 10.000 U/mL | Gibco | 15140-122 | |
| Minimum essential medium eagle (alfa-MEM) | Sigma | M4526-24x500ML | |
| Protein & RNA analyses | |||
| protease inhibitor cocktail | Sigma | P8340 | |
| QIAzol Lysis Reagent | Qiagen | 79306 | |
| AllPrep RNA/Protein Kit | Qiagen | 50980404 | |
| Rneasy mini kit | Qiagen | 74104 | |
| iTaq Universal Probes One-Step Kit | Bio-Rad Laboratories | 172-5140 | |
| Random hexamers | Qiagen | 79236 | |
| TaqMan PreAmp MasterMix 2X | Applied Biosystems | 4391128 | |
| TaqMan Universal PCR MasterMix | Applied Biosystems | 4324018 | |
| Immunostaining | |||
| 10% formalin | Sigma | HT-501128-4L | |
| horse serum | Sigma | H1138 | |
| Triton X-100 | Sigma | X100-500ML | |
| Bovine Serum Albumina (BSA) | Sigma | A7906-100G | |
| PARAFILM | Sigma | P6543 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| Phalloidin Alexa 568 | Invitrogen | A12380 | |
| sodium azide | Sigma | S8032-100g | |
| Hoechst 33342 | Sigma | 14533 | |
| Connexin-43 rabbit primary antibody | Sigma | C6219 lot#061M4823 | |
| sarcomeric α-actinin mouse primary antibody | Sigma | A7811 lot#080M4864 | |
| GATA-4 goat primary antibody | R&D | AF2606 VAZ0515101 | |
| MEF2 rabbit primary antibody | Santa Cruz | sc-313 lot#E0611 | |
| SERCA2 goat primary antibody | Santa Cruz | sc-8095 lot#D2709 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 711-165-152 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 715-165-151 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 712-165-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 715-225-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 711-225-152 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 705-225-147 |
References
- McDonough, P. M., Glembotski, C. C. Induction of atrial natriuretic factor and myosin light chain-2 gene expression in cultured ventricular myocytes by electrical stimulation of contraction. Journal of Biological Chemistry. 267, 11665-11668 (1992).
- Tandon, N., et al. Electrical stimulation systems for cardiac tissue engineering. Nature Protocols. 4, 155-173 (2009).
- Serena, E., et al. Electrical stimulation of human embryonic stem cells: cardiac differentiation and the generation of reactive oxygen species. Experimental Cell Research. 315, 3611-3619 (2009).
- Tandon, N., et al. Optimization of electrical stimulation parameters for cardiac tissue engineering. Journal of Tissue Engineering and Regenerative Medicine. 5, 115-125 (2011).
- Zhang, X., Wang, Q., Gablaski, B., Lucchesi, P., Zhao, Y. A microdevice for studying intercellular electromechanical transduction in adult cardiac myocytes. Lab on a Chip. 13, 3090-3097 (2013).
- Chan, Y. C., et al. Electrical stimulation promotes maturation of cardiomyocytes derived from human embryonic stem cells. Journal of Cardiovascular Translational Research. 6, 989-999 (2013).
- Pietronave, S., et al. Monophasic and biphasic electrical stimulation induces a precardiac differentiation in progenitor cells isolated from human heart. Stem Cells and Development. 23, 888-898 (2014).
- Pavesi, A., et al. Electrical conditioning of adipose-derived stem cells in a multi-chamber culture platform. Biotechnology and Bioengineering. 111, 1452-1463 (2014).
- Baumgartner, S., et al. Electrophysiological and morphological maturation of murine fetal cardiomyocytes during electrical stimulation in vitro. Journal of Cardiovascular Pharmacology and Therapeutics. 20, 104-112 (2015).
- Llucià-Valldeperas, A., et al. Electrical stimulation of cardiac adipose tissue-derived progenitor cells modulates cell phenotype and genetic machinery. Journal of Tissue Engineering and Regenerative Medicine. 9 (11), 76-83 (2015).
- Llucià-Valldeperas, A., et al. Physiological conditioning by electric field stimulation promotes cardiomyogenic gene expression in human cardiomyocyte progenitor cells. Stem Cell Research and Therapy. 5, 93 (2014).
- Radisic, M., et al. Functional assembly of engineered myocardium by electrical stimulation of cardiac myocytes cultured on scaffolds. Proceedings of the National Academy of Sciences of the United States of America. 101 (52), 18129-18134 (2004).
- Fink, C., et al. Chronic stretch of engineered heart tissue induces hypertrophy and functional improvement. FASEB Journal. 14, 669-679 (2000).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature Medicine. 12 (4), 452-458 (2006).
- Birla, R. K., Huang, Y. C., Dennis, R. G. Development of a novel bioreactor for the mechanical loading of tissue-engineered heart muscle. Tissue Engineering. 13, 2239-2248 (2007).
- Salameh, A., et al. Cyclic mechanical stretch induces cardiomyocyte orientation and polarization of the gap junction protein connexin43. Circulation Research. 106, 1592-1602 (2010).
- Galie, P. A., Stegemann, J. P. Simultaneous application of interstitial flow and cyclic mechanical strain to a three-dimensional cell-seeded hydrogel. Tissue Engineering Part C: Methods. 17 (5), 527-536 (2011).
- Leychenko, A., Konorev, E., Jijiwa, M., Matter, M. L. Stretch-induced hypertrophy activates NFkB-mediated VEGF secretion in adult cardiomyocytes. PLoS One. 6, 29055 (2011).
- Tulloch, N. L., et al. Growth of engineered human myocardium with mechanical loading and vascular coculture. Circulation Research. 109, 47-59 (2011).
- Mihic, A., et al. The effect of cyclic stretch on maturation and 3D tissue formation of human embryonic stem cell-derived cardiomyocytes. Biomaterials. 35, 2798-2808 (2014).
- Llucià-Valldeperas, A., et al. Unravelling the effects of mechanical physiological conditioning on cardiac adipose tissue-derived progenitor cells in vitro and in silico. Scientific Reports. 8, 499 (2018).
- Stoppel, W. L., Kaplan, D. L., Black, L. D. Electrical and mechanical stimulation of cardiac cells and tissue constructs. Advanced Drug Delivery Reviews. 96, 135-155 (2016).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nature Methods. 10, 781-787 (2013).
- Barash, Y., et al. Electric field stimulation integrated into perfusion bioreactor for cardiac tissue engineering. Tissue Engineering Part C: Methods. 16, 1417-1426 (2010).
- Maidhof, R., et al. Biomimetic perfusion and electrical stimulation applied in concert improved the assembly of engineered cardiac tissue. Journal of Tissue Engineering and Regenerative Medicine. 6, 12-23 (2012).
- Feng, Z., et al. An electro-tensile bioreactor for 3-D culturing of cardiomyocytes. A bioreactor system that simulates the myocardium’s electrical and mechanical response in vivo. IEEE Engineering in Medicine and Biology Magazine. 24 (4), 73-79 (2005).
- Wang, B., et al. Myocardial scaffold-based cardiac tissue engineering: application of coordinated mechanical and electrical stimulations. Langmuir. 29 (35), 11109-11117 (2013).
- Morgan, K. Y., Black, L. D. Mimicking isovolumic contraction with combined electromechanical stimulation improves the development of engineered cardiac constructs. Tissue Engineering Part A. 20 (11-12), 1654-1667 (2014).
- Godier-Furnémont, A. F., et al. Physiologic force-frequency response in engineered heart muscle by electromechanical stimulation. Biomaterials. 60, 82-91 (2015).
- Llucià-Valldeperas, A., et al. Electromechanical Conditioning of Adult Progenitor Cells Improves Recovery of Cardiac Function After Myocardial Infarction. Stem Cell Translational Medicine. 6 (3), 970-981 (2017).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Gelmi, A., et al. Direct Mechanical Stimulation of Stem Cells: A Beating Electromechanically Active Scaffold for Cardiac Tissue Engineering. Advanced Healthcare Materials. 5 (12), 1471-1480 (2016).
- Poulin, A., et al. An ultra-fast mechanically active cell culture substrate. Scientific Reports. 8 (1), 9895 (2018).
- Bayes-Genis, A., et al. Human progenitor cells derived from cardiac adipose tissue ameliorate myocardial infarction in rodents. Journal of Molecular and Cellular Cardiology. 49 (5), 771-780 (2010).
- Bagó, J. R., et al. Bioluminescence imaging of cardiomyogenic and vascular differentiation of cardiac and subcutaneous adipose tissue-derived progenitor cells in fibrin patches in a myocardium infarct model. International Journal of Cardiology. 169, 288-295 (2013).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
- Rosell Ferrer, F. X., Sánchez Terrones, B., Bragós Bardia, R., Bayés Genís, A., Llucià Valldeperas, A. Methods and devices for mechanical and electrical stimulation of stem cell monolayer and 3d cultures for tissue engineering applications. Spanish patent. , (2013).
- Bayés Genís, A., Llucià Valldeperas, A., Soler Botija, C., Bragós Bardia, R., Rosell Ferrer, F. X. Method for Conditioning Stem Cells. Spanish patent. , (2017).
- Roura, S., Gálvez-Montón, C., Bayes-Genis, A. Myocardial healing using cardiac fat. Expert Review of Cardiovascular Therapy. 16 (4), 305-311 (2018).
- Zhang, Y. M., Hartzell, C., Narlow, M., Dudley, S. C. Stem cell-derived cardiomyocytes demonstrate arrhythmic potential. Circulation. 106 (10), 1294-1299 (2002).
- Liu, J., Fu, J. D., Siu, C. W., Li, R. A. Functional sarcoplasmic reticulum for calcium handling of human embryonic stem cell-derived cardiomyocytes: insights for driven maturation. Stem Cells. 25 (12), 3038-3044 (2007).
- Wipff, P. J., et al. The covalent attachment of adhesion molecules to silicone membranes for cell stretching applications. Biomaterials. 30 (9), 1781-1789 (2009).
- Kim, C. iPSC technology–Powerful hand for disease modeling and therapeutic screen. Biochemistry and Molecular Biology Reports. 48 (5), 256-265 (2015).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A Fast Track for Engineered Human Tissues in Drug Development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Bruyneel, A. A., McKeithan, W. L., Feyen, D. A., Mercola, M. Will iPSC-cardiomyocytes revolutionize the discovery of drugs for heart disease. Current Opinion inPharmacology. 42, 55-61 (2018).
- Farley, A., Johnstone, C., Hendry, C., McLafferty, E. Nervous system: part 1. Nursing Standard. 28 (31), 46-51 (2014).
- Brotto, M., Bonewald, L. Bone and muscle: Interactions beyond mechanical. Bone. 80, 109-114 (2015).
- Park, S. J., et al. Neurogenesis Is Induced by Electrical Stimulation of Human Mesenchymal Stem Cells Co-Cultured With Mature Neuronal Cells. Macromolecular Bioscience. 15 (11), 1586-1594 (2015).
- Vianney, J. M., Miller, D. A., Spitsbergen, J. M. Effects of acetylcholine and electrical stimulation on glial cell line-derived neurotrophic factor production in skeletal muscle cells. Brain Research. 1588, 47-54 (2014).
- Shima, A., Morimoto, Y., Sweeney, H. L., Takeuchi, S. Three-dimensional contractile muscle tissue consisting of human skeletal myocyte cell line. Experimental Cell Research. 370 (1), 168-173 (2018).

