مضان المجهر لات الداخلي ATP بوساطة Macropinocytosis في خلايا الورم البشري والفئران الورم xenografted
Summary
طورنا طريقة قابلة للاستنساخ لتصور استيعاب ثلاثي الفوسفات ثلاثي الأدينوزين الفلوري غير القابل للهيدروليزين (ATP)، وهو بديل ATP، بدقة خلوية عالية. لقد أثبتنا صحة طريقتنا باستخدام المختبر المستقل وفي أجهزة قياس الجسم الحي وخطوط خلايا الورم البشرية والفئران ذات المناعة xenografted بأنسجة الورم البشري.
Abstract
أدينوسين ثلاثي الفوسفات (ATP), بما في ذلك ATP خارج الخلية (eATP), وقد ثبت أن تلعب أدوارا هامة في جوانب مختلفة من الورم, مثل مقاومة الأدوية, الانتقال الظهاري-المتوسطي (EMT), والانبثاث. eATP داخل الرحم هو 103 إلى 104 مرات أعلى في التركيز مما كانت عليه في الأنسجة العادية. في حين أن eATP يعمل كرسول لتنشيط الإشارات التنقية لتحريض EMT ، إلا أنه يتم استيعابه أيضا من قبل الخلايا السرطانية من خلال داء الماكروبينوسيتوزية الممضوم ، وهو نوع محدد من الغدد الصماء ، لأداء مجموعة واسعة من الوظائف البيولوجية. وتشمل هذه الوظائف توفير الطاقة لتفاعلات البيوكيميائية ATP التي تتطلب، والتبرع مجموعات الفوسفات أثناء نقل الإشارات، وتسهيل أو تسريع التعبير الجيني كمتبرع مساعد النسخ. ATP متاح بسهولة، والدراسة في السرطان وغيرها من المجالات سوف تزيد بلا شك. ومع ذلك، لا تزال دراسة eATP في مرحلة مبكرة، ولا تزال الأسئلة التي لم يتم حلها دون إجابة قبل أن يتم كشف الأنشطة الهامة ومتعددة الاستخدامات التي يقوم بها eATP وATP الداخلية بالكامل.
وتشمل مساهمات مختبرات هؤلاء المؤلفين في هذه الدراسات eATP في وقت مبكر التصوير المجهري من ATP الفلورسنت غير القابلة للتحلل، إلى جانب عالية ومنخفضة الجزيئية الوزن الفلورسنت دكسترانس، والتي هي بمثابة مثبطات التناضح الكلي والغدد الصماء، فضلا عن مثبطات الغدد الصماء المختلفة، لرصد وتوصيف عملية الاستيعاب eATP. تم تطبيق طريقة التصوير هذه على خطوط الخلايا السرطانية وعلى الفئران ذات المناعة ، التي تم نقلها بأورام سرطان الإنسان ، لدراسة استيعاب eATP في المختبر وفي الجسم الحي. تصف هذه الورقة هذه البروتوكولات في المختبر وفي الجسم الحي ، مع التركيز على تعديل وصقل شروط الفحص بحيث يمكن إجراء اختبارات الاستيعاب eATP بوساطة macropinocytosis /endocytosis بنجاح في أنظمة مختلفة.
Introduction
وقد تم مؤخرا امتصاص الانتهازية من المواد الغذائية خارج الخلية داخل الرحم (أي) اسمه السمة المميزة الرئيسية لعملية التمثيل الغذائي للسرطان1. واحدة من هذه العناصر الغذائية الهامة ATP، كما تركيز ieATP هو 103 و 104 مرات أعلى من تلك الموجودة في الأنسجة الطبيعية، في نطاق عدة مئات من ميكرومتر إلى mMمنخفضة 2،3،4،5. كجزيء الطاقة والإشارات الرئيسية، ATP يلعب دورا مركزيا في التمثيل الغذائي الخلوي في الخلايا السرطانية والصحية6،7،8. ATP خارج الخلية لا تشارك فقط في نمو الخلايا السرطانية, ولكنه يعزز أيضا مقاومة المخدرات9. وظائف ATP لم تكن معروفة من قبل، مثل النشاط الهيدروتروبيكي، وقد تم مؤخرا تحديد، وبالتالي تورط ATP في أمراض مثل الزهايمر10. في الواقع ، يبدو أن فهمنا ل ATP ووظائفه في الخلايا السرطانية والخلايا السليمة والخلايا المريضة الأخرى أبعد ما يكون عن الاكتمال. ومع ذلك ، بسبب عدم استقرار ATP وارتفاع معدلات الدوران في الخلايا ، فمن الصعب تقنيا مراقبة حركة ATP عبر غشاء الخلية وإلى الخلية.
لمعالجة هذه المشكلة وسد الحاجة إلى هذا المجال البحثي، تم تطوير طريقة حيث تم استخدام ATP الفلورية غير قابلة للهيدروليز (NHF-ATP)(الشكل 1)كبديل لتصور استيعاب ATP ومراقبة التعريب المكاني داخل الخلية من ATP الداخلي، سواء في المختبر وفي الجسم الحي11،12 . وقد ثبت NHF-ATP لتحل محل ATP الذاتية للتحقيق في حركة ATP عبر أغشية الخلايا الحيوانية، سواء في خطوط الخلايا السرطانية وفي أنسجة الورم البشري xenografted على الفئرانالمناعية 11،12. وعلاوة على ذلك، إدارة مثبطات macropinocytosis للخلايا منعت استيعاب eATP، مما يشير إلى أن امتصاص داخل الخلايا من eATP ينطوي على آلية الماكروبينوسيتوتيك9،11،12. يسمح هذا البروتوكول بتكبيل الكولابيل القائم على المناعة ضد البروتينات الخاصة بالخلايا وبالتالي تحديد نوع الخلية الذي يستوعب NHF-ATP. باستخدام في الجسم الحي xenografts الورم والمجهر عالية الدقة، NHF-ATP يمكن تصور مكانيا عبر عينة الأنسجة وحتى داخل خلية واحدة. تسمح هذه الطرق أيضا بالتحليل الكمي ، مثل النسبة المئوية لامتصاص الخلايا ، وعدد الحويصلات الماكروبينوسيتوتيكية ، وحركية الاستيعاب. تصف هذه الورقة بالتفصيل كيف يمكن استخدام NHF-ATP ، التي تعمل بمفردها أو مع dextrans الفلورية الانسطية13و14و15و16، في إعدادات تجريبية مختلفة لدراسة استيعاب ATP وتوطينها داخل الخلايا ، بعد الاستيعاب في الخلايا.
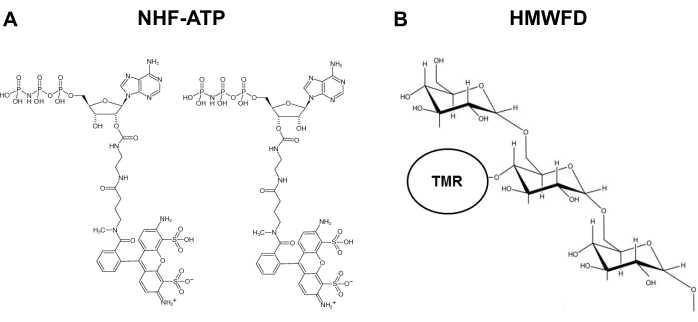
الشكل 1: هياكل ATP الفلورسنت غير قابلة للهيدروليزابل وtetrapmethylrhodamine المسمى عالية الوزن الجزيئي الفلورسنت dextran. (أ) هيكل NHF-ATP. (ب)التمثيل التخطيطي ل HMWFD. المختصرات: ATP = أدينوسين ثلاثي الفوسفات; NHF-ATP = ATP الفلورية غير قابلة للهيدروليز؛ TMR = رباعي ميثيل هودامين; HMWFD = ارتفاع الوزن الجزيئي الفلورسنت dextran. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
تم تطوير طريقة للتحليل المكاني والزمني والكمي للتدخيل الخلوي ل ATP غير القابل للهيدروليز. هذه الطريقة قابلة للتطبيق على نطاق واسع للاستخدام في النظم البيولوجية المتنوعة، بما في ذلك مختلف النماذج الورمية، والتي نقدم لها التعليم التقني والبيانات التمثيلية. للحصول على بيانات قابلة للتفسير ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
تم إجراء عملية استئصال الأعصاب في الموقع في جامعة أوهايو علم الأمراض الهستوباثولوجية الأساسية. وقد دعم هذا العمل جزئيا من قبل صناديق بدء التشغيل (جامعة أوهايو كلية الآداب والعلوم) إلى نيلسن C; المعاهد القومية للصحة منح R15 CA242177-01 وجائزة RSAC لX تشن.
Materials
| A549 cells, human lung epithelial, carcinoma | National Cancer Institute | n/a | Less expensive source |
| Acetone | Fisher Scientific | S25904 | |
| Aluminum foil, Reynolds | Grainger | 6CHG6 | |
| Aqueous Mounting Medium, ProLong Gold Anti-fade Reagent | ThermoFisher | P36930 | |
| ATP analog | Jena Biosciences | NK-101 | |
| Autoclave, sterilizer | Grainger | 33ZZ40 | |
| Blades, cryostat, high profile | C. L. Sturkey, Inc. | DT554550 | |
| Calipers, vernier | Grainger | 4KU77 | |
| Cell medium, Ham's Nutrient Mixture F12, serum-free | Millipore Sigma | 51651C-1000ML | |
| Centrifuge, refrigerated with swinging bucket rotor | Eppendorf | 5810R | |
| Chloroform | Acros Organics | 423555000 | |
| Conical tube, 15 mL | VWR | 21008-216 | |
| Conical tube, 50 mL | VWR | 21008-242 | |
| Coverslips, glass, 12 mm | Corning | 2975-245 | |
| Cryostat, Leica CM1950 | Leica Biosystems | CM1950 | |
| Delicate task wipe, Kim Wipes | Kimberly-Clark | 34155 | |
| Dextran, Lysine fixable, High Molecular Weight (HMW) | Invitrogen | D1818 | MW = 70,000, Tetramethylrhodamine |
| Dextran, Neutral, High Molecular Weight (HMW) | Invitrogen | D1819 | |
| Dulbecco's Modified Eagle Medium (DMEM), serum-free | Fisher Scientific | 11885076 | |
| Dry ice | Local delivery | Custom order | |
| Epifluorescent imaging system, Nikon NiU and Nikon NIS Elements acquisition software | Nikon | Custom order | |
| Ethanol | Fisher Scientific | BP2818-4 | |
| Fetal bovine serum (FBS) | ThermoFisher | 16000044 | |
| Forceps, Dumont #7, curved | Fine Science Tools | 11274-20 | |
| Forceps, Dumont #5, straight | Fine Science Tools | 11254-20 | |
| Gloves (small, medium, large) | Microflex | N191, N192, N193 | |
| Gloves, MAPA Temp-Ice 700 Thermal (for handling dry ice) | Fisher Scientific | 19-046-563 | |
| Hemocytometer | Daigger | EF16034F EA | |
| Incubator, cell culture | Eppendorf | Galaxy 170 S | |
| Labelling tape | Fisher Scientific | 159015R | |
| Marking pen, Sharpie (ultra-fine) | Staples | 642736 | |
| Mice, immunodeficient (Nu/J) | Jackson Laboratory | 2019 | |
| Microcentrifuge, accuSpin Micro17 | Fisher Scientific | 13-100-675 | |
| Microcentrifgue tubes, Eppendorf tubes (1.5 mL) | Axygen | MCT-150-C | |
| Microscope slide box | Fisher Scientific | 50-751-4983 | |
| Needle, 27 gauge | Becton-Dickinson | 752 0071 | |
| Paintbrush | Grainger | 39AL12 | |
| Paper towels | Staples | 33550 | |
| Paraformaldehyde | Acros Organics | 416785000 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Perforated spoon, 15 mm diameter, 135 mm length | Roboz Surgical Instrument Co. | RS-6162 | |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP3991 | |
| Pipet tips (10 μL) | Fisher Scientific | 02-707-438 | |
| Pipet tips (200 μL) | Fisher Scientific | 02-707-411 | |
| Pipet tips (1000 μL) | Fisher Scientific | 02-707-403 | |
| Pipets, serological (10 mL) | VWR | 89130-910 | |
| Pippetor, Gilson P2 | Daigger | EF9930A | |
| Pipettor Starter Kit, Gilson (2-10 μL, 20-200 μL, 200-1000 μL) | Daigger | EF9931A | |
| Platform shaker – orbital, benchtop | Cole-Parmer | EW-51710-23 | |
| Positively-charged microscope slides, Superfrost | Fisher Scientific | 12-550-15 | |
| Scalpel, size 10, Surgical Design, Inc. | Fisher Scientific | 22-079-707 | |
| Scissors, surgical – sharp, curved | Fine Science Tools | 14005-12 | |
| Software for image analysis, Nikon Elements | Nikon | Custom order | |
| Software for image analysis, ImageJ (FIJI) | National Institutes of Health | n/a | Download online (free) |
| Specimen disc 30 mm (chuck holder), cryostat accessory | Leica Biosystems | 14047740044 | |
| Staining tray, 245 mm BioAssay Dish | Corning | 431111 | |
| Syringe, 1 cc | Becton-Dickinson | 309623 | |
| Tape, laboratory, 19 mm width | Fisher Scientific | 15-901-5R | |
| Timer | Fisher Scientific | 14-649-17 | |
| Tissue culture dish, 100 x 15 mm diameter | Fisher Scientific | 08-757-100D | |
| Tissue culture flask, 225 cm2 | ThermoFisher | 159933 | |
| Tissue culture plate, 24-well | Becton-Dickinson | 353226 | |
| Tissue embedding mold, stainless steel | Tissue Tek | 4161 | |
| Tissue Freezing Medium, Optimal Cutting Temperature (OCT) | Fisher Scientific | 4585 | |
| Trypsin-EDTA (ethylenediaminetetraacetic acid), 0.25% | Gibco | 25200072 | |
| Water bath, Precision GP 2S | ThermoFisher | TSGP2S |
References
- Pavlova, N. N., Thompson, C. B. The emerging hallmarks of cancer metabolism. Cell Metabolism. 23 (1), 27-47 (2016).
- Pellegatti, P., et al. Increased level of extracellular ATP at tumor sites: in vivo imaging with plasma membrane luciferase. PLoS ONE. 3, 25992008 (2008).
- Falzoni, S., Donvito, G., Di Virgilio, F. Detecting adenosine triphosphate in the pericellular space. Interface Focus. 3 (3), 20120101 (2013).
- Michaud, M., et al. Autophagy-dependent anticancer immune responses induced by chemotherapeutic agents in mice. Science. 334, 1573-1577 (2011).
- Wilhelm, K., et al. Graft-versus-host disease is enhanced by extracellular ATP activating P2X7R. Nature Medicine. 16, 1434-1438 (2010).
- Vander Heiden, M. G., Cantley, L. C., Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324, 1029-1033 (2009).
- Cairns, R. A., Harris, I. S., Mak, T. W. Regulation of cancer cell metabolism. Nature Reviews Cancer. 11, 85-95 (2011).
- Chen, X., Qian, Y., Wu, S. The Warburg effect: evolving interpretations of an established concept. Free Radical Biology & Medicine. 79, 253-263 (2015).
- Wang, X., et al. Extracellular ATP, as an energy and phosphorylating molecule, induces different types of drug resistances in cancer cells through ATP internalization and intracellular ATP level increase. Oncotarget. 8 (5), 87860-87877 (2017).
- Patel, A., et al. ATP as a biological hydrotrope. Science. 356, 753-756 (2017).
- Qian, Y., et al. Extracellular ATP is internalized by macropinocytosis and induces intracellular ATP increase and drug resistance in cancer cells. Cancer Letters. 351, 242-251 (2014).
- Qian, Y., Wang, X., Li, Y., Cao, Y., Chen, X. Extracellular ATP a new player in cancer metabolism: NSCLC cells internalize ATP in vitro and in vivo using multiple endocytic mechanisms. Molecular Cancer Research. 14, 1087-1096 (2016).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497, 633-637 (2013).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biology International. 39, 531-539 (2015).
- Yanagawa, Y., Matsumoto, M., Togashi, H. Enhanced dendritic cell antigen uptake via alpha2 adrenoceptor-mediated PI3K activation following brief exposure to noradrenaline. Journal of Immunology. 185, 5762-5768 (2010).
- Hoppe, H. C., et al. Antimalarial quinolines and artemisinin inhibit endocytosis in Plasmodium falciparum. Antimicrobial Agents & Chemotherapy. 48, 2370-2378 (2004).
- Chaudry, I. H. Does ATP cross the cell plasma membrane. Yale Journal of Biology & Medicine. 55, 1-10 (1982).
- Pant, H. C., Terakawa, S., Yoshioka, T., Tasaki, I., Gainer, H. Evidence for the utilization of extracellular [gamma-32P]ATP for the phosphorylation of intracellular proteins in the squid giant axon. Biochimica et Biophysica Acta. 582, 107-114 (1979).
- Chaudry, I. H., Baue, A. E. Further evidence for ATP uptake by rat tissues. Biochimica et Biophysica Acta. 628, 336-342 (1980).
- Koppenol, W. H., Bounds, P. L., Dang, C. V. Otto Warburg’s contributions to current concepts of cancer metabolism. Nature Reviews Cancer. 11, 325-337 (2011).
- Dang, C. V. Links between metabolism and cancer. Genes & Development. 26, 877-890 (2012).
- Israelsen, W. J., Vander Heiden, M. G. ATP consumption promotes cancer metabolism. Cell. 143, 669-671 (2010).
- Koster, J. C., Permutt, M. A., Nichols, C. G. Diabetes and insulin secretion: the ATP-sensitive K+ channel (K ATP) connection. Diabetes. 54, 3065-3072 (2005).
- Szendroedi, J., et al. Muscle mitochondrial ATP synthesis and glucose transport/phosphorylation in type 2 diabetes. PLoS Medicine. 4, 154 (2007).
- Miyamoto, S., et al. Mass spectrometry imaging reveals elevated glomerular ATP/AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator. EBioMedicine. 7, 121-134 (2016).

