ヒト腫瘍細胞及び異種マウスにおけるマクロピノサイトシスにより媒介されるATP内在化のための蛍光顕微鏡
Summary
ATPサロゲートである非加水分解蛍光アデノシン三リン酸(ATP)の高い細胞分解能を可視化する再現性のある方法を開発しました。我々は、ヒト腫瘍組織を用いて異種移植されたヒト腫瘍細胞株および免疫不全マウスを用いて、イン ビトロ および インビボ内 独立のアッセイを用いて我々の方法を検証した。
Abstract
アデノシン三リン酸(ATP)は、細胞外ATP(eATP)を含む、薬剤耐性、上皮間葉転移(EMT)、転移などの腫瘍形成の様々な側面において重要な役割を果たすることが示されている。腫瘍内eATPは、通常組織よりも濃度が10 3〜10倍高い。eATPはEMT誘導のための純粋なシグナル伝達を活性化するメッセンジャーとして機能する一方で、特定のタイプのエンドサイトーシスである上方制御されたマクロピノサイトーシスを通じて癌細胞によって内在化され、多種多様な生物学的機能を実行する。これらの機能には、ATPを必要とする生化学反応にエネルギーを提供すること、シグナル伝達中にリン酸基を寄付すること、転写補因子としての遺伝子発現の促進または加速が含まれる。ATPは容易に利用でき、癌および他の分野での研究は間違いなく増加するだろう。しかし、eATPの研究は初期段階にとどまっており、eATPと内部化された細胞内ATPが行う重要で汎用性の高い活動が完全に解明される前に、未解決の質問は未回答のままです。
これらの著者の研究者のこれらの初期のeATP研究への貢献は、非加水分解蛍光ATPの顕微鏡イメージング、マクロピノサイトーシスおよびエンドサイトーシストレーサーとして機能する高分子および低分子蛍光デックストランス、ならびにeATP化プロセスを監視し、特徴付けるために様々なエンドサイトーシス阻害剤を含む。このイメージングモダリティは、腫瘍細胞株及び免疫不全マウスに適用され、ヒト癌腫瘍を用いて異種移植し、 インビトロ 及び インビボでeATP内在化を研究した。本論文では、マクロピノサイトーシス/エンドサイトーシスを介したeATP内在化アッセイを異なるシステムで正常に実行できるようにアッセイ条件の修正と微調整を重視した、イン ビトロ および インビボ プロトコルについて説明する。
Introduction
腫瘍外細胞外(すなわち)栄養素の日和見摂取は、最近、癌代謝の重要な特徴と命名された1.これらの重要な栄養素の1つはATPであり、ieATPの濃度は正常組織に見られるものよりも103および10倍高く、数百μM〜低mM2、3、4、5の範囲である。重要なエネルギーとシグナル伝達分子として、ATPは癌性および健康な細胞6、7、8における細胞代謝において中心的な役割を果たす。細胞外ATPは癌細胞増殖に関与するだけでなく、薬剤耐性を促進する9.最近、ATPの認識されていない機能は、最近同定されており、アルツハイマー病10などの疾患にATPが関与する。確かに、がん細胞、健康な細胞、その他の病気の細胞におけるATPとその機能に関する私たちの理解は決して完全ではありません。しかし、細胞の不安定性と高い回転率のために、細胞膜を横切って細胞内へのATPの動きを監視することは技術的に困難です。
この問題に対処し、この研究領域の必要性を満たすために、非加水分解性蛍光ATP(NHF-ATP)(図1)を代理としてATPの内部化を可視化し、インビトロとインビボ11、12の両方の内在化ATPの細胞内空間局在化を観察する方法を開発した。.NHF-ATPは、動物細胞膜を横切るATPの動きを調査するために内因性ATPの代用を示し、癌細胞株および免疫不全マウス11,12上に異種移植されたヒト腫瘍組織の両方で行う。また、eATP内在化を遮断した細胞にマクロピノサイトーシス阻害剤を投与し、eATPの細胞内取り込みは、マクロピノサイトーション機構9、11、12を伴うことを示唆している。このプロトコルは、細胞特異的タンパク質に対する免疫ベースのコラベル化を可能にし、したがって、どの細胞タイプがNHF-ATPを内在化するかを同定する。生体内腫瘍異種移植片と高解像度顕微鏡を用いて、NHF-ATPは組織サンプル全体、さらには単一細胞内でも空間的に可視化することができる。これらの方法は、細胞の取り込みの割合、マクロピノサイトー小胞の数、および内在化動態などの定量的分析も可能にする。この論文では、NHF-ATPが、単独で、またはエンドサイトーシストレーサー蛍光デクストランス13、14、15、16と一緒に働いて、細胞内在化に続くATPの内在化および細胞内局在化を研究するために、異なる実験設定で使用される方法を詳細に述べる。
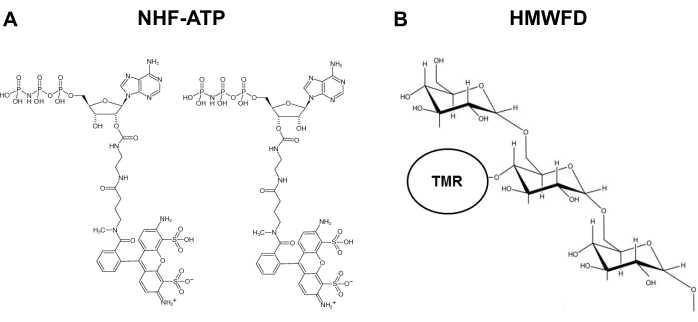
図1:非加水分解性蛍光ATPおよびテトラメチルローダミンの構造は、高分子量蛍光デキストラン(A)NHF-ATPの構造を標識した。(B) HMWFDの概略表現。略語: ATP = アデノシン三リン酸;NHF-ATP = 非加水蛍光ATP;TMR = テトラメチルロダミン;HMWFD = 高分子量蛍光デキストランこの図の大きなバージョンを表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
非加水分解性ATPの細胞内在化の空間的、時間的、定量的な分析のために開発された方法。この方法は、様々な腫瘍形成モデルを含む多様な生物学的システムでの使用に広く適用され、技術的な指示および代表的なデータを提供しています。 in vivo ATPの内在化研究(プロトコルのセクション4)の間に解釈可能なデータを取得するには、腫瘍内デキストラン注射からクライオ埋め込みに経過?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
クライオセクションは、オハイオ大学組織病理学コアで現場で行われました。この作品は、Cニールセンへのスタートアップ資金(オハイオ大学芸術科学大学)によって部分的に支えられ、その一部は支援されました。NIHは、XチェンにR15 CA242177-01とRSAC賞を付与します。
Materials
| A549 cells, human lung epithelial, carcinoma | National Cancer Institute | n/a | Less expensive source |
| Acetone | Fisher Scientific | S25904 | |
| Aluminum foil, Reynolds | Grainger | 6CHG6 | |
| Aqueous Mounting Medium, ProLong Gold Anti-fade Reagent | ThermoFisher | P36930 | |
| ATP analog | Jena Biosciences | NK-101 | |
| Autoclave, sterilizer | Grainger | 33ZZ40 | |
| Blades, cryostat, high profile | C. L. Sturkey, Inc. | DT554550 | |
| Calipers, vernier | Grainger | 4KU77 | |
| Cell medium, Ham's Nutrient Mixture F12, serum-free | Millipore Sigma | 51651C-1000ML | |
| Centrifuge, refrigerated with swinging bucket rotor | Eppendorf | 5810R | |
| Chloroform | Acros Organics | 423555000 | |
| Conical tube, 15 mL | VWR | 21008-216 | |
| Conical tube, 50 mL | VWR | 21008-242 | |
| Coverslips, glass, 12 mm | Corning | 2975-245 | |
| Cryostat, Leica CM1950 | Leica Biosystems | CM1950 | |
| Delicate task wipe, Kim Wipes | Kimberly-Clark | 34155 | |
| Dextran, Lysine fixable, High Molecular Weight (HMW) | Invitrogen | D1818 | MW = 70,000, Tetramethylrhodamine |
| Dextran, Neutral, High Molecular Weight (HMW) | Invitrogen | D1819 | |
| Dulbecco's Modified Eagle Medium (DMEM), serum-free | Fisher Scientific | 11885076 | |
| Dry ice | Local delivery | Custom order | |
| Epifluorescent imaging system, Nikon NiU and Nikon NIS Elements acquisition software | Nikon | Custom order | |
| Ethanol | Fisher Scientific | BP2818-4 | |
| Fetal bovine serum (FBS) | ThermoFisher | 16000044 | |
| Forceps, Dumont #7, curved | Fine Science Tools | 11274-20 | |
| Forceps, Dumont #5, straight | Fine Science Tools | 11254-20 | |
| Gloves (small, medium, large) | Microflex | N191, N192, N193 | |
| Gloves, MAPA Temp-Ice 700 Thermal (for handling dry ice) | Fisher Scientific | 19-046-563 | |
| Hemocytometer | Daigger | EF16034F EA | |
| Incubator, cell culture | Eppendorf | Galaxy 170 S | |
| Labelling tape | Fisher Scientific | 159015R | |
| Marking pen, Sharpie (ultra-fine) | Staples | 642736 | |
| Mice, immunodeficient (Nu/J) | Jackson Laboratory | 2019 | |
| Microcentrifuge, accuSpin Micro17 | Fisher Scientific | 13-100-675 | |
| Microcentrifgue tubes, Eppendorf tubes (1.5 mL) | Axygen | MCT-150-C | |
| Microscope slide box | Fisher Scientific | 50-751-4983 | |
| Needle, 27 gauge | Becton-Dickinson | 752 0071 | |
| Paintbrush | Grainger | 39AL12 | |
| Paper towels | Staples | 33550 | |
| Paraformaldehyde | Acros Organics | 416785000 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Perforated spoon, 15 mm diameter, 135 mm length | Roboz Surgical Instrument Co. | RS-6162 | |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP3991 | |
| Pipet tips (10 μL) | Fisher Scientific | 02-707-438 | |
| Pipet tips (200 μL) | Fisher Scientific | 02-707-411 | |
| Pipet tips (1000 μL) | Fisher Scientific | 02-707-403 | |
| Pipets, serological (10 mL) | VWR | 89130-910 | |
| Pippetor, Gilson P2 | Daigger | EF9930A | |
| Pipettor Starter Kit, Gilson (2-10 μL, 20-200 μL, 200-1000 μL) | Daigger | EF9931A | |
| Platform shaker – orbital, benchtop | Cole-Parmer | EW-51710-23 | |
| Positively-charged microscope slides, Superfrost | Fisher Scientific | 12-550-15 | |
| Scalpel, size 10, Surgical Design, Inc. | Fisher Scientific | 22-079-707 | |
| Scissors, surgical – sharp, curved | Fine Science Tools | 14005-12 | |
| Software for image analysis, Nikon Elements | Nikon | Custom order | |
| Software for image analysis, ImageJ (FIJI) | National Institutes of Health | n/a | Download online (free) |
| Specimen disc 30 mm (chuck holder), cryostat accessory | Leica Biosystems | 14047740044 | |
| Staining tray, 245 mm BioAssay Dish | Corning | 431111 | |
| Syringe, 1 cc | Becton-Dickinson | 309623 | |
| Tape, laboratory, 19 mm width | Fisher Scientific | 15-901-5R | |
| Timer | Fisher Scientific | 14-649-17 | |
| Tissue culture dish, 100 x 15 mm diameter | Fisher Scientific | 08-757-100D | |
| Tissue culture flask, 225 cm2 | ThermoFisher | 159933 | |
| Tissue culture plate, 24-well | Becton-Dickinson | 353226 | |
| Tissue embedding mold, stainless steel | Tissue Tek | 4161 | |
| Tissue Freezing Medium, Optimal Cutting Temperature (OCT) | Fisher Scientific | 4585 | |
| Trypsin-EDTA (ethylenediaminetetraacetic acid), 0.25% | Gibco | 25200072 | |
| Water bath, Precision GP 2S | ThermoFisher | TSGP2S |
References
- Pavlova, N. N., Thompson, C. B. The emerging hallmarks of cancer metabolism. Cell Metabolism. 23 (1), 27-47 (2016).
- Pellegatti, P., et al. Increased level of extracellular ATP at tumor sites: in vivo imaging with plasma membrane luciferase. PLoS ONE. 3, 25992008 (2008).
- Falzoni, S., Donvito, G., Di Virgilio, F. Detecting adenosine triphosphate in the pericellular space. Interface Focus. 3 (3), 20120101 (2013).
- Michaud, M., et al. Autophagy-dependent anticancer immune responses induced by chemotherapeutic agents in mice. Science. 334, 1573-1577 (2011).
- Wilhelm, K., et al. Graft-versus-host disease is enhanced by extracellular ATP activating P2X7R. Nature Medicine. 16, 1434-1438 (2010).
- Vander Heiden, M. G., Cantley, L. C., Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324, 1029-1033 (2009).
- Cairns, R. A., Harris, I. S., Mak, T. W. Regulation of cancer cell metabolism. Nature Reviews Cancer. 11, 85-95 (2011).
- Chen, X., Qian, Y., Wu, S. The Warburg effect: evolving interpretations of an established concept. Free Radical Biology & Medicine. 79, 253-263 (2015).
- Wang, X., et al. Extracellular ATP, as an energy and phosphorylating molecule, induces different types of drug resistances in cancer cells through ATP internalization and intracellular ATP level increase. Oncotarget. 8 (5), 87860-87877 (2017).
- Patel, A., et al. ATP as a biological hydrotrope. Science. 356, 753-756 (2017).
- Qian, Y., et al. Extracellular ATP is internalized by macropinocytosis and induces intracellular ATP increase and drug resistance in cancer cells. Cancer Letters. 351, 242-251 (2014).
- Qian, Y., Wang, X., Li, Y., Cao, Y., Chen, X. Extracellular ATP a new player in cancer metabolism: NSCLC cells internalize ATP in vitro and in vivo using multiple endocytic mechanisms. Molecular Cancer Research. 14, 1087-1096 (2016).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497, 633-637 (2013).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biology International. 39, 531-539 (2015).
- Yanagawa, Y., Matsumoto, M., Togashi, H. Enhanced dendritic cell antigen uptake via alpha2 adrenoceptor-mediated PI3K activation following brief exposure to noradrenaline. Journal of Immunology. 185, 5762-5768 (2010).
- Hoppe, H. C., et al. Antimalarial quinolines and artemisinin inhibit endocytosis in Plasmodium falciparum. Antimicrobial Agents & Chemotherapy. 48, 2370-2378 (2004).
- Chaudry, I. H. Does ATP cross the cell plasma membrane. Yale Journal of Biology & Medicine. 55, 1-10 (1982).
- Pant, H. C., Terakawa, S., Yoshioka, T., Tasaki, I., Gainer, H. Evidence for the utilization of extracellular [gamma-32P]ATP for the phosphorylation of intracellular proteins in the squid giant axon. Biochimica et Biophysica Acta. 582, 107-114 (1979).
- Chaudry, I. H., Baue, A. E. Further evidence for ATP uptake by rat tissues. Biochimica et Biophysica Acta. 628, 336-342 (1980).
- Koppenol, W. H., Bounds, P. L., Dang, C. V. Otto Warburg’s contributions to current concepts of cancer metabolism. Nature Reviews Cancer. 11, 325-337 (2011).
- Dang, C. V. Links between metabolism and cancer. Genes & Development. 26, 877-890 (2012).
- Israelsen, W. J., Vander Heiden, M. G. ATP consumption promotes cancer metabolism. Cell. 143, 669-671 (2010).
- Koster, J. C., Permutt, M. A., Nichols, C. G. Diabetes and insulin secretion: the ATP-sensitive K+ channel (K ATP) connection. Diabetes. 54, 3065-3072 (2005).
- Szendroedi, J., et al. Muscle mitochondrial ATP synthesis and glucose transport/phosphorylation in type 2 diabetes. PLoS Medicine. 4, 154 (2007).
- Miyamoto, S., et al. Mass spectrometry imaging reveals elevated glomerular ATP/AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator. EBioMedicine. 7, 121-134 (2016).

