Microscopia a fluorescenza per l'internalizzazione dell'ATP mediata dalla macropinocitosi in cellule tumorali umane e topi xenotrapiantati da tumore
Summary
Abbiamo sviluppato un metodo riproducibile per visualizzare l’internalizzazione dell’adenosina trifosfato fluorescente non idrolizzabile (ATP), un surrogato di ATP, ad alta risoluzione cellulare. Abbiamo convalidato il nostro metodo utilizzando saggi indipendenti in vitro e in vivo: linee cellulari tumorali umane e topi immunodeficienti xenografati con tessuto tumorale umano.
Abstract
L’adenosina trifosfato (ATP), compreso l’ATP extracellulare (eATP), ha dimostrato di svolgere ruoli significativi in vari aspetti della tumorigenesi, come la resistenza ai farmaci, la transizione epiteliale-mesenchimale (EMT) e le metastasi. L’eATP intratumorale è da10 3 a10 4 volte superiore in concentrazione rispetto ai tessuti normali. Mentre l’eATP funziona come un messaggero per attivare la segnalazione purinergica per l’induzione EMT, è anche internalizzato dalle cellule tumorali attraverso macropinocitosi sovraregolata, un tipo specifico di endocitosi, per svolgere un’ampia varietà di funzioni biologiche. Queste funzioni includono la fornitura di energia alle reazioni biochimiche che richiedono ATP, la donazione di gruppi fosfato durante la trasduzione del segnale e la facilitazione o l’accelerazione dell’espressione genica come cofattore trascrizionale. L’ATP è prontamente disponibile e il suo studio sul cancro e in altri campi aumenterà senza dubbio. Tuttavia, lo studio eATP rimane in una fase iniziale e le domande irrisolte rimangono senza risposta prima che le attività importanti e versatili svolte dall’eATP e dall’ATP intracellulare interiorizzato possano essere completamente svelate.
I contributi dei laboratori di questi autori a questi primi studi eATP includono l’imaging microscopico di ATP fluorescente non idrolizzabile, accoppiato con dextrans fluorescenti ad alto e basso peso molecolare, che fungono da traccianti di macropinocitosi ed endocitosi, nonché vari inibitori dell’endocitosi, per monitorare e caratterizzare il processo di internalizzazione dell’eATP. Questa modalità di imaging è stata applicata a linee cellulari tumorali e a topi immunodeficienti, xenotrapiantati con tumori tumorali umani, per studiare l’internalizzazione dell’eATP in vitro e in vivo. Questo articolo descrive questi protocolli in vitro e in vivo, con particolare attenzione alla modifica e alla messa a punto delle condizioni di analisi in modo che i saggi di internalizzazione eATP mediati da macropinocitosi / endocitosi possano essere eseguiti con successo in diversi sistemi.
Introduction
L’assorbimento opportunistico di nutrienti extracellulari intratumorali (cioè) è stato recentemente nominato un segno distintivo chiave per il metabolismo del cancro1. Uno di questi importanti nutrienti è l’ATP, in quanto la concentrazione di ieATP è10 3 e10 4 volte superiore a quella che si trova nei tessuti normali, nell’intervallo da diverse centinaia di μM a bassi mM2,3,4,5. Come molecola chiave di energia e segnalazione, l’ATP svolge un ruolo centrale nel metabolismo cellulare nelle cellule cancerose e sane6,7,8. L’ATP extracellulare non è solo coinvolto nella crescita delle cellule tumorali, ma promuove anche la resistenza ai farmaci9. Funzioni precedentemente non riconosciute dell’ATP, come l’attività idrotropica, sono state recentemente identificate, implicando così il coinvolgimento dell’ATP in malattie come l’Alzheimer10. In effetti, sembra che la nostra comprensione dell’ATP e delle sue funzioni nelle cellule tumorali, nelle cellule sane e in altre cellule malate sia tutt’altro che completa. Tuttavia, a causa dell’instabilità dell’ATP e degli alti tassi di turnover nelle cellule, è tecnicamente difficile monitorare il movimento dell’ATP attraverso la membrana cellulare e nella cellula.
Per affrontare questo problema e soddisfare le esigenze di questa area di ricerca, è stato sviluppato un metodo in cui l’ATP fluorescente non idrolizzabile (NHF-ATP) (Figura 1) è stato utilizzato come surrogato per visualizzare l’internalizzazione dell’ATP e osservare la localizzazione spaziale intracellulare dell’ATP internalizzato, sia in vitro che in vivo11,12 . NHF-ATP ha dimostrato di sostituire l’ATP endogeno per studiare il movimento dell’ATP attraverso le membrane cellulari animali, sia nelle linee cellulari tumorali che nel tessuto tumorale umano xenotrapiantato su topi immunodeficienti11,12. Inoltre, la somministrazione di inibitori della macropinocitosi alle cellule ha bloccato l’internalizzazione dell’eATP, suggerendo che l’assorbimento intracellulare di eATP comporta un meccanismo macropinocitotico9,11,12. Questo protocollo consente il colabeling immunobased contro proteine cellulari specifiche e quindi l’identificazione di quale tipo di cellula interiorizza NHF-ATP. Utilizzando xenotrapianti tumorali in vivo e microscopia ad alta risoluzione, NHF-ATP può essere visualizzato spazialmente attraverso il campione di tessuto e anche all’interno di una singola cellula. Questi metodi consentono anche analisi quantitative, come la percentuale di assorbimento cellulare, il numero di vescicole macropinocitotiche e la cinetica di internalizzazione. Questo articolo descrive in dettaglio come NHF-ATP, lavorando da solo o insieme adextrans13, 14,15,16fluorescenti endocitosi-traccianti, può essere utilizzato in diversi contesti sperimentali per studiare l’internalizzazione e la localizzazione intracellulare dell’ATP, a seguito dell’internalizzazione nelle cellule.
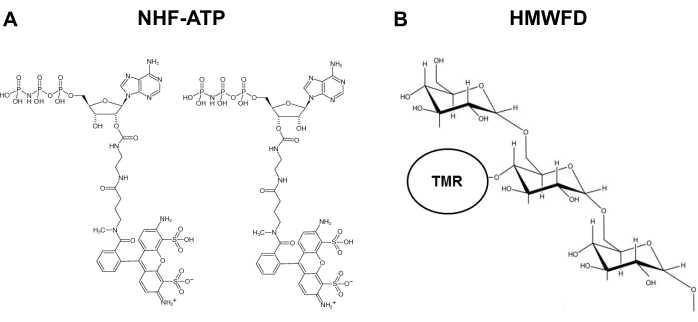
Figura 1: Strutture di ATP fluorescente non idrolizzabile e tetrametilrodramina etichettate come destrano fluorescente ad alto peso molecolare. (A) Struttura di NHF-ATP. (B) Rappresentazione schematica dell’HMWFD. Abbreviazioni: ATP = adenosina trifosfato; NHF-ATP = ATP fluorescente non idrolizzabile; TMR = tetrametilrodramina; HMWFD = destrano fluorescente ad alto peso molecolare. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
È stato sviluppato un metodo per l’analisi spaziale, temporale e quantitativa dell’internalizzazione cellulare dell’ATP non idrolizzabile. Questo metodo è ampiamente applicabile per l’uso in diversi sistemi biologici, compresi vari modelli tumorigenici, per i quali forniamo istruzioni tecniche e dati rappresentativi. Per acquisire dati interpretabili durante gli studi di internalizzazione dell’ATP in vivo (sezione 4 del protocollo), è fondamentale limitare il tempo sperimentale trascorso dall’iniezione intrat…
Disclosures
The authors have nothing to disclose.
Acknowledgements
La criosezione è stata eseguita in loco presso l’Ohio University Histopathology Core. Questo lavoro è stato sostenuto in parte da fondi di start-up (Ohio University College of Arts & Sciences) a C Nielsen; NIH concede R15 CA242177-01 e premio RSAC a X Chen.
Materials
| A549 cells, human lung epithelial, carcinoma | National Cancer Institute | n/a | Less expensive source |
| Acetone | Fisher Scientific | S25904 | |
| Aluminum foil, Reynolds | Grainger | 6CHG6 | |
| Aqueous Mounting Medium, ProLong Gold Anti-fade Reagent | ThermoFisher | P36930 | |
| ATP analog | Jena Biosciences | NK-101 | |
| Autoclave, sterilizer | Grainger | 33ZZ40 | |
| Blades, cryostat, high profile | C. L. Sturkey, Inc. | DT554550 | |
| Calipers, vernier | Grainger | 4KU77 | |
| Cell medium, Ham's Nutrient Mixture F12, serum-free | Millipore Sigma | 51651C-1000ML | |
| Centrifuge, refrigerated with swinging bucket rotor | Eppendorf | 5810R | |
| Chloroform | Acros Organics | 423555000 | |
| Conical tube, 15 mL | VWR | 21008-216 | |
| Conical tube, 50 mL | VWR | 21008-242 | |
| Coverslips, glass, 12 mm | Corning | 2975-245 | |
| Cryostat, Leica CM1950 | Leica Biosystems | CM1950 | |
| Delicate task wipe, Kim Wipes | Kimberly-Clark | 34155 | |
| Dextran, Lysine fixable, High Molecular Weight (HMW) | Invitrogen | D1818 | MW = 70,000, Tetramethylrhodamine |
| Dextran, Neutral, High Molecular Weight (HMW) | Invitrogen | D1819 | |
| Dulbecco's Modified Eagle Medium (DMEM), serum-free | Fisher Scientific | 11885076 | |
| Dry ice | Local delivery | Custom order | |
| Epifluorescent imaging system, Nikon NiU and Nikon NIS Elements acquisition software | Nikon | Custom order | |
| Ethanol | Fisher Scientific | BP2818-4 | |
| Fetal bovine serum (FBS) | ThermoFisher | 16000044 | |
| Forceps, Dumont #7, curved | Fine Science Tools | 11274-20 | |
| Forceps, Dumont #5, straight | Fine Science Tools | 11254-20 | |
| Gloves (small, medium, large) | Microflex | N191, N192, N193 | |
| Gloves, MAPA Temp-Ice 700 Thermal (for handling dry ice) | Fisher Scientific | 19-046-563 | |
| Hemocytometer | Daigger | EF16034F EA | |
| Incubator, cell culture | Eppendorf | Galaxy 170 S | |
| Labelling tape | Fisher Scientific | 159015R | |
| Marking pen, Sharpie (ultra-fine) | Staples | 642736 | |
| Mice, immunodeficient (Nu/J) | Jackson Laboratory | 2019 | |
| Microcentrifuge, accuSpin Micro17 | Fisher Scientific | 13-100-675 | |
| Microcentrifgue tubes, Eppendorf tubes (1.5 mL) | Axygen | MCT-150-C | |
| Microscope slide box | Fisher Scientific | 50-751-4983 | |
| Needle, 27 gauge | Becton-Dickinson | 752 0071 | |
| Paintbrush | Grainger | 39AL12 | |
| Paper towels | Staples | 33550 | |
| Paraformaldehyde | Acros Organics | 416785000 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Perforated spoon, 15 mm diameter, 135 mm length | Roboz Surgical Instrument Co. | RS-6162 | |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP3991 | |
| Pipet tips (10 μL) | Fisher Scientific | 02-707-438 | |
| Pipet tips (200 μL) | Fisher Scientific | 02-707-411 | |
| Pipet tips (1000 μL) | Fisher Scientific | 02-707-403 | |
| Pipets, serological (10 mL) | VWR | 89130-910 | |
| Pippetor, Gilson P2 | Daigger | EF9930A | |
| Pipettor Starter Kit, Gilson (2-10 μL, 20-200 μL, 200-1000 μL) | Daigger | EF9931A | |
| Platform shaker – orbital, benchtop | Cole-Parmer | EW-51710-23 | |
| Positively-charged microscope slides, Superfrost | Fisher Scientific | 12-550-15 | |
| Scalpel, size 10, Surgical Design, Inc. | Fisher Scientific | 22-079-707 | |
| Scissors, surgical – sharp, curved | Fine Science Tools | 14005-12 | |
| Software for image analysis, Nikon Elements | Nikon | Custom order | |
| Software for image analysis, ImageJ (FIJI) | National Institutes of Health | n/a | Download online (free) |
| Specimen disc 30 mm (chuck holder), cryostat accessory | Leica Biosystems | 14047740044 | |
| Staining tray, 245 mm BioAssay Dish | Corning | 431111 | |
| Syringe, 1 cc | Becton-Dickinson | 309623 | |
| Tape, laboratory, 19 mm width | Fisher Scientific | 15-901-5R | |
| Timer | Fisher Scientific | 14-649-17 | |
| Tissue culture dish, 100 x 15 mm diameter | Fisher Scientific | 08-757-100D | |
| Tissue culture flask, 225 cm2 | ThermoFisher | 159933 | |
| Tissue culture plate, 24-well | Becton-Dickinson | 353226 | |
| Tissue embedding mold, stainless steel | Tissue Tek | 4161 | |
| Tissue Freezing Medium, Optimal Cutting Temperature (OCT) | Fisher Scientific | 4585 | |
| Trypsin-EDTA (ethylenediaminetetraacetic acid), 0.25% | Gibco | 25200072 | |
| Water bath, Precision GP 2S | ThermoFisher | TSGP2S |
References
- Pavlova, N. N., Thompson, C. B. The emerging hallmarks of cancer metabolism. Cell Metabolism. 23 (1), 27-47 (2016).
- Pellegatti, P., et al. Increased level of extracellular ATP at tumor sites: in vivo imaging with plasma membrane luciferase. PLoS ONE. 3, 25992008 (2008).
- Falzoni, S., Donvito, G., Di Virgilio, F. Detecting adenosine triphosphate in the pericellular space. Interface Focus. 3 (3), 20120101 (2013).
- Michaud, M., et al. Autophagy-dependent anticancer immune responses induced by chemotherapeutic agents in mice. Science. 334, 1573-1577 (2011).
- Wilhelm, K., et al. Graft-versus-host disease is enhanced by extracellular ATP activating P2X7R. Nature Medicine. 16, 1434-1438 (2010).
- Vander Heiden, M. G., Cantley, L. C., Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324, 1029-1033 (2009).
- Cairns, R. A., Harris, I. S., Mak, T. W. Regulation of cancer cell metabolism. Nature Reviews Cancer. 11, 85-95 (2011).
- Chen, X., Qian, Y., Wu, S. The Warburg effect: evolving interpretations of an established concept. Free Radical Biology & Medicine. 79, 253-263 (2015).
- Wang, X., et al. Extracellular ATP, as an energy and phosphorylating molecule, induces different types of drug resistances in cancer cells through ATP internalization and intracellular ATP level increase. Oncotarget. 8 (5), 87860-87877 (2017).
- Patel, A., et al. ATP as a biological hydrotrope. Science. 356, 753-756 (2017).
- Qian, Y., et al. Extracellular ATP is internalized by macropinocytosis and induces intracellular ATP increase and drug resistance in cancer cells. Cancer Letters. 351, 242-251 (2014).
- Qian, Y., Wang, X., Li, Y., Cao, Y., Chen, X. Extracellular ATP a new player in cancer metabolism: NSCLC cells internalize ATP in vitro and in vivo using multiple endocytic mechanisms. Molecular Cancer Research. 14, 1087-1096 (2016).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497, 633-637 (2013).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biology International. 39, 531-539 (2015).
- Yanagawa, Y., Matsumoto, M., Togashi, H. Enhanced dendritic cell antigen uptake via alpha2 adrenoceptor-mediated PI3K activation following brief exposure to noradrenaline. Journal of Immunology. 185, 5762-5768 (2010).
- Hoppe, H. C., et al. Antimalarial quinolines and artemisinin inhibit endocytosis in Plasmodium falciparum. Antimicrobial Agents & Chemotherapy. 48, 2370-2378 (2004).
- Chaudry, I. H. Does ATP cross the cell plasma membrane. Yale Journal of Biology & Medicine. 55, 1-10 (1982).
- Pant, H. C., Terakawa, S., Yoshioka, T., Tasaki, I., Gainer, H. Evidence for the utilization of extracellular [gamma-32P]ATP for the phosphorylation of intracellular proteins in the squid giant axon. Biochimica et Biophysica Acta. 582, 107-114 (1979).
- Chaudry, I. H., Baue, A. E. Further evidence for ATP uptake by rat tissues. Biochimica et Biophysica Acta. 628, 336-342 (1980).
- Koppenol, W. H., Bounds, P. L., Dang, C. V. Otto Warburg’s contributions to current concepts of cancer metabolism. Nature Reviews Cancer. 11, 325-337 (2011).
- Dang, C. V. Links between metabolism and cancer. Genes & Development. 26, 877-890 (2012).
- Israelsen, W. J., Vander Heiden, M. G. ATP consumption promotes cancer metabolism. Cell. 143, 669-671 (2010).
- Koster, J. C., Permutt, M. A., Nichols, C. G. Diabetes and insulin secretion: the ATP-sensitive K+ channel (K ATP) connection. Diabetes. 54, 3065-3072 (2005).
- Szendroedi, J., et al. Muscle mitochondrial ATP synthesis and glucose transport/phosphorylation in type 2 diabetes. PLoS Medicine. 4, 154 (2007).
- Miyamoto, S., et al. Mass spectrometry imaging reveals elevated glomerular ATP/AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator. EBioMedicine. 7, 121-134 (2016).

