Fluorescentiemicroscopie voor ATP-internalisatie gemedieerd door macropinocytose in menselijke tumorcellen en tumor-xenogetransplanteerde muizen
Summary
We ontwikkelden een reproduceerbare methode om de internalisatie van niet-hydrolyseerbaar fluorescerend adenosinetrifosfaat (ATP), een ATP-surrogaat, met hoge cellulaire resolutie te visualiseren. We hebben onze methode gevalideerd met behulp van onafhankelijke in vitro en in vivo assays – menselijke tumorcellijnen en immunodeficiënte muizen xenografeerd met menselijk tumorweefsel.
Abstract
Van adenosinetrifosfaat (ATP), inclusief extracellulaire ATP (eATP), is aangetoond dat het een belangrijke rol speelt in verschillende aspecten van tumorigenese, zoals geneesmiddelresistentie, epitheliale-mesenchymale overgang (EMT) en metastase. Intratumorale eATP is 103 tot 104 keer hoger in concentratie dan in normale weefsels. Terwijl eATP functioneert als een boodschapper om purinerge signalering voor EMT-inductie te activeren, wordt het ook geïnternaliseerd door kankercellen door middel van upregulated macropinocytose, een specifiek type endocytose, om een breed scala aan biologische functies uit te voeren. Deze functies omvatten het leveren van energie aan ATP-vereisende biochemische reacties, het doneren van fosfaatgroepen tijdens signaaltransductie en het vergemakkelijken of versnellen van genexpressie als een transcriptionele cofactor. ATP is direct beschikbaar en de studie op kanker en andere gebieden zal ongetwijfeld toenemen. EATP-studie blijft echter in een vroeg stadium en onopgeloste vragen blijven onbeantwoord voordat de belangrijke en veelzijdige activiteiten van eATP en geïnternaliseerde intracellulaire ATP volledig kunnen worden ontrafeld.
De bijdragen van de laboratoria van deze auteurs aan deze vroege eATP-studies omvatten microscopische beeldvorming van niet-hydrolyseerbare fluorescerende ATP, gekoppeld aan fluorescentie dextrans met een hoog en laag molecuulgewicht, die dienen als macropinocytose en endocytose tracers, evenals verschillende endocytoseremmers, om het eATP-internalisatieproces te controleren en te karakteriseren. Deze beeldvormingsmodaliteit werd toegepast op tumorcellijnen en op immunodeficiënte muizen, xenogegrafeerd met menselijke kankertumoren, om eATP-internalisatie in vitro en in vivo te bestuderen. Dit artikel beschrijft deze in vitro en in vivo protocollen, met de nadruk op het modificeren en finetunen van assaycondities, zodat de macropinocytose-/endocytose-gemedieerde eATP-internalisatie assays met succes kunnen worden uitgevoerd in verschillende systemen.
Introduction
De opportunistische opname van intratumorale extracellulaire (dwz) voedingsstoffen is onlangs uitgeroepen tot een belangrijk kenmerk voor kankermetabolisme1. Een van deze belangrijke voedingsstoffen is ATP, omdat de concentratie van ieATP 103 en 104 keer hoger is dan die in normale weefsels, in het bereik van enkele honderden μM tot lage mM2,3,4,5. Als een belangrijk energie- en signaalmolecuul speelt ATP een centrale rol in het cellulaire metabolisme in kankerachtige en gezonde cellen6,7,8. Extracellulaire ATP is niet alleen betrokken bij de groei van kankercellen, maar bevordert ook de resistentie tegen geneesmiddelen9. Eerder niet-herkende functies van ATP, zoals hydrotrope activiteit, zijn onlangs geïdentificeerd, waardoor ATP-betrokkenheid bij ziekten zoals de ziekte van Alzheimer wordt geïmpliceerd10. Inderdaad, het lijkt erop dat ons begrip van ATP en zijn functies in kankercellen, gezonde cellen en andere zieke cellen verre van compleet is. Vanwege de instabiliteit van ATP en de hoge omloopsnelheden in cellen is het echter technisch een uitdaging om de beweging van ATP over het celmembraan en in de cel te volgen.
Om dit probleem aan te pakken en in de behoefte van dit onderzoeksgebied te voorzien, werd een methode ontwikkeld waarbij niet-hydrolyseerbare fluorescerende ATP (NHF-ATP) (Figuur 1) werd gebruikt als surrogaat om de internalisatie van ATP te visualiseren en de intracellulaire ruimtelijke lokalisatie van geïnternaliseerde ATP te observeren, zowel in vitro als in vivo11,12 . Van NHF-ATP is aangetoond dat het endogene ATP vervangt om ATP-beweging over dierlijke celmembranen te onderzoeken, zowel in kankercellijnen als in menselijk tumorweefsel xenogetransplanteerd op immunodeficiënte muizen11,12. Bovendien blokkeerde het toedienen van macropinocytoseremmers aan cellen eATP-internalisatie, wat suggereert dat intracellulaire opname van eATP een macropinocytotisch mechanismeomvat 9,11,12. Dit protocol maakt immunobased colabeling tegen celspecifieke eiwitten mogelijk en dus identificatie van welk celtype NHF-ATP internaliseert. Met behulp van in vivo tumor xenografts en hoge resolutie microscopie kan NHF-ATP ruimtelijk worden gevisualiseerd over het weefselmonster en zelfs binnen een enkele cel. Deze methoden maken ook kwantitatieve analyse mogelijk, zoals het percentage cellulaire opname, het aantal macropinocytotische blaasjes en internalisatiekinetiek. Dit artikel beschrijft in detail hoe NHF-ATP, alleen of samen met endocytose-tracer fluorescerende dextrans13,14,15,16, kan worden gebruikt in verschillende experimentele omgevingen om de internalisatie en intracellulaire lokalisatie van ATP te bestuderen, na internalisatie in cellen.
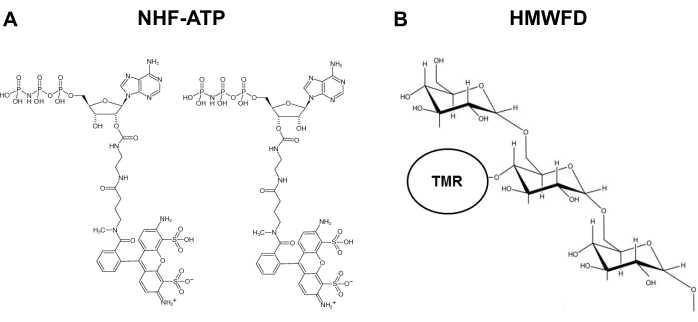
Figuur 1: Structuren van niet-hydrolyseerbare fluorescerende ATP en tetramethylrhodamine gelabeld met hoog molecuulgewicht fluorescerend dextran. (A) Structuur van NHF-ATP. (B) Schematische weergave van HMWFD. Afkortingen: ATP = adenosinetrifosfaat; NHF-ATP = niet-hydrolyseerbare fluorescerende ATP; TMR = tetramethylrhodamine; HMWFD = fluorescerend dextran met hoog molecuulgewicht. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Er werd een methode ontwikkeld voor ruimtelijke, temporele en kwantitatieve analyse van de cellulaire internalisatie van niet-hydrolyseerbare ATP. Deze methode is breed toepasbaar voor gebruik in diverse biologische systemen, waaronder verschillende tumorogene modellen, waarvoor we technische instructies en representatieve gegevens verstrekken. Om interpreteerbare gegevens te verkrijgen tijdens in vivo ATP-internalisatiestudies (sectie 4 van het protocol), is het van cruciaal belang om de experimentele tijd die …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Cryosectie werd ter plaatse uitgevoerd in de Ohio University Histopathology Core. Dit werk werd deels ondersteund door start-upfondsen (Ohio University College of Arts & Sciences) aan C Nielsen; NIH-subsidie R15 CA242177-01 en RSAC-toekenning aan X Chen.
Materials
| A549 cells, human lung epithelial, carcinoma | National Cancer Institute | n/a | Less expensive source |
| Acetone | Fisher Scientific | S25904 | |
| Aluminum foil, Reynolds | Grainger | 6CHG6 | |
| Aqueous Mounting Medium, ProLong Gold Anti-fade Reagent | ThermoFisher | P36930 | |
| ATP analog | Jena Biosciences | NK-101 | |
| Autoclave, sterilizer | Grainger | 33ZZ40 | |
| Blades, cryostat, high profile | C. L. Sturkey, Inc. | DT554550 | |
| Calipers, vernier | Grainger | 4KU77 | |
| Cell medium, Ham's Nutrient Mixture F12, serum-free | Millipore Sigma | 51651C-1000ML | |
| Centrifuge, refrigerated with swinging bucket rotor | Eppendorf | 5810R | |
| Chloroform | Acros Organics | 423555000 | |
| Conical tube, 15 mL | VWR | 21008-216 | |
| Conical tube, 50 mL | VWR | 21008-242 | |
| Coverslips, glass, 12 mm | Corning | 2975-245 | |
| Cryostat, Leica CM1950 | Leica Biosystems | CM1950 | |
| Delicate task wipe, Kim Wipes | Kimberly-Clark | 34155 | |
| Dextran, Lysine fixable, High Molecular Weight (HMW) | Invitrogen | D1818 | MW = 70,000, Tetramethylrhodamine |
| Dextran, Neutral, High Molecular Weight (HMW) | Invitrogen | D1819 | |
| Dulbecco's Modified Eagle Medium (DMEM), serum-free | Fisher Scientific | 11885076 | |
| Dry ice | Local delivery | Custom order | |
| Epifluorescent imaging system, Nikon NiU and Nikon NIS Elements acquisition software | Nikon | Custom order | |
| Ethanol | Fisher Scientific | BP2818-4 | |
| Fetal bovine serum (FBS) | ThermoFisher | 16000044 | |
| Forceps, Dumont #7, curved | Fine Science Tools | 11274-20 | |
| Forceps, Dumont #5, straight | Fine Science Tools | 11254-20 | |
| Gloves (small, medium, large) | Microflex | N191, N192, N193 | |
| Gloves, MAPA Temp-Ice 700 Thermal (for handling dry ice) | Fisher Scientific | 19-046-563 | |
| Hemocytometer | Daigger | EF16034F EA | |
| Incubator, cell culture | Eppendorf | Galaxy 170 S | |
| Labelling tape | Fisher Scientific | 159015R | |
| Marking pen, Sharpie (ultra-fine) | Staples | 642736 | |
| Mice, immunodeficient (Nu/J) | Jackson Laboratory | 2019 | |
| Microcentrifuge, accuSpin Micro17 | Fisher Scientific | 13-100-675 | |
| Microcentrifgue tubes, Eppendorf tubes (1.5 mL) | Axygen | MCT-150-C | |
| Microscope slide box | Fisher Scientific | 50-751-4983 | |
| Needle, 27 gauge | Becton-Dickinson | 752 0071 | |
| Paintbrush | Grainger | 39AL12 | |
| Paper towels | Staples | 33550 | |
| Paraformaldehyde | Acros Organics | 416785000 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Perforated spoon, 15 mm diameter, 135 mm length | Roboz Surgical Instrument Co. | RS-6162 | |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP3991 | |
| Pipet tips (10 μL) | Fisher Scientific | 02-707-438 | |
| Pipet tips (200 μL) | Fisher Scientific | 02-707-411 | |
| Pipet tips (1000 μL) | Fisher Scientific | 02-707-403 | |
| Pipets, serological (10 mL) | VWR | 89130-910 | |
| Pippetor, Gilson P2 | Daigger | EF9930A | |
| Pipettor Starter Kit, Gilson (2-10 μL, 20-200 μL, 200-1000 μL) | Daigger | EF9931A | |
| Platform shaker – orbital, benchtop | Cole-Parmer | EW-51710-23 | |
| Positively-charged microscope slides, Superfrost | Fisher Scientific | 12-550-15 | |
| Scalpel, size 10, Surgical Design, Inc. | Fisher Scientific | 22-079-707 | |
| Scissors, surgical – sharp, curved | Fine Science Tools | 14005-12 | |
| Software for image analysis, Nikon Elements | Nikon | Custom order | |
| Software for image analysis, ImageJ (FIJI) | National Institutes of Health | n/a | Download online (free) |
| Specimen disc 30 mm (chuck holder), cryostat accessory | Leica Biosystems | 14047740044 | |
| Staining tray, 245 mm BioAssay Dish | Corning | 431111 | |
| Syringe, 1 cc | Becton-Dickinson | 309623 | |
| Tape, laboratory, 19 mm width | Fisher Scientific | 15-901-5R | |
| Timer | Fisher Scientific | 14-649-17 | |
| Tissue culture dish, 100 x 15 mm diameter | Fisher Scientific | 08-757-100D | |
| Tissue culture flask, 225 cm2 | ThermoFisher | 159933 | |
| Tissue culture plate, 24-well | Becton-Dickinson | 353226 | |
| Tissue embedding mold, stainless steel | Tissue Tek | 4161 | |
| Tissue Freezing Medium, Optimal Cutting Temperature (OCT) | Fisher Scientific | 4585 | |
| Trypsin-EDTA (ethylenediaminetetraacetic acid), 0.25% | Gibco | 25200072 | |
| Water bath, Precision GP 2S | ThermoFisher | TSGP2S |
References
- Pavlova, N. N., Thompson, C. B. The emerging hallmarks of cancer metabolism. Cell Metabolism. 23 (1), 27-47 (2016).
- Pellegatti, P., et al. Increased level of extracellular ATP at tumor sites: in vivo imaging with plasma membrane luciferase. PLoS ONE. 3, 25992008 (2008).
- Falzoni, S., Donvito, G., Di Virgilio, F. Detecting adenosine triphosphate in the pericellular space. Interface Focus. 3 (3), 20120101 (2013).
- Michaud, M., et al. Autophagy-dependent anticancer immune responses induced by chemotherapeutic agents in mice. Science. 334, 1573-1577 (2011).
- Wilhelm, K., et al. Graft-versus-host disease is enhanced by extracellular ATP activating P2X7R. Nature Medicine. 16, 1434-1438 (2010).
- Vander Heiden, M. G., Cantley, L. C., Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324, 1029-1033 (2009).
- Cairns, R. A., Harris, I. S., Mak, T. W. Regulation of cancer cell metabolism. Nature Reviews Cancer. 11, 85-95 (2011).
- Chen, X., Qian, Y., Wu, S. The Warburg effect: evolving interpretations of an established concept. Free Radical Biology & Medicine. 79, 253-263 (2015).
- Wang, X., et al. Extracellular ATP, as an energy and phosphorylating molecule, induces different types of drug resistances in cancer cells through ATP internalization and intracellular ATP level increase. Oncotarget. 8 (5), 87860-87877 (2017).
- Patel, A., et al. ATP as a biological hydrotrope. Science. 356, 753-756 (2017).
- Qian, Y., et al. Extracellular ATP is internalized by macropinocytosis and induces intracellular ATP increase and drug resistance in cancer cells. Cancer Letters. 351, 242-251 (2014).
- Qian, Y., Wang, X., Li, Y., Cao, Y., Chen, X. Extracellular ATP a new player in cancer metabolism: NSCLC cells internalize ATP in vitro and in vivo using multiple endocytic mechanisms. Molecular Cancer Research. 14, 1087-1096 (2016).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497, 633-637 (2013).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biology International. 39, 531-539 (2015).
- Yanagawa, Y., Matsumoto, M., Togashi, H. Enhanced dendritic cell antigen uptake via alpha2 adrenoceptor-mediated PI3K activation following brief exposure to noradrenaline. Journal of Immunology. 185, 5762-5768 (2010).
- Hoppe, H. C., et al. Antimalarial quinolines and artemisinin inhibit endocytosis in Plasmodium falciparum. Antimicrobial Agents & Chemotherapy. 48, 2370-2378 (2004).
- Chaudry, I. H. Does ATP cross the cell plasma membrane. Yale Journal of Biology & Medicine. 55, 1-10 (1982).
- Pant, H. C., Terakawa, S., Yoshioka, T., Tasaki, I., Gainer, H. Evidence for the utilization of extracellular [gamma-32P]ATP for the phosphorylation of intracellular proteins in the squid giant axon. Biochimica et Biophysica Acta. 582, 107-114 (1979).
- Chaudry, I. H., Baue, A. E. Further evidence for ATP uptake by rat tissues. Biochimica et Biophysica Acta. 628, 336-342 (1980).
- Koppenol, W. H., Bounds, P. L., Dang, C. V. Otto Warburg’s contributions to current concepts of cancer metabolism. Nature Reviews Cancer. 11, 325-337 (2011).
- Dang, C. V. Links between metabolism and cancer. Genes & Development. 26, 877-890 (2012).
- Israelsen, W. J., Vander Heiden, M. G. ATP consumption promotes cancer metabolism. Cell. 143, 669-671 (2010).
- Koster, J. C., Permutt, M. A., Nichols, C. G. Diabetes and insulin secretion: the ATP-sensitive K+ channel (K ATP) connection. Diabetes. 54, 3065-3072 (2005).
- Szendroedi, J., et al. Muscle mitochondrial ATP synthesis and glucose transport/phosphorylation in type 2 diabetes. PLoS Medicine. 4, 154 (2007).
- Miyamoto, S., et al. Mass spectrometry imaging reveals elevated glomerular ATP/AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator. EBioMedicine. 7, 121-134 (2016).

