Fluorescensmikroskopi for ATP Internalisering mediert av makropinocytose i humane tumorceller og tumor-xenograftede mus
Summary
Vi utviklet en reproduserbar metode for å visualisere internaliseringen av ikke-hydroolyzable fluorescerende adenosin triphosfat (ATP), en ATP surrogat, med høy cellulær oppløsning. Vi validerte metoden vår ved hjelp av uavhengige in vitro- og in vivo-analyser-menneskelige tumorcellelinjer og immunodeficient mus xenografted med humant tumorvev.
Abstract
Adenosin tripfosfat (ATP), inkludert ekstracellulær ATP (eATP), har vist seg å spille betydelige roller i ulike aspekter av tumorigenesis, som narkotikaresistens, epitel-mesenchymal overgang (EMT) og metastase. Intratumoral eATP er 103 til 104 ganger høyere i konsentrasjon enn i normalt vev. Mens eATP fungerer som en budbringer for å aktivere purinergisk signalering for EMT-induksjon, er den også internalisert av kreftceller gjennom upregulert makropinocytose, en bestemt type endokytose, for å utføre et bredt spekter av biologiske funksjoner. Disse funksjonene inkluderer å gi energi til ATP-krevende biokjemiske reaksjoner, donere fosfatgrupper under signaltransduksjon, og legge til rette for eller akselerere genuttrykk som transkripsjonell kofaktor. ATP er lett tilgjengelig, og studien på kreft og andre felt vil utvilsomt øke. Imidlertid forblir eATP-studien på et tidlig stadium, og uløste spørsmål forblir ubesvart før de viktige og allsidige aktivitetene som spilles av eATP og internalisert intracellulær ATP kan løses helt.
Disse forfatternes laboratoriers bidrag til disse tidlige eATP-studiene inkluderer mikroskopisk avbildning av ikke-hydrolysbar fluorescerende ATP, kombinert med høy- og lavmolekylære fluorescerende dextrans, som fungerer som makropinocytose og endokytosesporere, samt ulike endokytosehemmere, for å overvåke og karakterisere eATP-internaliseringsprosessen. Denne avbildningsmodaliteten ble brukt på tumorcellelinjer og på immunodeficient mus, xenografted med menneskelige kreftsvulster, for å studere eATP internalisering in vitro og in vivo. Dette dokumentet beskriver disse in vitro- og in vivo-protokollene, med vekt på å endre og finjustere analyseforhold slik at makropinocytose-/endokytosemediert eATP internaliseringsanalyser kan utføres i forskjellige systemer.
Introduction
Det opportunistiske opptaket av intratumorale ekstracellulære (dvs.) næringsstoffer har nylig blitt kalt et sentralt kjennetegn for kreftmetabolisme1. Et av disse viktige næringsstoffene er ATP, da konsentrasjonen av ieATP er 103 og 104 ganger høyere enn den som finnes i normalt vev, i området flere hundre μM til lav mM2,3,4,5. Som et viktig energi- og signalmolekyl spiller ATP en sentral rolle i cellulær metabolisme i kreft og sunne celler6,7,8. Ekstracellulær ATP er ikke bare involvert i kreftcellevekst, men det fremmer også legemiddelresistens9. Tidligere ukjente funksjoner av ATP, som hydrotropisk aktivitet, har nylig blitt identifisert, og dermed implisert ATP-involvering i sykdommer som Alzheimers10. Faktisk ser det ut til at vår forståelse av ATP og dens funksjoner i kreftceller, sunne celler og andre syke celler er langt fra komplett. På grunn av ATPs ustabilitet og høye omsetningshastigheter i celler er det imidlertid teknisk utfordrende å overvåke ATPs bevegelse over cellemembranen og inn i cellen.
For å løse dette problemet og fylle behovet for dette forskningsområdet, ble det utviklet en metode der ikke-hydroolysert fluorescerende ATP (NHF-ATP) (figur 1) ble brukt som surrogat for å visualisere internaliseringen av ATP og observere den intracellulære romlige lokaliseringen av internalisert ATP, både in vitro og in vivo11,12 . NHF-ATP har vist seg å erstatte endogen ATP for å undersøke ATP-bevegelse på tvers av dyrecellemembraner, både i kreftcellelinjer og i humant tumorvev xenograftert på immunodeficient mus11,12. Videre, administrere makropinocytosehemmere til celler blokkert eATP internalisering, noe som tyder på at intracellulært opptak av eATP innebærer en makropinocytotisk mekanisme9,11,12. Denne protokollen tillater immunobased colabeling mot cellespesifikke proteiner og dermed identifisering av hvilken celletype som internaliserer NHF-ATP. Ved hjelp av in vivo tumor xenografts og høyoppløselig mikroskopi kan NHF-ATP visualiseres romlig over vevsprøven og til og med i en enkelt celle. Disse metodene tillater også kvantitativ analyse, for eksempel prosentandelen av cellulært opptak, antall makropinocytotiske vesikler og internaliseringskinetikk. Dette dokumentet beskriver i detalj hvordan NHF-ATP, som arbeider alene eller sammen med endokytose-tracer fluorescerende dextrans13,14,15,16, kan brukes i forskjellige eksperimentelle omgivelser for å studere ATPs internalisering og intracellulær lokalisering, etter internalisering i celler.
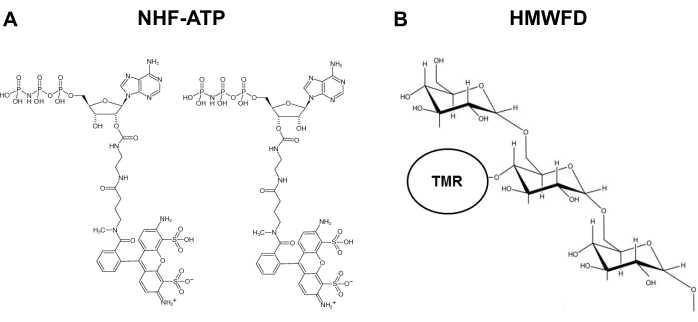
Figur 1: Strukturer av ikke-hydroolyzable fluorescerende ATP og tetrametylrhodamin merket høymolekylær fluorescerende dextran. (A) Struktur av NHF-ATP. (B) Skjematisk representasjon av HMWFD. Forkortelser: ATP = adenosin tripfosfat; NHF-ATP = ikke-hydroolyzable fluorescerende ATP; TMR = tetrametylrhodamin; HMWFD = fluorescerende dekstran med høy molekylvekt. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
En metode ble utviklet for romlig, tidsmessig og kvantitativ analyse av cellulær internalisering av ikke-hydroolysert ATP. Denne metoden er bredt anvendelig for bruk i ulike biologiske systemer, inkludert ulike tumorigeniske modeller, som vi gir teknisk instruksjon og representative data for. For å innhente tolkedata under in vivo ATP internaliseringsstudier (paragraf 4 i protokollen), er det viktig å begrense den eksperimentelle tiden som går fra intratumoral dekstraninjeksjon til kryo-innebygging. Å fikse…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Kryosectioning ble utført på stedet ved Ohio University Histopathology Core. Dette arbeidet ble delvis støttet av oppstartsfond (Ohio University College of Arts &Sciences) til C Nielsen; NIH gir R15 CA242177-01 og RSAC-prisen til X Chen.
Materials
| A549 cells, human lung epithelial, carcinoma | National Cancer Institute | n/a | Less expensive source |
| Acetone | Fisher Scientific | S25904 | |
| Aluminum foil, Reynolds | Grainger | 6CHG6 | |
| Aqueous Mounting Medium, ProLong Gold Anti-fade Reagent | ThermoFisher | P36930 | |
| ATP analog | Jena Biosciences | NK-101 | |
| Autoclave, sterilizer | Grainger | 33ZZ40 | |
| Blades, cryostat, high profile | C. L. Sturkey, Inc. | DT554550 | |
| Calipers, vernier | Grainger | 4KU77 | |
| Cell medium, Ham's Nutrient Mixture F12, serum-free | Millipore Sigma | 51651C-1000ML | |
| Centrifuge, refrigerated with swinging bucket rotor | Eppendorf | 5810R | |
| Chloroform | Acros Organics | 423555000 | |
| Conical tube, 15 mL | VWR | 21008-216 | |
| Conical tube, 50 mL | VWR | 21008-242 | |
| Coverslips, glass, 12 mm | Corning | 2975-245 | |
| Cryostat, Leica CM1950 | Leica Biosystems | CM1950 | |
| Delicate task wipe, Kim Wipes | Kimberly-Clark | 34155 | |
| Dextran, Lysine fixable, High Molecular Weight (HMW) | Invitrogen | D1818 | MW = 70,000, Tetramethylrhodamine |
| Dextran, Neutral, High Molecular Weight (HMW) | Invitrogen | D1819 | |
| Dulbecco's Modified Eagle Medium (DMEM), serum-free | Fisher Scientific | 11885076 | |
| Dry ice | Local delivery | Custom order | |
| Epifluorescent imaging system, Nikon NiU and Nikon NIS Elements acquisition software | Nikon | Custom order | |
| Ethanol | Fisher Scientific | BP2818-4 | |
| Fetal bovine serum (FBS) | ThermoFisher | 16000044 | |
| Forceps, Dumont #7, curved | Fine Science Tools | 11274-20 | |
| Forceps, Dumont #5, straight | Fine Science Tools | 11254-20 | |
| Gloves (small, medium, large) | Microflex | N191, N192, N193 | |
| Gloves, MAPA Temp-Ice 700 Thermal (for handling dry ice) | Fisher Scientific | 19-046-563 | |
| Hemocytometer | Daigger | EF16034F EA | |
| Incubator, cell culture | Eppendorf | Galaxy 170 S | |
| Labelling tape | Fisher Scientific | 159015R | |
| Marking pen, Sharpie (ultra-fine) | Staples | 642736 | |
| Mice, immunodeficient (Nu/J) | Jackson Laboratory | 2019 | |
| Microcentrifuge, accuSpin Micro17 | Fisher Scientific | 13-100-675 | |
| Microcentrifgue tubes, Eppendorf tubes (1.5 mL) | Axygen | MCT-150-C | |
| Microscope slide box | Fisher Scientific | 50-751-4983 | |
| Needle, 27 gauge | Becton-Dickinson | 752 0071 | |
| Paintbrush | Grainger | 39AL12 | |
| Paper towels | Staples | 33550 | |
| Paraformaldehyde | Acros Organics | 416785000 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Perforated spoon, 15 mm diameter, 135 mm length | Roboz Surgical Instrument Co. | RS-6162 | |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP3991 | |
| Pipet tips (10 μL) | Fisher Scientific | 02-707-438 | |
| Pipet tips (200 μL) | Fisher Scientific | 02-707-411 | |
| Pipet tips (1000 μL) | Fisher Scientific | 02-707-403 | |
| Pipets, serological (10 mL) | VWR | 89130-910 | |
| Pippetor, Gilson P2 | Daigger | EF9930A | |
| Pipettor Starter Kit, Gilson (2-10 μL, 20-200 μL, 200-1000 μL) | Daigger | EF9931A | |
| Platform shaker – orbital, benchtop | Cole-Parmer | EW-51710-23 | |
| Positively-charged microscope slides, Superfrost | Fisher Scientific | 12-550-15 | |
| Scalpel, size 10, Surgical Design, Inc. | Fisher Scientific | 22-079-707 | |
| Scissors, surgical – sharp, curved | Fine Science Tools | 14005-12 | |
| Software for image analysis, Nikon Elements | Nikon | Custom order | |
| Software for image analysis, ImageJ (FIJI) | National Institutes of Health | n/a | Download online (free) |
| Specimen disc 30 mm (chuck holder), cryostat accessory | Leica Biosystems | 14047740044 | |
| Staining tray, 245 mm BioAssay Dish | Corning | 431111 | |
| Syringe, 1 cc | Becton-Dickinson | 309623 | |
| Tape, laboratory, 19 mm width | Fisher Scientific | 15-901-5R | |
| Timer | Fisher Scientific | 14-649-17 | |
| Tissue culture dish, 100 x 15 mm diameter | Fisher Scientific | 08-757-100D | |
| Tissue culture flask, 225 cm2 | ThermoFisher | 159933 | |
| Tissue culture plate, 24-well | Becton-Dickinson | 353226 | |
| Tissue embedding mold, stainless steel | Tissue Tek | 4161 | |
| Tissue Freezing Medium, Optimal Cutting Temperature (OCT) | Fisher Scientific | 4585 | |
| Trypsin-EDTA (ethylenediaminetetraacetic acid), 0.25% | Gibco | 25200072 | |
| Water bath, Precision GP 2S | ThermoFisher | TSGP2S |
References
- Pavlova, N. N., Thompson, C. B. The emerging hallmarks of cancer metabolism. Cell Metabolism. 23 (1), 27-47 (2016).
- Pellegatti, P., et al. Increased level of extracellular ATP at tumor sites: in vivo imaging with plasma membrane luciferase. PLoS ONE. 3, 25992008 (2008).
- Falzoni, S., Donvito, G., Di Virgilio, F. Detecting adenosine triphosphate in the pericellular space. Interface Focus. 3 (3), 20120101 (2013).
- Michaud, M., et al. Autophagy-dependent anticancer immune responses induced by chemotherapeutic agents in mice. Science. 334, 1573-1577 (2011).
- Wilhelm, K., et al. Graft-versus-host disease is enhanced by extracellular ATP activating P2X7R. Nature Medicine. 16, 1434-1438 (2010).
- Vander Heiden, M. G., Cantley, L. C., Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324, 1029-1033 (2009).
- Cairns, R. A., Harris, I. S., Mak, T. W. Regulation of cancer cell metabolism. Nature Reviews Cancer. 11, 85-95 (2011).
- Chen, X., Qian, Y., Wu, S. The Warburg effect: evolving interpretations of an established concept. Free Radical Biology & Medicine. 79, 253-263 (2015).
- Wang, X., et al. Extracellular ATP, as an energy and phosphorylating molecule, induces different types of drug resistances in cancer cells through ATP internalization and intracellular ATP level increase. Oncotarget. 8 (5), 87860-87877 (2017).
- Patel, A., et al. ATP as a biological hydrotrope. Science. 356, 753-756 (2017).
- Qian, Y., et al. Extracellular ATP is internalized by macropinocytosis and induces intracellular ATP increase and drug resistance in cancer cells. Cancer Letters. 351, 242-251 (2014).
- Qian, Y., Wang, X., Li, Y., Cao, Y., Chen, X. Extracellular ATP a new player in cancer metabolism: NSCLC cells internalize ATP in vitro and in vivo using multiple endocytic mechanisms. Molecular Cancer Research. 14, 1087-1096 (2016).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497, 633-637 (2013).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biology International. 39, 531-539 (2015).
- Yanagawa, Y., Matsumoto, M., Togashi, H. Enhanced dendritic cell antigen uptake via alpha2 adrenoceptor-mediated PI3K activation following brief exposure to noradrenaline. Journal of Immunology. 185, 5762-5768 (2010).
- Hoppe, H. C., et al. Antimalarial quinolines and artemisinin inhibit endocytosis in Plasmodium falciparum. Antimicrobial Agents & Chemotherapy. 48, 2370-2378 (2004).
- Chaudry, I. H. Does ATP cross the cell plasma membrane. Yale Journal of Biology & Medicine. 55, 1-10 (1982).
- Pant, H. C., Terakawa, S., Yoshioka, T., Tasaki, I., Gainer, H. Evidence for the utilization of extracellular [gamma-32P]ATP for the phosphorylation of intracellular proteins in the squid giant axon. Biochimica et Biophysica Acta. 582, 107-114 (1979).
- Chaudry, I. H., Baue, A. E. Further evidence for ATP uptake by rat tissues. Biochimica et Biophysica Acta. 628, 336-342 (1980).
- Koppenol, W. H., Bounds, P. L., Dang, C. V. Otto Warburg’s contributions to current concepts of cancer metabolism. Nature Reviews Cancer. 11, 325-337 (2011).
- Dang, C. V. Links between metabolism and cancer. Genes & Development. 26, 877-890 (2012).
- Israelsen, W. J., Vander Heiden, M. G. ATP consumption promotes cancer metabolism. Cell. 143, 669-671 (2010).
- Koster, J. C., Permutt, M. A., Nichols, C. G. Diabetes and insulin secretion: the ATP-sensitive K+ channel (K ATP) connection. Diabetes. 54, 3065-3072 (2005).
- Szendroedi, J., et al. Muscle mitochondrial ATP synthesis and glucose transport/phosphorylation in type 2 diabetes. PLoS Medicine. 4, 154 (2007).
- Miyamoto, S., et al. Mass spectrometry imaging reveals elevated glomerular ATP/AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator. EBioMedicine. 7, 121-134 (2016).

