Neutronspektroskopi med høj opløsning til undersøgelse af picosekund-nanosekunddynamik af proteiner og hydreringsvand
Summary
Neutron backscattering spektroskopi giver en ikke-destruktiv og etiketfri adgang til ps-ns dynamikken i proteiner og deres hydreringsvand. Arbejdsprocessen præsenteres med to undersøgelser af amyloidproteiner: på lysozyms tidsopløste dynamik under aggregering og på hydreringsvanddynamikken i tau ved fiberdannelse.
Abstract
Neutronspredning giver mulighed for at undersøge dynamikken i prøver for en bred vifte af energier på en ikke-destruktiv måde og uden anden mærkning end deuterium. Især registrerer neutron backscattering spektroskopi spredningssignalerne ved flere spredningsvinkler samtidigt og er velegnet til at studere dynamikken i biologiske systemer på ps-ns tidsskalaen. Ved at anvende D2O- og muligvis deutererede bufferkomponenter muliggør metoden overvågning af både massecenterdiffusion og rygrads- og sidekædebevægelser (intern dynamik) af proteiner i flydende tilstand.
Derudover kan hydreringsvanddynamikken studeres ved at anvende pulvere af perdeutererede proteiner hydreret medH2O. Dette papir præsenterer arbejdsgangen anvendt på instrumentet IN16B på Institut Laue-Langevin (ILL) for at undersøge protein- og hydreringsvanddynamik. Fremstillingen af opløsningsprøver og hydratiserede proteinpulverprøver ved hjælp af dampudveksling forklares. Dataanalyseproceduren for både protein- og hydreringsvanddynamik er beskrevet for forskellige typer datasæt (kvasielastiske spektre eller scanninger med fast vindue), der kan opnås på et neutronbackscattering-spektrometer.
Metoden illustreres med to studier med amyloidproteiner. Aggregeringen af lysozym i sfæriske aggregater i μm-størrelse – betegnet partikler – er vist at forekomme i en ettrinsproces på rum- og tidsintervallet undersøgt på IN16B, mens den interne dynamik forbliver uændret. Endvidere blev dynamikken i hydreringsvand af tau undersøgt på hydratiserede pulvere af perdeutereret protein. Det er vist, at translationelle bevægelser af vand aktiveres ved dannelsen af amyloidfibre. Endelig diskuteres kritiske trin i protokollen om, hvordan neutronspredning er placeret med hensyn til studiet af dynamik med hensyn til andre eksperimentelle biofysiske metoder.
Introduction
Neutronen er en ladningsfri og massiv partikel, der med succes er blevet brugt gennem årene til at undersøge prøver på forskellige områder fra grundlæggende fysik til biologi1. Til biologiske anvendelser anvendes småvinkel neutronspredning, uelastisk neutronspredning og neutronkrystallografi og reflektometri i vid udstrækning 2,3,4. Uelastisk neutronspredning giver en ensemble-gennemsnitlig måling af dynamikken uden at kræve specifik mærkning i sig selv og en signalkvalitet, der ikke afhænger af størrelsen eller proteinet5. Målingen kan udføres ved hjælp af et meget komplekst miljø for det undersøgte protein, der efterligner det intracellulære medium, såsom et deutereret bakterielt lysat eller endda in vivo 3,6,7. Forskellige eksperimentelle opsætninger kan bruges til at studere dynamikken, nemlig i) time-of-flight-giver adgang til sub-ps-ps-dynamik, ii) backscattering-giver adgang til ps-ns-dynamik og iii) spin-ekko-giver adgang til dynamik fra ns til hundredvis af ns. Neutron backscattering gør brug af Braggs lov 2d sinθ = nλ, hvor d er afstanden mellem planer i en krystal, θ spredningsvinklen, n spredningsrækkefølgen og λ bølgelængden. Brugen af krystaller til backscattering mod detektorerne giver mulighed for at opnå en høj opløsning i energi, typisk ~ 0,8 μeV. For at måle energiudvekslingen bruges enten et Doppler-drev, der bærer en krystal i backscattering, til at definere og indstille den indkommende neutronbølgelængde 8,9,10 (figur 1), eller en time-of-flight-opsætning kan bruges på bekostning af et fald i energiopløsning 11.
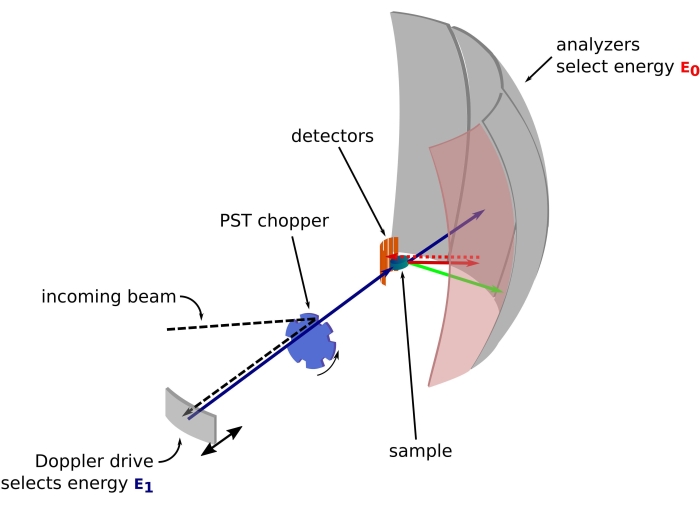
Figur 1: Skitse af et neutron backscattering spektrometer med et Doppler-drev. Den indkommende stråle rammer faserumstransformationen (PST) chopper42, hvilket øger fluxen ved prøvepositionen. Det spredes derefter tilbage mod prøven af Doppler-drevet, som vælger en energi E1 (cyanpil). Neutronerne spredes derefter af prøven (med forskellige energier repræsenteret af pilenes farve), og analysatorerne, der er lavet af Si 111-krystaller, vil kun backscatter neutroner med en bestemt energi E0 (rødfarvede pile her). Derfor opnås momentumoverførslen q fra neutronens detekterede position på detektorarrayet, og energioverførslen opnås fra forskellen E1– E0. Den forventede flyvetid for neutronpulsen produceret af PST bruges til at kassere signalet fra neutronerne spredt direkte mod detektorrørene. Forkortelse: PST = fase rumtransformation. Klik her for at se en større version af denne figur.
For backscattering-spektroskopi kommer hovedbidraget til signalet fra hydrogenprotonrige prøver, såsom proteiner, fra usammenhængende spredning, for hvilken spredningsintensiteten Sinc(q, ω) er vist ved Eq (1)12
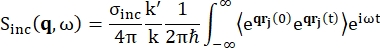 (1)
(1)
Hvor σinc er det usammenhængende tværsnit af det betragtede element, er k’ normen for den spredte bølgevektor, k normen for den indkommende bølgevektor, q (= k – k’) momentumoverførslen, r j (t) positionsvektoren for atom j på tidspunktet t og ω frekvensen svarende til energioverførslen mellem den indkommende neutron og systemet. Vinkelbeslagene angiver ensemblegennemsnittet. Derfor undersøger usammenhængende spredning den ensemble-gennemsnitlige enkeltpartikel-selvkorrelation af atompositioner med tiden og giver selvdynamikken i gennemsnit over alle atomer i systemet og forskellige tidsoprindelser (ensemblegennemsnit). Spredningsfunktionen er Fouriertransformationen i tid af den mellemliggende spredningsfunktion I(q, t), der kan ses som Fouriertransformationen i rummet af van Hove-korrelationsfunktionen vist ved Eq (2):
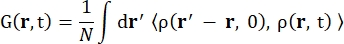 (2)
(2)
Hvor ρ(r,t) er sandsynlighedstætheden for at finde et atom i position r og tid t 13.
For en fickiansk diffusionsproces resulterer selvdiffusionsfunktionen (se Eq (3)) efter en dobbelt Fourier-transformation i en spredningsfunktion bestående af en Lorentzian med linjebredde givet ved γ = Dq2.
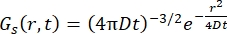 (3)
(3)
Mere sofistikerede modeller blev udviklet og fundet nyttige, såsom springdiffusionsmodellen af Singwi og Sjölander til ps-ns interne proteindynamik14 eller rotationsmodellen af Sears til hydreringsvand15,16,17.
På neutron backscattering (NBS) instrumentet IN16B 8,9 ved ILL, Grenoble, Frankrig (supplerende figur S1), består en opsætning, der almindeligvis anvendes med proteiner, af Si 111-krystaller til analysatorerne med et Doppler-drev til tuning af den indkommende bølgelængde (supplerende figur S2A), hvilket giver adgang til momentumoverførselsområdet ~ 0,2 Å-1 < q < ~ 2 Å-1 og energioverførselsområdet på –30 μeV < 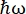 < 30 μeV – svarende til tidsskalaer fra nogle få ps til nogle få ns og afstande på nogle få Å. Derudover giver IN16B mulighed for at udføre elastiske og uelastiske fastvinduesscanninger (E/IFWS)10, som omfatter dataindsamling ved en fast energioverførsel. Da fluxen er begrænset, når man arbejder med neutroner, tillader E/IFWS maksimering af fluxen for en energioverførsel, hvilket reducerer den anskaffelsestid, der er nødvendig for at opnå et tilfredsstillende signal-støj-forhold. En nyere mulighed er backscattering og time-of-flight spektrometer (BATS) mode11, som muliggør måling af en lang række energioverførsler (f.eks. -150 μeV < <
< 30 μeV – svarende til tidsskalaer fra nogle få ps til nogle få ns og afstande på nogle få Å. Derudover giver IN16B mulighed for at udføre elastiske og uelastiske fastvinduesscanninger (E/IFWS)10, som omfatter dataindsamling ved en fast energioverførsel. Da fluxen er begrænset, når man arbejder med neutroner, tillader E/IFWS maksimering af fluxen for en energioverførsel, hvilket reducerer den anskaffelsestid, der er nødvendig for at opnå et tilfredsstillende signal-støj-forhold. En nyere mulighed er backscattering og time-of-flight spektrometer (BATS) mode11, som muliggør måling af en lang række energioverførsler (f.eks. -150 μeV < < 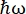 150 μeV) med en højere flux end med Doppler-drevet, men på bekostning af en lavere energiopløsning (supplerende figur S2B).
150 μeV) med en højere flux end med Doppler-drevet, men på bekostning af en lavere energiopløsning (supplerende figur S2B).
En vigtig egenskab ved neutronspredning er, at det usammenhængende tværsnit σinc har en 40 gange højere værdi for hydrogen end for deuterium og er ubetydelig for andre grundstoffer, der almindeligvis findes i biologiske prøver. Derfor kan dynamikken af proteiner i et flydende miljø studeres ved hjælp af en deutereret buffer, og pulvertilstanden muliggør undersøgelse af enten proteinets indre dynamik med hydrogeneret proteinpulver hydreret med D 2 Oeller undersøgelsen af hydreringsvand til perdeutereret proteinpulver hydreret med H2O. I flydende tilstand tillader neutron backscattering typisk samtidig adgang til massecentrets selvdiffusion af proteiner (Fickian-type diffusion) og deres interne dynamik. Sidstnævnte er rygrads- og sidekædebevægelser, der normalt beskrives af den såkaldte springdiffusionsmodel eller andre 3,18. I hydrogeneret proteinpulver er proteindiffusionen fraværende, og kun intern dynamik skal modelleres. For hydreringsvand præsenterer bidragene fra translationelle og rotationsbevægelser af vandmolekyler en anden afhængighed af momentumoverførslen q, hvilket muliggør deres sondring i dataanalyseprocessen17.
Dette papir illustrerer neutron backscattering metoden med undersøgelsen af proteiner, der viste sig at være i stand til at udfolde sig, aggregere i en kanonisk form bestående af stakke af β-strenge – det såkaldte cross-β mønster 19,20 – og danne aflange fibre. Dette er den såkaldte amyloidaggregering, som er grundigt undersøgt på grund af dens centrale rolle i neurodegenerative lidelser som Alzheimers eller Parkinsons sygdomme21,22. Undersøgelsen af amyloidproteinerne er også motiveret af den funktionelle rolle, de kan spille 23,24 eller deres store potentiale for udvikling af nye biomaterialer25. De fysisk-kemiske determinanter for amyloidaggregeringen forbliver uklare, og der findes ingen generel teori om amyloidaggregering på trods af enorme fremskridt i de seneste år21,26.
Amyloidaggregering indebærer ændringer i proteinstruktur og stabilitet med tiden, hvis undersøgelse naturligt indebærer dynamik, knyttet til proteinkonformationsstabilitet, proteinfunktion og proteinenergilandskab27. Dynamik er direkte knyttet til stabiliteten af en bestemt tilstand gennem det entropiske bidrag til de hurtigste bevægelser28, og proteinfunktionen kan opretholdes af bevægelser på forskellige tidsskalaer fra sub-ps for lysfølsomme proteiner29 til ms for domænebevægelser, hvilket kan lettes af picosekund-nanosekund dynamik30.
To eksempler på anvendelse af neutron backscattering spektroskopi til at studere amyloidproteiner vil blive præsenteret, et i flydende tilstand for at studere proteindynamik og et i hydratiseret pulvertilstand for at studere hydreringsvanddynamik. Det første eksempel vedrører aggregering af lysozym i μm-store kugler (kaldet partikler) efterfulgt i realtid5, og det andet en sammenligning af vanddynamik i indfødte og aggregerede tilstande af det humane protein tau31.
Lysozym er et enzym involveret i immunforsvaret og består af 129 aminosyrerester. Lysozym kan danne partikler i deutereret buffer ved pD på 10,5 og ved en temperatur på 90 °C. Med neutronspredning viste vi, at tidsudviklingen af lysozyms center-of-mass diffusionskoefficient følger den enkelte eksponentielle kinetik af thioflavin T-fluorescens (en fluorescerende sonde, der bruges til at overvåge dannelsen af amyloid cross-β mønstre32), hvilket indikerer, at formationspartikeloverbygningerne og tvær-β mønstre forekommer i et enkelt trin med samme hastighed. Desuden forblev den interne dynamik konstant gennem hele aggregeringsprocessen, hvilket kan forklares enten ved en hurtig konformationsændring, der ikke kan observeres på NBS-instrumenter, eller ved fraværet af signifikant ændring i proteinintern energi ved aggregering.
Det humane protein tau er et iboende forstyrret protein (IDP) bestående af 441 aminosyrer til den såkaldte 2N4R-isoform, som især er involveret i Alzheimers sygdom33. Ved hjælp af neutron backscattering på pulvere af perdeutereret protein tau viste vi, at hydreringsvanddynamikken øges i fibertilstanden, med en højere population af vandmolekyler, der gennemgår translationelle bevægelser. Resultatet tyder på, at en stigning i hydreringsvandentropi kan drive amyloidflimmer af tau.
Protocol
Representative Results
Discussion
Neutronspektroskopi er den eneste metode, der gør det muligt at undersøge proteinprøvers ensemble-gennemsnitlige ps-ns-dynamik uanset proteinets størrelse eller opløsningens kompleksitet, når deuteration anvendes6. Specifikt ved at undersøge selvdiffusion af proteinsamlinger i opløsning kan den hydrodynamiske størrelse af sådanne samlinger entydigt bestemmes. Ikke desto mindre er metoden almindeligvis begrænset af den lave neutronflux, hvilket indebærer lange erhvervelsestider og behov…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne takker Michaela Zamponi ved Jülich Centre for Neutron Science ved Heinz Maier-Leibnitz Zentrum, Garching, Tyskland, for en del af neutronspredningseksperimenterne udført på instrumentet SPHERES. Dette arbejde har nydt godt af aktiviteterne i konsortiet Deuteration Laboratory (DLAB), der finansieres af Den Europæiske Union i henhold til kontrakterne HPRI-2001-50065 og RII3-CT-2003-505925, og af UK Engineering and Physical Sciences Research Council (EPSRC)-finansierede aktiviteter inden for Institut Laue Langevin EMBL DLAB under tilskud GR/R99393/01 og EP/C015452/1. Støtte fra Europa-Kommissionen under det 7. rammeprogram gennem nøgleaktionen: styrkelse af det europæiske forskningsrum, forskningsinfrastrukturer anerkendes [kontrakt 226507 (NMI3)]. Kevin Pounot og Christian Beck takker Forbundsministeriet for Uddannelse og Forskning (BMBF, bevillingsnummer 05K19VTB) for finansiering af deres postdoc-stipendier.
Materials
| Aluminum sample holder | Not commercially available. Either the local contact on the instrument can provide them or they can be manufactured based on a technical drawing that can be provided by the local contact. | ||
| Deuterium chloride, 35 wt. % in D2O, ≥99 atom % D | Sigma-Aldrich | 543047 |
|
| Deuterium oxide (D, 99.9%) | Eurisotop | DLM-4DR-PK | |
| Dow Corning high-vacuum silicone grease | Sigma-Aldrich | Z273554-1EA | |
| Ethanol 96%, EMSURE Reag. Ph Eur | Sigma-Aldrich | 1.5901 | |
| Glass dessicator | VWR | 75871-660 | |
| Glass dessicator plate, 140 mm | VWR | 89038-068 | |
| Indium wire, 1.0 mm (0.04 in) dia, Puratronic, 99.999% | Alfa Aesar | 00470.G1 | |
| Lysozyme from chicken egg white dialyzed, lyophilized, powder, ~100,000 U/mg | Sigma-Aldrich | 62970 | |
| nPDyn | v3.x | see github.com/kpounot/nPDyn, model functions fot fitting also included in the software | |
| OHAUS AX324 Adventurer balance, internal calibration | Dutscher | 92641 | |
| Phosphorus pentoxide, ReagentPlus, 99% | Sigma-Aldrich | 214701 | |
| Pipette ErgoOne 0.5-10 μL | Starlab | S7100-0510 | |
| Pipette ErgoOne 100-1,000 μL | Starlab | S7100-1000 | |
| Pipette ErgoOne 20-200 μL | Starlab | S7100-2200 | |
| Pipette tip TipOne 1,000 μL | Starlab | S1111-6001 | |
| Pipette tip TipOne 10 μL | Starlab | S1111-3200 | |
| Pipette tip TipOne 200 μL | Starlab | S1111-0206 | |
| Sodium deuteroxide solution, 40 wt. % in D2O, 99.5 atom % D | Sigma-Aldrich | 372072 |
References
- Jacrot, B. Des neutrons pour la science: Histoire de l’Institut Laue-Langevin. Des neutrons pour la science. EDP Sciences. , (2021).
- Mahieu, E., Gabel, F. Biological small-angle neutron scattering: recent results and development. Acta Crystallographica Section D. 74 (8), 715-726 (2018).
- Grimaldo, M., Roosen-Runge, F., Zhang, F., Schreiber, F., Seydel, T. Dynamics of proteins in solution. Quarterly Reviews of Biophysics. 52, 7 (2019).
- Martel, A., et al. Membrane permeation versus amyloidogenicity: A multitechnique study of islet amyloid polypeptide interaction with model membranes. Journal of the American Chemical Society. 139 (1), 137-148 (2017).
- Pounot, K., et al. Tracking internal and global diffusive dynamics during protein aggregation by high-resolution neutron spectroscopy. The Journal of Physical Chemistry Letters. 11 (15), 6299-6304 (2020).
- Grimaldo, M., et al. Protein short-time diffusion in a naturally crowded environment. The Journal of Physical Chemistry Letters. 10 (8), 1709-1715 (2019).
- Jasnin, M., Stadler, A., Tehei, M., Zaccai, G. Specific cellular water dynamics observed in vivo by neutron scattering and NMR. Physical Chemistry Chemical Physics. 12 (35), 10154-10160 (2010).
- Frick, B. The neutron backscattering spectrometer IN16 at ILL-high energy resolution with high intensity and excellent signal-to-noise ratio. Neutron News. 13 (2), 15-22 (2002).
- Frick, B., Mamontov, E., van Eijck, L., Seydel, T. Recent backscattering instrument developments at the ILL and SNS. Zeitschrift für Physikalische Chemie. 224 (1-2), 33-60 (2010).
- Frick, B., Combet, J., van Eijck, L. New possibilities with inelastic fixed window scans and linear motor Doppler drives on high resolution neutron backscattering spectrometers. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 669, 7-13 (2012).
- Appel, M., Frick, B., Magerl, A. A flexible high speed pulse chopper system for an inverted neutron time-of-flight option on backscattering spectrometers. Scientific Reports. 8 (1), 13580 (2018).
- Squires, G. L. . Introduction to the theory of thermal neutron scattering. , (1996).
- Singwi, K. S., Sjölander, A. Diffusive motions in water and cold neutron scattering. Physical Review. 119 (3), 863-871 (1960).
- Sears, V. F. Theory of cold neutron scattering by homonuclear diatomic liquids: i. free rotation. Canadian Journal of Physics. 44 (6), 1279-1297 (1966).
- Sears, V. F. Theory of cold neutron scattering by homonuclear liquid: ii. hindered rotation. Canadian Journal of Physics. 44 (6), 1299-1311 (1966).
- Schirò, G., et al. Translational diffusion of hydration water correlates with functional motions in folded and intrinsically disordered proteins. Nature Communications. 6, 6490 (2015).
- Grimaldo, M., et al. Hierarchical molecular dynamics of bovine serum albumin in concentrated aqueous solution below and above thermal denaturation. Physical Chemistry Chemical Physics. 17 (6), 4645-4655 (2015).
- Eanes, E. D., Glenner, G. G. X-ray diffraction studies on amyloid filaments. Journal of Histochemistry & Cytochemistry. 16 (11), 673-677 (1968).
- Bonar, L., Cohen, A. S., Skinner, M. M. Characterization of the Amyloid Fibril as a Cross-β Protein. Proceedings of the Society for Experimental Biology and Medicine. 131 (4), 1373-1375 (1969).
- Chiti, F., Dobson, C. M. Protein Misfolding, Amyloid Formation, and Human Disease: A Summary of Progress Over the Last Decade. Annual Review of Biochemistry. 86 (1), 27-68 (2017).
- Knowles, T. P. J., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nature Reviews Molecular Cell Biology. 15 (6), 384-396 (2014).
- Maji, S. K., et al. Functional amyloids as natural storage of peptide hormones in pituitary secretory granules. Science. 325 (5938), 328-332 (2009).
- Li, J., et al. The RIP1/RIP3 necrosome forms a functional amyloid signaling complex required for programmed necrosis. Cell. 150 (2), 339-350 (2012).
- Knowles, T. P. J., Mezzenga, R. Amyloid fibrils as building blocks for natural and artificial functional materials. Advanced Materials. 28 (31), 6546-6561 (2016).
- Stephens, A. D., Kaminski Schierle, G. S. The role of water in amyloid aggregation kinetics. Current Opinion in Structural Biology. 58, 115-123 (2019).
- Adamcik, J., Mezzenga, R. Amyloid polymorphism in the protein folding and aggregation energy landscape. Angewandte Chemie International Edition. 57 (28), 8370-8382 (2018).
- Liu, Z., et al. Entropic contribution to enhanced thermal stability in the thermostable P450 CYP119. Proceedings of the National Academy of Sciences of the United States of America. 115 (43), 10049-10058 (2018).
- Coquelle, N., et al. Chromophore twisting in the excited state of a photoswitchable fluorescent protein captured by time-resolved serial femtosecond crystallography. Nature Chemistry. 10 (1), 31-37 (2018).
- Henzler-Wildman, K. A., et al. A hierarchy of timescales in protein dynamics is linked to enzyme catalysis. Nature. 450 (7171), 913-916 (2007).
- Fichou, Y., et al. Hydration water mobility is enhanced around tau amyloid fibers. Proceedings of the National Academy of Sciences of the United States of America. 112 (20), 6365-6370 (2015).
- Burns, J., Pennock, C. A., Stoward, P. J. The specificity of the staining of amyloid deposits with thioflavine T. The Journal of Pathology and Bacteriology. 94 (2), 337-344 (1967).
- Iqbal, K., Liu, F., Gong, C. -. X., Grundke-Iqbal, I. Tau in Alzheimer disease and related tauopathies. Current Alzheimer Research. 7 (8), 656-664 (2010).
- Krȩżel, A., Bal, W. A formula for correlating pKa values determined in D2O and H2O. Journal of Inorganic Biochemistry. 98 (1), 161-166 (2004).
- Dolman, M., Halling, P. J., Moore, B. D., Waldron, S. How dry are anhydrous enzymes? Measurement of residual and buried 18O-labeled water molecules using mass spectrometry. Biopolymers. 41 (3), 313-321 (1997).
- Pounot, K. kpounotnPDyn: v3.0.0. Zenodo. , (2021).
- Yi, Z., Miao, Y., Baudry, J., Jain, N., Smith, J. C. Derivation of mean-square displacements for protein dynamics from elastic incoherent neutron scattering. Journal of Physical Chemistry B. 116 (16), 5028-5036 (2012).
- Peters, J., Kneller, G. R. Motional heterogeneity in human acetylcholinesterase revealed by a non-Gaussian model for elastic incoherent neutron scattering. The Journal of Chemical Physics. 139 (16), 165102 (2013).
- Zeller, D., Telling, M. T. F., Zamponi, M., García Sakai, V., Peters, J. Analysis of elastic incoherent neutron scattering data beyond the Gaussian approximation. The Journal of Chemical Physics. 149 (23), 234908 (2018).
- Roosen-Runge, F., Seydel, T. A generalized mean-squared displacement from inelastic fixed window scans of incoherent neutron scattering as a model-free indicator of anomalous diffusion confinement. EPJ Web of Conferences. 83, 02015 (2015).
- Ortega, A., Amorós, D., García de la Torre, J. Prediction of hydrodynamic and other solution properties of rigid proteins from atomic- and residue-level models. Biophysical Journal. 101 (4), 892-898 (2011).
- Hennig, M., Frick, B., Seydel, T. IUCr Optimum velocity of a phase-space transformer for cold-neutron backscattering spectroscopy. Journal of Applied Crystallography. 44 (3), 467-472 (2011).
- Paalman, H. H., Pings, C. J. Numerical evaluation of X-ray absorption factors for cylindrical samples and annular sample cells. Journal of Applied Physics. 33 (8), 2635-2639 (1962).
- Ow, S. -. Y., Dunstan, D. E. The effect of concentration, temperature and stirring on hen egg white lysozyme amyloid formation. Soft Matter. 9 (40), 9692-9701 (2013).
- Tominaga, T., Sahara, M., Kawakita, Y., Nakagawa, H., Yamada, T. Evaluation of sample cell materials for aqueous solutions used in quasi-elastic neutron scattering measurements. Journal of Applied Crystallography. 54 (6), 1631-1640 (2021).
- Beck, C., et al. Following protein dynamics in real time during crystallization. Crystal Growth & Design. 19 (12), 7036-7045 (2019).
- Smith, A. A., Testori, E., Cadalbert, R., Meier, B. H., Ernst, M. Characterization of fibril dynamics on three timescales by solid-state NMR. Journal of Biomolecular NMR. 65 (3-4), 171-191 (2016).
- Wang, T., Jo, H., DeGrado, W. F., Hong, M. Water distribution, dynamics, and interactions with Alzheimer’s β-amyloid fibrils investigated by solid-state NMR. Journal of the American Chemical Society. 139 (17), 6242-6252 (2017).
- Rezaei-Ghaleh, N., Giller, K., Becker, S., Zweckstetter, M. Effect of zinc dinding on β-amyloid structure and dynamics: Implications for Aβ aggregation. Biophysical Journal. 101 (5), 1202-1211 (2011).
- Vugmeyster, L., et al. Fast motions of key methyl groups in amyloid-β fibrils. Biophysical Journal. 111 (10), 2135-2148 (2016).
- Yang, X., Wang, B., Hoop, C. L., Williams, J. K., Baum, J. NMR unveils an N-terminal interaction interface on acetylated-α-synuclein monomers for recruitment to fibrils. Proceedings of the National Academy of Sciences of the United States of America. 118 (18), (2021).
- Tuttle, M. D., et al. Solid-state NMR structure of a pathogenic fibril of full-length human α-synuclein. Nature Structural & Molecular Biology. 23 (5), 409-415 (2016).
- Karamanos, T. K., Kalverda, A. P., Thompson, G. S., Radford, S. E. Mechanisms of amyloid formation revealed by solution NMR. Progress in Nuclear Magnetic Resonance Spectroscopy. 88-89, 86-104 (2015).
- Lai, Y. -. C., Kuo, Y. -. H., Chiang, Y. -. W. Identifying protein conformational dynamics using spin-label ESR. Chemistry – An Asian Journal. 14 (22), 3981-3991 (2019).
- Franck, J. M., Han, S. Overhauser dynamic nuclear polarization for the study of hydration dynamics, explained. Methods in Enzymology. 615, 131-175 (2019).
- Pavlova, A., et al. Protein structural and surface water rearrangement constitute major events in the earliest aggregation stages of tau. Proceedings of the National Academy of Sciences of the United States of America. 113 (2), 127-136 (2016).
- Lin, Y., et al. Liquid-liquid phase separation of tau driven by hydrophobic interaction facilitates fibrillization of tau. bioRxiv. , (2020).
- Decatur, S. M. Elucidation of residue-level structure and dynamics of polypeptides via isotope-edited infrared spectroscopy. Accounts of Chemical Research. 39 (3), 169-175 (2006).
- Chatani, E., Tsuchisaka, Y., Masuda, Y., Water Tsenkova, R. molecular system dynamics associated with amyloidogenic nucleation as revealed by real time near infrared spectroscopy and aquaphotomics. PLoS One. 9 (7), 101997 (2014).
- Goret, G., Aoun, B., Pellegrini, E. MDANSE: An interactive analysis environment for molecular dynamics simulations. Journal of Chemical Information and Modeling. 57 (1), 1-5 (2017).
- Fujiwara, S., et al. Internal dynamics of a protein that forms the amyloid fibrils observed by neutron scattering. Journal of the Physical Society of Japan. 82, (2013).
- Schiró, G., et al. Neutron scattering reveals enhanced protein dynamics in concanavalin a amyloid fibrils. Journal of Physical Chemistry Letters. 3 (8), 992-996 (2012).
- Pounot, K., et al. Zinc determines dynamical properties and aggregation kinetics of human insulin. Biophysical Journal. 120 (5), 886-898 (2021).
- Fujiwara, S., et al. Dynamic properties of human α-synuclein related to propensity to amyloid fibril formation. Journal of Molecular Biology. 431 (17), 3229-3245 (2019).
- Sanz, A., et al. High-pressure cell for simultaneous dielectric and neutron spectroscopy. Review of Scientific Instruments. 89 (2), 023904 (2018).
- Adams, M. A., et al. Simultaneous neutron scattering and Raman scattering. Applied Spectroscopy. 63 (7), 727-732 (2009).

