병아리 두개골 신경 볏 세포 배양의 준비 및 형태학적 분석
Summary
이 다목적 프로토콜은 병아리 배아에서 두개골 신경 주름의 절제를 통해 이식 신경 볏 세포 (NCC)의 분리를 설명합니다. 도금 및 배양 시 이동 NCC가 신경 접힘 외식편에서 나와 단순화된 2D 환경에서 세포 형태 및 이동을 평가할 수 있습니다.
Abstract
척추 동물이 발달하는 동안 신경 볏 세포 (NCC)는 광범위하게 이동하여 두개 안면 골격 및 말초 신경계와 같은 구조에 기여하는 다양한 세포 유형으로 분화합니다. 3D 배아의 맥락에서 NCC 이동을 이해하는 것이 중요하지만 2D 배양에서 이동 세포를 분리하면 시각화 및 기능적 특성화가 촉진되어 배아 연구를 보완할 수 있습니다. 본 프로토콜은 일차 NCC 배양물을 생성하기 위해 병아리 두개골 신경 주름을 단리하는 방법을 보여줍니다. 이동 NCC는 피브로넥틴으로 코팅된 기질에 도금된 신경 접힘 외식편에서 나옵니다. 그 결과 염색 및 정량적 형태학적 분석으로 평가할 수 있는 분산되고 부착된 NCC 집단이 생성됩니다. 이 단순화된 문화 접근 방식은 적응력이 뛰어나며 다른 기술과 결합할 수 있습니다. 예를 들어, NCC 이민 및 이동 행동은 타임 랩스 이미징에 의해 평가되거나 유전자 발현의 억제제 또는 실험적 조작 (예 : DNA, 모르 폴리 노 또는 CRISPR 전기 천공)을 포함하여 기능적으로 질의 될 수 있습니다. 다양성 때문에이 방법은 두개골 NCC 발달을 조사하기위한 강력한 시스템을 제공합니다.
Introduction
신경 볏 세포 (NCC)는 척추 동물 배아의 일시적인 세포 집단입니다. NCC는 신경판의 경계에 지정되며 등쪽 신경관1에서 이동하기 위해 상피에서 중간엽으로의 전이(EMT)를 겪습니다. EMT 후, NCC는 배아 전체에 광범위하게 분산되어 궁극적으로 두개 안면 골격, 심장의 유출로 및 대부분의 말초 신경계를 포함한 다양한 구조를 구별하고 기여합니다2. 세포 극성, 세포 골격 및 접착 특성의 변화는 이동 전 세포 집단에서 이동 세포 집단으로의 이러한 변화의 기초가됩니다3. NCC EMT 및 이동을 연구하면 세포 운동성의 기본 메커니즘에 대한 통찰력을 제공하고 선천적 결함 및 암 전이를 예방하고 치료하기위한 노력을 알 수 있습니다.
생체 내 분석은 배아 맥락에서 NCC 발달 과정을 이해하는 데 필수적이지만 시험관 내 방법은 추가적인 실험 경로를 용이하게 하는 시각적 및 물리적 접근성을 제공합니다. 단순화된 2D 환경에서는 NCC 형태, 세포골격 구조 및 이동한 거리를 평가할 수 있습니다. 또한, 운동성 NCC의 이동 행동에 대한 유전 적 또는 용해성 인자 섭동의 영향을 분석 할 수 있습니다 4,5,6,7,8,9,10. 또한, 분리 된 예비 또는 이동 NCC는 단백질체, 전사체 및 후성 유전체 프로파일 링 7,11을 통해 NCC의 발달 조절을 연구하기위한 고 처리량 방법론에 수집, 풀링 및 사용될 수 있습니다. 다양한 발달 모델 유기체12,13,14로부터 두개골 NCC를 준비하는 방법을 사용할 수 있지만, 이 기사는 병아리 배아에서 두개골 NCC를 배양하는 방법을 처음 배우는 사람들을 위한 접근 방식의 메커니즘을 보여줍니다.
현재 프로토콜은 병아리 두개골 NCC 배양을 준비하기 위한 다목적 기술을 설명합니다(그림 1). NCC는 이식된 신경 주름에서 배양 기질로 쉽게 이동하기 때문에 병아리 NCC는 배아 조직에서 자연적으로 분리되고 1차 배양이 쉽게 생성됩니다. 중뇌 NCC가 두개골 신경 주름으로부터 한꺼번에 이동함에 따라 (몸통15의 연장 된 세포 별 박리와는 대조적으로), 이들 배양은 주로 이동 두개골 신경 볏 세포로 구성되며, 초기 신경 접힘 절제는 예비 NCC에 대한 수집 방법을 제공한다. 병아리 두개골 신경 주름을 해부하고 배양하는 기본 방법이 자세히 설명되어 있으며이 방법에 대한 다양한 응용 및 변형에 대한 제안이 제공됩니다.
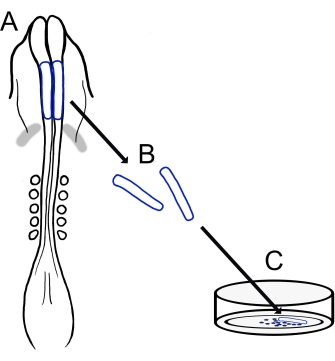
그림 1: 병아리 두개골 신경접힘 배양 프로토콜의 개략도. (A,B) 두개골 신경 주름 (파란색 윤곽선)은 5 개의 체세포가있는 병아리 배아에서 절제됩니다 (A의 등쪽 보기에 표시). 회색 밴드, 심장 초승달. (C) 피브로넥틴에 도금하면 이동 신경 볏 세포가 신경 주름에서 나와 기질 상으로 분산됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
여기에 설명 된 기술은 병아리 신경 주름을 분리하고 철새 두개골 NCC의 배양을 만들기 위해 도금하는 적응 가능한 방법을 제공합니다. 이러한 배양은 병아리 NCC 이동 및 형태를 쉽게 분석할 수 있는 단순화된 2D 조건을 제공하며, 이는 ovo 이미징 방법24,25,26에서 기술적으로 더 어려운 것을 보완할 수 있습니다. 이 시험…
Disclosures
The authors have nothing to disclose.
Acknowledgements
병아리 두개골 신경구 배양 프로토콜 버전 개발에 참여한 Corinne A. Fairchild와 Katie L. Vermillion에게 감사드립니다.
Materials
| AxioObserver equipped with an LSM710 confocal scan head controlled by ZEN 3.0 SR software | Zeiss | Used alpha Plan-Apochromat 100x/1.46 Oil DIC M27 objective | |
| CaCl2 | Sigma-Aldrich | C3306 | |
| Chamber dishes (glass bottom, single or divided) | MatTek; Cell Vis | P35G-1.5-14-C (MatTek) X000NOJQGX (Cellvis) X000NOK1OJ (Cellvis) |
Single chamber 35 mm or 4 chamber 35 mm |
| Cover glass | Carolina Biological Supply Company | 633029, 633031, 633033, 633035, 633037 | circles, 0.13–0.17 mm thickness, available in 12-25 mm diameter |
| DMEM/F12 | ThermoFisher Scientific | 11320033 | Alternative for L15 media |
| Egg incubator | Sportsman | 1502 | |
| FBS | Life Technologies | 10437-028 | |
| Fibronectin | Fisher Scientific | CB-40008A | |
| Filter paper | Whatman | grade 3MM chromatography | |
| Forceps (blunt) | Fisher Scientific; Thomas Scientific | 08-890 (Fisher);1141W97 (Thomas) | |
| Forceps (fine) | Fine Science Tools | 11252-20 | Dumont #5 |
| Image J | https://fiji.sc/ | Free image analysis software | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P0662 | |
| L15 media | Invitrogen | 11415064 | |
| L-glutamine | Invitrogen | 25030 | |
| Mounting Media (Vectashield or ProLong Gold) | Vector Laboratories; Thermofisher Scientific | H-1700 (Vectashield); P36930 (ProLong Gold) | |
| Na2HPO4 | Sigma-Aldrich | S9638 | |
| NaCl | Sigma-Aldrich | S9888 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin/streptomycin | Life Technologies | 15140-148 | 10,000 Units/mL Penicillin; 10,000 mg/mL Streptomycin |
| Petri Dishes | VWR (or similar) | 60 mm, 100 mm | |
| Phalloidin | Sigma-Aldrich | P1951 | multiple flurophores available |
| Pin holder | Fine Science Tools | 26016-12 | For tungsten needle (alternative for spring scissors) |
| Scissors (dissection) | Fine Science Tools | 14061-10 | |
| Spring Scissors | Fine Science Tools | 15000-08 | 2.5 mm cutting edge (alternative for tungsten needle) |
| Sylgard | Krayden | Sylgard 184 | |
| Syringe Filters | Sigma-Aldrich | SLGVM33RS | Millex-GV Syringe Filter Unit, 0.22 µm, PVDF, 33 mm, gamma sterilized |
| Tissue culture dishes | Sarstedt | 83-3900 | 35 mm culture dishes for bulk neural fold cultures |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Tungsten wire | Variety of sources | 0.01" diameter for tungsten needle (alternative for spring scissors) |
References
- Pla, P., Monsoro-Burq, A. H. The neural border: Induction, specification and maturation of the territory that generates neural crest cells. Developmental Biology. 444, 36-46 (2018).
- Tang, W., Bronner, M. E. Neural crest lineage analysis: From past to future trajectory. Development. 147 (20), (2021).
- Piacentino, M. L., Li, Y., Bronner, M. E. Epithelial-to-mesenchymal transition and different migration strategies as viewed from the neural crest. Current Opinion in Cell Biology. 66, 43-50 (2020).
- McLennan, R., et al. Neural crest cells bulldoze through the microenvironment using Aquaporin 1 to stabilize filopodia. Development. 147 (1), 185231 (2020).
- Carmona-Fontaine, C., et al. Complement fragment C3a controls mutual cell attraction during collective cell migration. Developmental Cell. 21 (6), 1026-1037 (2011).
- Giovannone, D., et al. Slits affect the timely migration of neural crest cells via robo receptor. Developmental Dynamics. 241 (8), 1274-1288 (2012).
- Vermillion, K. L., Lidberg, K. A., Gammill, L. S. Cytoplasmic protein methylation is essential for neural crest migration. Journal of Cell Biology. 204 (1), 95-109 (2014).
- Yang, X., Li, J., Zeng, W., Li, C., Mao, B. Elongator Protein 3 (Elp3) stabilizes Snail1 and regulates neural crest migration in Xenopus. Scientific Reports. 6 (1), 1-9 (2016).
- Gonzalez Malagon, S. G., et al. Glycogen synthase kinase 3 controls migration of the neural crest lineage in mouse and Xenopus. Nature Communications. 9 (1), 1-15 (2018).
- Bhattacharya, D., Azambuja, A. P., Simoes-Costa, M. Metabolic reprogramming promotes neural crest migration via yap/tead signaling. Developmental Cell. 53 (2), 199-211 (2020).
- Jacques-Fricke, B. T., et al. Profiling NSD3-dependent neural crest gene expression reveals known and novel candidate regulatory factors. Developmental Biology. 475, 118-130 (2021).
- Bronner-Fraser, M., García-Castro, M. Chapter 4 manipulations of neural crest cells or their migratory pathways. Methods in Cell Biology. 87, 75-96 (2008).
- Milet, C., Monsoro-Burq, A. H. Dissection of xenopus laevis neural crest for in vitro explant culture or in vivo transplantation. Journal of Visualized Experiments. (85), e51118 (2014).
- Malagon, S. G. G., et al. Dissection, culture and analysis of primary cranial neural crest cells from mouse for the study of neural crest cell delamination and migration. Journal of Visualized Experiments. (152), e60051 (2019).
- Theveneau, E., Mayor, R. Neural crest delamination and migration: From epithelium-to-mesenchyme transition to collective cell migration. Developmental Biology. 366 (1), 34-54 (2012).
- Conrad, G. W., Bee, J. A., Roche, S. M., Teillet, M. A. Fabrication of microscalpels by electrolysis of tungsten wire in a meniscus. Journal of Neuroscience Methods. 50 (1), 123-127 (1993).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Gammill, L. S., Jacques-Fricke, B., Roffers-Agarwal, J. Embryological and genetic manipulation of chick development. Methods in Molecular Biology. 1920, 75-97 (2019).
- Vandekerckhove, J., Deboben, A., Nassal, M., Wieland, T. The phalloidin binding site of F-actin. The EMBO Journal. 4 (11), 2815-2818 (1985).
- Bronner-Fraser, M. Analysis of the early stages of trunk neural crest migration in avian embryos using monoclonal antibody HNK-1. Developmental Biology. 115 (1), 44-55 (1986).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Soille, P., Vincent, L. Determining watersheds in digital pictures via flooding simulations. Visual Communications and Image Processing ’90: Fifth in a Series. (1360), 240-250 (1990).
- Haupt, A., Minc, N. How cells sense their own shape – mechanisms to probe cell geometry and their implications in cellular organization and function. Journal of Cell Science. 131 (6), (2018).
- Ezin, M., Fraser, S. Chapter 11 time-lapse imaging of the early avian embryo. Methods in Cell Biology. 87, 211-236 (2008).
- Kulesa, P. M., Bailey, C. M., Cooper, C., Fraser, S. E. In ovo live imaging of avian embryos. Cold Spring Harbor Protocols. 5 (6), (2010).
- McKinney, M. C., Kulesa, P. M. Live imaging of the neural crest cell epithelial-to-mesenchymal transition in the chick embryo. Methods in Molecular Biology. 2179, 107-114 (2021).
- Gustafson, C. M., Roffers-Agarwal, J., Gammill, L. S. Chick cranial neural crest cells release extracellular vesicles that are critical for their migration. Journal of Cell Science. , (2022).
- Williams, R., Sauka-Spengler, T. Ex ovo electroporation of early chicken embryos. STAR Protocols. 2 (2), 100424 (2021).
- Moulton, J. D. Using morpholinos to control gene expression. Current Protocols in Nucleic Acid Chemistry. 68 (1), 4-30 (2017).
- Gandhi, S., et al. A single-plasmid approach for genome editing coupled with long-term lineage analysis in chick embryos. Development. 148 (7), (2021).
- Williams, R. M., et al. Reconstruction of the Global Neural Crest Gene Regulatory Network In Vivo. Developmental Cell. 51 (2), 255-267 (2019).

