Civciv Kraniyal Nöral Kret Hücre Kültürlerinin Hazırlanması ve Morfolojik Analizi
Summary
Bu çok yönlü protokol, civciv embriyolarından kraniyal nöral kıvrımların eksizyonu yoluyla göç öncesi nöral krest hücrelerinin (NCC’ler) izolasyonunu tanımlar. Kaplama ve inkübasyon üzerine, göçmen NCC’ler nöral kıvrım eksplantlarından ortaya çıkar ve basitleştirilmiş bir 2D ortamda hücre morfolojisinin ve göçünün değerlendirilmesine izin verir.
Abstract
Omurgalı gelişimi sırasında, nöral krest hücreleri (NCC’ler) yoğun bir şekilde göç eder ve kraniyofasiyal iskelet ve periferik sinir sistemi gibi yapılara katkıda bulunan çeşitli hücre tiplerine farklılaşır. NCC göçünü bir 3D embriyo bağlamında anlamak kritik olsa da, 2D kültürde göçmen hücrelerin izole edilmesi, embriyonik çalışmaları tamamlayarak görselleştirmeyi ve fonksiyonel karakterizasyonu kolaylaştırır. Mevcut protokol, primer NCC kültürleri oluşturmak için civciv kraniyal nöral kıvrımlarını izole etmek için bir yöntem göstermektedir. Göçmen NCC’ler, fibronektin kaplı bir substrat üzerine kaplanmış nöral kıvrımlı eksplantlardan ortaya çıkar. Bu, boyama ve kantitatif morfolojik analizlerle değerlendirilebilen dağınık, yapışkan NCC popülasyonları ile sonuçlanır. Bu basitleştirilmiş kültür yaklaşımı son derece uyarlanabilir ve diğer tekniklerle birleştirilebilir. Örneğin, NCC göçü ve göç davranışları, hızlandırılmış görüntüleme ile değerlendirilebilir veya inhibitörler veya gen ekspresyonunun deneysel manipülasyonları (örneğin, DNA, morfolino veya CRISPR elektroporasyonu) dahil edilerek fonksiyonel olarak sorgulanabilir. Çok yönlülüğü nedeniyle, bu yöntem kraniyal NCC gelişimini araştırmak için güçlü bir sistem sağlar.
Introduction
Nöral krest hücreleri (NCC’ler) omurgalı embriyolarında geçici bir hücre popülasyonudur. NCC’ler nöral plakanın sınırlarında belirtilir ve dorsal nöral tüp1’den göç etmek için epitel-mezenkimal geçişe (EMT) uğrar. EMT’den sonra, NCC’ler embriyo boyunca yoğun bir şekilde dağılır, sonuçta kraniyofasiyal iskelet, kalbin çıkış yolu ve periferik sinir sisteminin çoğunluğu dahil olmak üzere çeşitli yapılara farklılaşır ve katkıda bulunur2. Hücre polaritesindeki, hücre iskeletindeki ve yapışma özelliklerindeki değişiklikler, bu göçmenlikten göçmen hücre popülasyonunageçişin altında yatmaktadır 3. NCC EMT ve göçün incelenmesi, hücre hareketliliğinin temel mekanizmaları hakkında fikir verir ve doğum kusurlarını ve kanser metastazını önleme ve tedavi etme çabalarını bilgilendirir.
İn vivo analiz, NCC gelişimsel süreçlerini embriyonik bir bağlamda anlamak için hayati önem taşırken, in vitro yöntemler ek deneysel yolları kolaylaştıran görsel ve fiziksel erişilebilirlik sunar. Basitleştirilmiş bir 2D ortamda, NCC morfolojisi, sitoiskelet yapıları ve göç edilen mesafe değerlendirilebilir. Ayrıca, genetik veya çözünür faktör pertürbasyonunun hareketli NCC’lerin göç davranışları üzerindeki etkileri analiz edilebilir 4,5,6,7,8,9,10. Ek olarak, izole edilmiş premigratory veya migratory NCC’ler toplanabilir, bir araya getirilebilir ve proteomik, transkriptomik ve epigenomik profilleme yoluyla NCC’lerin gelişimsel düzenlemesini incelemek için yüksek verimli metodolojiler için kullanılabilir 7,11. Çeşitli gelişimsel model organizmalardan12,13,14 kraniyal NCC’lerin hazırlanması için yöntemler mevcut olsa da, bu makale civciv embriyolarından kraniyal NCC kültürünü ilk öğrenenler için yaklaşımın mekaniğini göstermektedir.
Mevcut protokol, civciv kafatası NCC kültürlerini hazırlamak için çok yönlü bir tekniği tanımlamaktadır (Şekil 1). NCC’ler ekşi nöral kıvrımlardan bir kültür substratına kolayca göç ettiğinden, civciv NCC’ler doğal olarak embriyonik dokudan ayrılır ve birincil kültürler kolayca üretilir. Orta beyin NCC’leri kraniyal nöral kıvrımlardan toplu olarak göç ederken (gövde15’teki uzun süreli, hücre hücre delaminasyonunun aksine), bu kültürler esas olarak göçmen kraniyal nöral krest hücrelerinden oluşur ve ilk nöral kıvrım eksizyonu premigrasyon NCC’ler için bir toplama yöntemi sağlar. Civciv kraniyal nöral kıvrımlarının diseksiyonu ve kültürlenmesi için temel bir yöntem detaylandırılmıştır ve bu yöntemin farklı uygulamaları ve varyasyonları için öneriler sunulmaktadır.
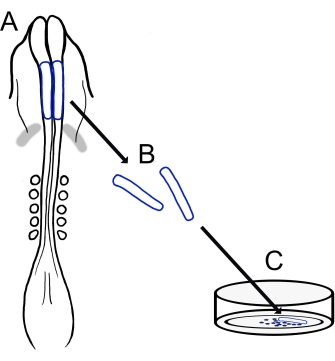
Şekil 1: Civciv kafatası nöral kıvrım kültürü protokolüne şematik genel bakış. (A,B) Kraniyal nöral kıvrımlar (mavi ile özetlenmiş) beş somitli bir civciv embriyosundan eksize edilir (A’da dorsal görünümde gösterilmiştir). Gri bantlar, kalp hilali. (C) Fibronektin üzerine kaplandığında, göçmen nöral krest hücreleri nöral kıvrımlardan ortaya çıkar ve substrat üzerine dağılır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Burada açıklanan teknik, civciv nöral kıvrımlarını izole etmek ve göçmen kraniyal NCC’lerin kültürlerini oluşturmak için bunları kaplamak için uyarlanabilir bir yöntem sağlar. Bu kültürler, civciv NCC migrasyonunun ve morfolojisinin kolay analizi için basitleştirilmiş 2D koşullar sağlar ve bu da ovo görüntüleme yöntemlerinde teknik olarak daha zorluolabilir 24,25,26. Bu in vitro yön…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Civciv kafatası nöral kıvrım kültürü protokolümüzün versiyonunun geliştirilmesine katılan Corinne A. Fairchild ve Katie L. Vermillion’a teşekkür ederiz.
Materials
| AxioObserver equipped with an LSM710 confocal scan head controlled by ZEN 3.0 SR software | Zeiss | Used alpha Plan-Apochromat 100x/1.46 Oil DIC M27 objective | |
| CaCl2 | Sigma-Aldrich | C3306 | |
| Chamber dishes (glass bottom, single or divided) | MatTek; Cell Vis | P35G-1.5-14-C (MatTek) X000NOJQGX (Cellvis) X000NOK1OJ (Cellvis) |
Single chamber 35 mm or 4 chamber 35 mm |
| Cover glass | Carolina Biological Supply Company | 633029, 633031, 633033, 633035, 633037 | circles, 0.13–0.17 mm thickness, available in 12-25 mm diameter |
| DMEM/F12 | ThermoFisher Scientific | 11320033 | Alternative for L15 media |
| Egg incubator | Sportsman | 1502 | |
| FBS | Life Technologies | 10437-028 | |
| Fibronectin | Fisher Scientific | CB-40008A | |
| Filter paper | Whatman | grade 3MM chromatography | |
| Forceps (blunt) | Fisher Scientific; Thomas Scientific | 08-890 (Fisher);1141W97 (Thomas) | |
| Forceps (fine) | Fine Science Tools | 11252-20 | Dumont #5 |
| Image J | https://fiji.sc/ | Free image analysis software | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P0662 | |
| L15 media | Invitrogen | 11415064 | |
| L-glutamine | Invitrogen | 25030 | |
| Mounting Media (Vectashield or ProLong Gold) | Vector Laboratories; Thermofisher Scientific | H-1700 (Vectashield); P36930 (ProLong Gold) | |
| Na2HPO4 | Sigma-Aldrich | S9638 | |
| NaCl | Sigma-Aldrich | S9888 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin/streptomycin | Life Technologies | 15140-148 | 10,000 Units/mL Penicillin; 10,000 mg/mL Streptomycin |
| Petri Dishes | VWR (or similar) | 60 mm, 100 mm | |
| Phalloidin | Sigma-Aldrich | P1951 | multiple flurophores available |
| Pin holder | Fine Science Tools | 26016-12 | For tungsten needle (alternative for spring scissors) |
| Scissors (dissection) | Fine Science Tools | 14061-10 | |
| Spring Scissors | Fine Science Tools | 15000-08 | 2.5 mm cutting edge (alternative for tungsten needle) |
| Sylgard | Krayden | Sylgard 184 | |
| Syringe Filters | Sigma-Aldrich | SLGVM33RS | Millex-GV Syringe Filter Unit, 0.22 µm, PVDF, 33 mm, gamma sterilized |
| Tissue culture dishes | Sarstedt | 83-3900 | 35 mm culture dishes for bulk neural fold cultures |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Tungsten wire | Variety of sources | 0.01" diameter for tungsten needle (alternative for spring scissors) |
References
- Pla, P., Monsoro-Burq, A. H. The neural border: Induction, specification and maturation of the territory that generates neural crest cells. Developmental Biology. 444, 36-46 (2018).
- Tang, W., Bronner, M. E. Neural crest lineage analysis: From past to future trajectory. Development. 147 (20), (2021).
- Piacentino, M. L., Li, Y., Bronner, M. E. Epithelial-to-mesenchymal transition and different migration strategies as viewed from the neural crest. Current Opinion in Cell Biology. 66, 43-50 (2020).
- McLennan, R., et al. Neural crest cells bulldoze through the microenvironment using Aquaporin 1 to stabilize filopodia. Development. 147 (1), 185231 (2020).
- Carmona-Fontaine, C., et al. Complement fragment C3a controls mutual cell attraction during collective cell migration. Developmental Cell. 21 (6), 1026-1037 (2011).
- Giovannone, D., et al. Slits affect the timely migration of neural crest cells via robo receptor. Developmental Dynamics. 241 (8), 1274-1288 (2012).
- Vermillion, K. L., Lidberg, K. A., Gammill, L. S. Cytoplasmic protein methylation is essential for neural crest migration. Journal of Cell Biology. 204 (1), 95-109 (2014).
- Yang, X., Li, J., Zeng, W., Li, C., Mao, B. Elongator Protein 3 (Elp3) stabilizes Snail1 and regulates neural crest migration in Xenopus. Scientific Reports. 6 (1), 1-9 (2016).
- Gonzalez Malagon, S. G., et al. Glycogen synthase kinase 3 controls migration of the neural crest lineage in mouse and Xenopus. Nature Communications. 9 (1), 1-15 (2018).
- Bhattacharya, D., Azambuja, A. P., Simoes-Costa, M. Metabolic reprogramming promotes neural crest migration via yap/tead signaling. Developmental Cell. 53 (2), 199-211 (2020).
- Jacques-Fricke, B. T., et al. Profiling NSD3-dependent neural crest gene expression reveals known and novel candidate regulatory factors. Developmental Biology. 475, 118-130 (2021).
- Bronner-Fraser, M., García-Castro, M. Chapter 4 manipulations of neural crest cells or their migratory pathways. Methods in Cell Biology. 87, 75-96 (2008).
- Milet, C., Monsoro-Burq, A. H. Dissection of xenopus laevis neural crest for in vitro explant culture or in vivo transplantation. Journal of Visualized Experiments. (85), e51118 (2014).
- Malagon, S. G. G., et al. Dissection, culture and analysis of primary cranial neural crest cells from mouse for the study of neural crest cell delamination and migration. Journal of Visualized Experiments. (152), e60051 (2019).
- Theveneau, E., Mayor, R. Neural crest delamination and migration: From epithelium-to-mesenchyme transition to collective cell migration. Developmental Biology. 366 (1), 34-54 (2012).
- Conrad, G. W., Bee, J. A., Roche, S. M., Teillet, M. A. Fabrication of microscalpels by electrolysis of tungsten wire in a meniscus. Journal of Neuroscience Methods. 50 (1), 123-127 (1993).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Gammill, L. S., Jacques-Fricke, B., Roffers-Agarwal, J. Embryological and genetic manipulation of chick development. Methods in Molecular Biology. 1920, 75-97 (2019).
- Vandekerckhove, J., Deboben, A., Nassal, M., Wieland, T. The phalloidin binding site of F-actin. The EMBO Journal. 4 (11), 2815-2818 (1985).
- Bronner-Fraser, M. Analysis of the early stages of trunk neural crest migration in avian embryos using monoclonal antibody HNK-1. Developmental Biology. 115 (1), 44-55 (1986).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Soille, P., Vincent, L. Determining watersheds in digital pictures via flooding simulations. Visual Communications and Image Processing ’90: Fifth in a Series. (1360), 240-250 (1990).
- Haupt, A., Minc, N. How cells sense their own shape – mechanisms to probe cell geometry and their implications in cellular organization and function. Journal of Cell Science. 131 (6), (2018).
- Ezin, M., Fraser, S. Chapter 11 time-lapse imaging of the early avian embryo. Methods in Cell Biology. 87, 211-236 (2008).
- Kulesa, P. M., Bailey, C. M., Cooper, C., Fraser, S. E. In ovo live imaging of avian embryos. Cold Spring Harbor Protocols. 5 (6), (2010).
- McKinney, M. C., Kulesa, P. M. Live imaging of the neural crest cell epithelial-to-mesenchymal transition in the chick embryo. Methods in Molecular Biology. 2179, 107-114 (2021).
- Gustafson, C. M., Roffers-Agarwal, J., Gammill, L. S. Chick cranial neural crest cells release extracellular vesicles that are critical for their migration. Journal of Cell Science. , (2022).
- Williams, R., Sauka-Spengler, T. Ex ovo electroporation of early chicken embryos. STAR Protocols. 2 (2), 100424 (2021).
- Moulton, J. D. Using morpholinos to control gene expression. Current Protocols in Nucleic Acid Chemistry. 68 (1), 4-30 (2017).
- Gandhi, S., et al. A single-plasmid approach for genome editing coupled with long-term lineage analysis in chick embryos. Development. 148 (7), (2021).
- Williams, R. M., et al. Reconstruction of the Global Neural Crest Gene Regulatory Network In Vivo. Developmental Cell. 51 (2), 255-267 (2019).

