Voorbereiding en morfologische analyse van Chick Cranial Neural Crest Cell Cultures
Summary
Dit veelzijdige protocol beschrijft de isolatie van premigratory neural crest cells (NCC’s) door de excisie van craniale neurale plooien van kuikenembryo’s. Bij plating en incubatie komen migrerende NCC’s tevoorschijn uit neurale vouwexplantaten, waardoor celmorfologie en migratie in een vereenvoudigde 2D-omgeving kunnen worden beoordeeld.
Abstract
Tijdens de ontwikkeling van gewervelde dieren migreren neurale crestcellen (NCC’s) uitgebreid en differentiëren ze in verschillende celtypen die bijdragen aan structuren zoals het craniofaciale skelet en het perifere zenuwstelsel. Hoewel het van cruciaal belang is om NCC-migratie te begrijpen in de context van een 3D-embryo, vergemakkelijkt het isoleren van migrerende cellen in 2D-cultuur visualisatie en functionele karakterisering, als aanvulling op embryonale studies. Het huidige protocol demonstreert een methode voor het isoleren van kuiken craniale neurale plooien om primaire NCC-culturen te genereren. Migrerende NCC’s komen voort uit neurale vouwexplantaten die op een met fibronectine gecoat substraat zijn geplaatst. Dit resulteert in verspreide, aanhangende NCC-populaties die kunnen worden beoordeeld door kleuring en kwantitatieve morfologische analyses. Deze vereenvoudigde cultuurbenadering is zeer aanpasbaar en kan worden gecombineerd met andere technieken. NCC-emigratie en migratiegedrag kunnen bijvoorbeeld worden geëvalueerd door time-lapse-beeldvorming of functioneel worden bevraagd door remmers of experimentele manipulaties van genexpressie op te nemen (bijv. DNA, morfolino of CRISPR-elektroporatie). Vanwege zijn veelzijdigheid biedt deze methode een krachtig systeem voor het onderzoeken van craniale NCC-ontwikkeling.
Introduction
Neurale kamcellen (NCC’s) zijn een voorbijgaande celpopulatie in gewervelde embryo’s. NCC’s worden gespecificeerd aan de randen van de neurale plaat en ondergaan een epitheliale naar mesenchymale overgang (EMT) om te migreren vanuit de dorsale neurale buis1. Na EMT verspreiden NCC’s zich uitgebreid door het embryo, waardoor uiteindelijk onderscheid wordt gemaakt en wordt bijgedragen aan verschillende structuren, waaronder het craniofaciale skelet, het uitstroomkanaal van het hart en het grootste deel van het perifere zenuwstelsel2. Veranderingen in celpolariteit, het cytoskelet en adhesie-eigenschappen liggen ten grondslag aan deze verschuiving van een premigratory naar een migrerende celpopulatie3. Het bestuderen van NCC EMT en migratie biedt inzicht in fundamentele mechanismen van celmotiliteit en informeert inspanningen om geboorteafwijkingen en kankermetastase te voorkomen en te behandelen.
Hoewel in vivo analyse van vitaal belang is voor het begrijpen van NCC-ontwikkelingsprocessen in een embryonale context, bieden in vitro methoden visuele en fysieke toegankelijkheid die aanvullende experimentele wegen mogelijk maakt. In een vereenvoudigde 2D-omgeving kunnen NCC-morfologie, cytoskeletstructuren en gemigreerde afstand worden geëvalueerd. Bovendien kunnen de effecten van genetische of oplosbare factorverstoring op migratiegedrag van beweeglijke NCC’s worden geanalyseerd 4,5,6,7,8,9,10. Bovendien kunnen geïsoleerde premigratory of migrerende NCC’s worden verzameld, gepoold en gebruikt voor high-throughput methodologieën om de ontwikkelingsregulatie van NCC’s te bestuderen door middel van proteomische, transcriptomische en epigenomische profilering 7,11. Hoewel er methoden beschikbaar zijn voor het bereiden van craniale NCC’s van verschillende ontwikkelingsmodelorganismen 12,13,14, demonstreert dit artikel de mechanica van de aanpak voor degenen die voor het eerst leren om craniale NCC te kweken uit kuikenembryo’s.
Het huidige protocol beschrijft een veelzijdige techniek voor het bereiden van kuiken craniale NCC-culturen (figuur 1). Omdat NCC’s gemakkelijk migreren van geëxplanteerde neurale plooien naar een kweeksubstraat, scheiden kuiken-NCC’s zich op natuurlijke wijze van embryonaal weefsel en worden primaire culturen gemakkelijk gegenereerd. Aangezien midbrain NCCs massaal migreren uit de craniale neurale plooien (in tegenstelling tot de langdurige, cel-voor-cel delaminatie in de stam15), bestaan deze culturen voornamelijk uit migrerende craniale neurale crest-cellen, waarbij initiële neurale vouwexcisie een verzamelmethode biedt voor premigratory NCC’s. Een basismethode voor het ontleden en kweken van kuiken craniale neurale plooien is gedetailleerd en suggesties voor verschillende toepassingen en variaties op deze methode worden aangeboden.
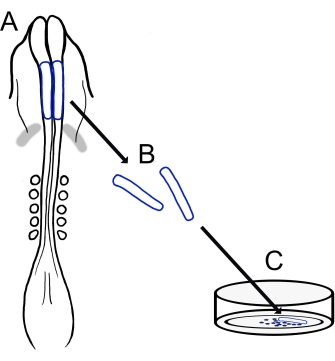
Figuur 1: Schematisch overzicht van het kuiken craniale neurale vouwcultuurprotocol. (A,B) Craniale neurale plooien (omlijnd in blauw) worden weggesneden uit een kuikenembryo met vijf somites (weergegeven in dorsale weergave in A). Grijze banden, cardiale halve maan. (C) Wanneer ze op fibronectine worden geplaatst, komen migrerende neurale kamcellen uit de neurale plooien en verspreiden zich op het substraat. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
De hier beschreven techniek biedt een aanpasbare methode om kuikenneuraalplooien te isoleren en te platen om culturen van migrerende craniale NCC’s te creëren. Deze culturen bieden vereenvoudigde 2D-voorwaarden voor eenvoudige analyse van NCC-migratie en morfologie van kuikens die een aanvulling kunnen vormen op de meer technisch uitdagende ovo-beeldvormingsmethoden 24,25,26. Hoewel deze in vitro methode rela…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We bedanken Corinne A. Fairchild en Katie L. Vermillion, die hebben deelgenomen aan de ontwikkeling van onze versie van het chick cranial neural fold culture protocol.
Materials
| AxioObserver equipped with an LSM710 confocal scan head controlled by ZEN 3.0 SR software | Zeiss | Used alpha Plan-Apochromat 100x/1.46 Oil DIC M27 objective | |
| CaCl2 | Sigma-Aldrich | C3306 | |
| Chamber dishes (glass bottom, single or divided) | MatTek; Cell Vis | P35G-1.5-14-C (MatTek) X000NOJQGX (Cellvis) X000NOK1OJ (Cellvis) |
Single chamber 35 mm or 4 chamber 35 mm |
| Cover glass | Carolina Biological Supply Company | 633029, 633031, 633033, 633035, 633037 | circles, 0.13–0.17 mm thickness, available in 12-25 mm diameter |
| DMEM/F12 | ThermoFisher Scientific | 11320033 | Alternative for L15 media |
| Egg incubator | Sportsman | 1502 | |
| FBS | Life Technologies | 10437-028 | |
| Fibronectin | Fisher Scientific | CB-40008A | |
| Filter paper | Whatman | grade 3MM chromatography | |
| Forceps (blunt) | Fisher Scientific; Thomas Scientific | 08-890 (Fisher);1141W97 (Thomas) | |
| Forceps (fine) | Fine Science Tools | 11252-20 | Dumont #5 |
| Image J | https://fiji.sc/ | Free image analysis software | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P0662 | |
| L15 media | Invitrogen | 11415064 | |
| L-glutamine | Invitrogen | 25030 | |
| Mounting Media (Vectashield or ProLong Gold) | Vector Laboratories; Thermofisher Scientific | H-1700 (Vectashield); P36930 (ProLong Gold) | |
| Na2HPO4 | Sigma-Aldrich | S9638 | |
| NaCl | Sigma-Aldrich | S9888 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin/streptomycin | Life Technologies | 15140-148 | 10,000 Units/mL Penicillin; 10,000 mg/mL Streptomycin |
| Petri Dishes | VWR (or similar) | 60 mm, 100 mm | |
| Phalloidin | Sigma-Aldrich | P1951 | multiple flurophores available |
| Pin holder | Fine Science Tools | 26016-12 | For tungsten needle (alternative for spring scissors) |
| Scissors (dissection) | Fine Science Tools | 14061-10 | |
| Spring Scissors | Fine Science Tools | 15000-08 | 2.5 mm cutting edge (alternative for tungsten needle) |
| Sylgard | Krayden | Sylgard 184 | |
| Syringe Filters | Sigma-Aldrich | SLGVM33RS | Millex-GV Syringe Filter Unit, 0.22 µm, PVDF, 33 mm, gamma sterilized |
| Tissue culture dishes | Sarstedt | 83-3900 | 35 mm culture dishes for bulk neural fold cultures |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Tungsten wire | Variety of sources | 0.01" diameter for tungsten needle (alternative for spring scissors) |
References
- Pla, P., Monsoro-Burq, A. H. The neural border: Induction, specification and maturation of the territory that generates neural crest cells. Developmental Biology. 444, 36-46 (2018).
- Tang, W., Bronner, M. E. Neural crest lineage analysis: From past to future trajectory. Development. 147 (20), (2021).
- Piacentino, M. L., Li, Y., Bronner, M. E. Epithelial-to-mesenchymal transition and different migration strategies as viewed from the neural crest. Current Opinion in Cell Biology. 66, 43-50 (2020).
- McLennan, R., et al. Neural crest cells bulldoze through the microenvironment using Aquaporin 1 to stabilize filopodia. Development. 147 (1), 185231 (2020).
- Carmona-Fontaine, C., et al. Complement fragment C3a controls mutual cell attraction during collective cell migration. Developmental Cell. 21 (6), 1026-1037 (2011).
- Giovannone, D., et al. Slits affect the timely migration of neural crest cells via robo receptor. Developmental Dynamics. 241 (8), 1274-1288 (2012).
- Vermillion, K. L., Lidberg, K. A., Gammill, L. S. Cytoplasmic protein methylation is essential for neural crest migration. Journal of Cell Biology. 204 (1), 95-109 (2014).
- Yang, X., Li, J., Zeng, W., Li, C., Mao, B. Elongator Protein 3 (Elp3) stabilizes Snail1 and regulates neural crest migration in Xenopus. Scientific Reports. 6 (1), 1-9 (2016).
- Gonzalez Malagon, S. G., et al. Glycogen synthase kinase 3 controls migration of the neural crest lineage in mouse and Xenopus. Nature Communications. 9 (1), 1-15 (2018).
- Bhattacharya, D., Azambuja, A. P., Simoes-Costa, M. Metabolic reprogramming promotes neural crest migration via yap/tead signaling. Developmental Cell. 53 (2), 199-211 (2020).
- Jacques-Fricke, B. T., et al. Profiling NSD3-dependent neural crest gene expression reveals known and novel candidate regulatory factors. Developmental Biology. 475, 118-130 (2021).
- Bronner-Fraser, M., García-Castro, M. Chapter 4 manipulations of neural crest cells or their migratory pathways. Methods in Cell Biology. 87, 75-96 (2008).
- Milet, C., Monsoro-Burq, A. H. Dissection of xenopus laevis neural crest for in vitro explant culture or in vivo transplantation. Journal of Visualized Experiments. (85), e51118 (2014).
- Malagon, S. G. G., et al. Dissection, culture and analysis of primary cranial neural crest cells from mouse for the study of neural crest cell delamination and migration. Journal of Visualized Experiments. (152), e60051 (2019).
- Theveneau, E., Mayor, R. Neural crest delamination and migration: From epithelium-to-mesenchyme transition to collective cell migration. Developmental Biology. 366 (1), 34-54 (2012).
- Conrad, G. W., Bee, J. A., Roche, S. M., Teillet, M. A. Fabrication of microscalpels by electrolysis of tungsten wire in a meniscus. Journal of Neuroscience Methods. 50 (1), 123-127 (1993).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Gammill, L. S., Jacques-Fricke, B., Roffers-Agarwal, J. Embryological and genetic manipulation of chick development. Methods in Molecular Biology. 1920, 75-97 (2019).
- Vandekerckhove, J., Deboben, A., Nassal, M., Wieland, T. The phalloidin binding site of F-actin. The EMBO Journal. 4 (11), 2815-2818 (1985).
- Bronner-Fraser, M. Analysis of the early stages of trunk neural crest migration in avian embryos using monoclonal antibody HNK-1. Developmental Biology. 115 (1), 44-55 (1986).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Soille, P., Vincent, L. Determining watersheds in digital pictures via flooding simulations. Visual Communications and Image Processing ’90: Fifth in a Series. (1360), 240-250 (1990).
- Haupt, A., Minc, N. How cells sense their own shape – mechanisms to probe cell geometry and their implications in cellular organization and function. Journal of Cell Science. 131 (6), (2018).
- Ezin, M., Fraser, S. Chapter 11 time-lapse imaging of the early avian embryo. Methods in Cell Biology. 87, 211-236 (2008).
- Kulesa, P. M., Bailey, C. M., Cooper, C., Fraser, S. E. In ovo live imaging of avian embryos. Cold Spring Harbor Protocols. 5 (6), (2010).
- McKinney, M. C., Kulesa, P. M. Live imaging of the neural crest cell epithelial-to-mesenchymal transition in the chick embryo. Methods in Molecular Biology. 2179, 107-114 (2021).
- Gustafson, C. M., Roffers-Agarwal, J., Gammill, L. S. Chick cranial neural crest cells release extracellular vesicles that are critical for their migration. Journal of Cell Science. , (2022).
- Williams, R., Sauka-Spengler, T. Ex ovo electroporation of early chicken embryos. STAR Protocols. 2 (2), 100424 (2021).
- Moulton, J. D. Using morpholinos to control gene expression. Current Protocols in Nucleic Acid Chemistry. 68 (1), 4-30 (2017).
- Gandhi, S., et al. A single-plasmid approach for genome editing coupled with long-term lineage analysis in chick embryos. Development. 148 (7), (2021).
- Williams, R. M., et al. Reconstruction of the Global Neural Crest Gene Regulatory Network In Vivo. Developmental Cell. 51 (2), 255-267 (2019).

