Подготовка и морфологический анализ клеточных культур черепно-мозгового черепа цыплят
Summary
Этот универсальный протокол описывает выделение премигрирующих клеток нервного гребня (NCC) путем иссечения черепных нервных складок из эмбрионов цыплят. После покрытия и инкубации мигрирующие NCC возникают из эксплантов нервной складки, что позволяет оценить морфологию клеток и миграцию в упрощенной 2D-среде.
Abstract
Во время развития позвоночных клетки нервных гребней (NCC) широко мигрируют и дифференцируются в различные типы клеток, которые способствуют таким структурам, как черепно-лицевой скелет и периферическая нервная система. Хотя важно понимать миграцию NCC в контексте 3D-эмбриона, выделение мигрирующих клеток в 2D-культуре облегчает визуализацию и функциональную характеристику, дополняя эмбриональные исследования. Настоящий протокол демонстрирует метод выделения черепно-мозговых складок цыплят для генерации первичных культур NCC. Мигрирующие NCC возникают из эксплантов нервной складки, покрытых фибронектиновым субстратом. Это приводит к дисперсным, адгезивным популяциям NCC, которые могут быть оценены с помощью окрашивания и количественного морфологического анализа. Этот упрощенный культурный подход обладает высокой адаптивностью и может сочетаться с другими методами. Например, эмиграция NCC и миграционное поведение могут быть оценены с помощью покадровой визуализации или функционально запрошены путем включения ингибиторов или экспериментальных манипуляций экспрессии генов (например, ДНК, морфолино или электропорации CRISPR). Благодаря своей универсальности этот метод обеспечивает мощную систему для исследования развития черепных NCC.
Introduction
Клетки нервного гребня (NCC) представляют собой переходную клеточную популяцию в эмбрионах позвоночных. НКЦ указываются на границах нервной пластинки и претерпевают эпителиально-мезенхимальный переход (ЭМТ) для миграции из дорсальной нервной трубки1. После ЭМТ NCC широко рассеиваются по всему эмбриону, в конечном итоге дифференцируя и способствуя различным структурам, включая черепно-лицевой скелет, отток сердца и большую часть периферической нервной системы2. Изменения в полярности клеток, цитоскелете и адгезионных свойствах объясняют этот переход от премиграционной к мигрирующей клеточной популяции3. Изучение NCC EMT и миграции дает представление о фундаментальных механизмах подвижности клеток и информирует об усилиях по профилактике и лечению врожденных дефектов и метастазирования рака.
В то время как анализ in vivo имеет жизненно важное значение для понимания процессов развития NCC в эмбриональном контексте, методы in vitro предлагают визуальную и физическую доступность, которая облегчает дополнительные экспериментальные возможности. В упрощенной 2D-среде можно оценить морфологию NCC, цитоскелетные структуры и расстояние миграции. Кроме того, влияние возмущения генетического или растворимого фактора на миграционное поведение подвижных ННК может быть проанализировано 4,5,6,7,8,9,10. Кроме того, изолированные премиграторные или мигрирующие НКЦ могут быть собраны, объединены и использованы для высокопроизводительных методологий для изучения регуляции развития NCC посредством протеомного, транскриптомного и эпигеномного профилирования 7,11. В то время как доступны методы получения черепных NCC из различных модельных организмов развития 12,13,14, в этой статье демонстрируется механика подхода для тех, кто впервые научился культивировать черепные NCC из эмбрионов цыплят.
Текущий протокол описывает универсальную технику приготовления черепно-черепных культур NCC цыплят (рисунок 1). Поскольку NCC легко мигрируют из эксплантированных нервных складок на субстрат культуры, цыплята NCC естественным образом отделяются от эмбриональной ткани, и первичные культуры легко генерируются. Поскольку НКЦ среднего мозга массово мигрируют из черепных нервных складок (в отличие от затяжного расслоения клетки за клеткой в стволе15), эти культуры состоят в основном из мигрирующих клеток черепно-мозгового нервного гребня, причем начальное иссечение нервной складки обеспечивает метод сбора для премиграторных NCC. Подробно описан базовый метод вскрытия и культивирования черепно-мозговых складок цыплят, предложены предложения по различным применениям и вариациям этого метода.
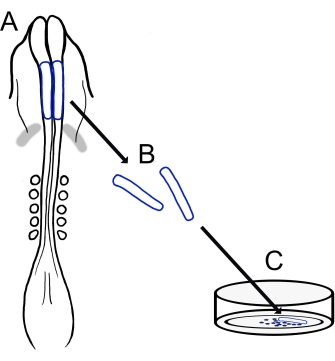
Рисунок 1: Схематический обзор протокола культивирования черепно-мозговой складки цыпленка. (A,B) Черепные нервные складки (очерченные синим цветом) иссекаются из эмбриона цыпленка с пятью сомитами (показаны в дорсальном виде в А). Серые полосы, сердечный полумесяц. (C) При нанесении фибронектина мигрирующие клетки нервного гребня выходят из нервных складок и рассеиваются на субстрате. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Метод, описанный здесь, обеспечивает адаптируемый метод выделения нервных складок цыплят и их покрытия для создания культур мигрирующих черепных NCC. Эти культуры обеспечивают упрощенные 2D-условия для легкого анализа миграции и морфологии цыплят NCC, которые могут дополнять более техни?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы благодарим Коринн А. Фэйрчайлд и Кэти Л. Вермиллион, которые участвовали в разработке нашей версии протокола культивирования черепно-мозговой нейронной складки цыпленка.
Materials
| AxioObserver equipped with an LSM710 confocal scan head controlled by ZEN 3.0 SR software | Zeiss | Used alpha Plan-Apochromat 100x/1.46 Oil DIC M27 objective | |
| CaCl2 | Sigma-Aldrich | C3306 | |
| Chamber dishes (glass bottom, single or divided) | MatTek; Cell Vis | P35G-1.5-14-C (MatTek) X000NOJQGX (Cellvis) X000NOK1OJ (Cellvis) |
Single chamber 35 mm or 4 chamber 35 mm |
| Cover glass | Carolina Biological Supply Company | 633029, 633031, 633033, 633035, 633037 | circles, 0.13–0.17 mm thickness, available in 12-25 mm diameter |
| DMEM/F12 | ThermoFisher Scientific | 11320033 | Alternative for L15 media |
| Egg incubator | Sportsman | 1502 | |
| FBS | Life Technologies | 10437-028 | |
| Fibronectin | Fisher Scientific | CB-40008A | |
| Filter paper | Whatman | grade 3MM chromatography | |
| Forceps (blunt) | Fisher Scientific; Thomas Scientific | 08-890 (Fisher);1141W97 (Thomas) | |
| Forceps (fine) | Fine Science Tools | 11252-20 | Dumont #5 |
| Image J | https://fiji.sc/ | Free image analysis software | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P0662 | |
| L15 media | Invitrogen | 11415064 | |
| L-glutamine | Invitrogen | 25030 | |
| Mounting Media (Vectashield or ProLong Gold) | Vector Laboratories; Thermofisher Scientific | H-1700 (Vectashield); P36930 (ProLong Gold) | |
| Na2HPO4 | Sigma-Aldrich | S9638 | |
| NaCl | Sigma-Aldrich | S9888 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin/streptomycin | Life Technologies | 15140-148 | 10,000 Units/mL Penicillin; 10,000 mg/mL Streptomycin |
| Petri Dishes | VWR (or similar) | 60 mm, 100 mm | |
| Phalloidin | Sigma-Aldrich | P1951 | multiple flurophores available |
| Pin holder | Fine Science Tools | 26016-12 | For tungsten needle (alternative for spring scissors) |
| Scissors (dissection) | Fine Science Tools | 14061-10 | |
| Spring Scissors | Fine Science Tools | 15000-08 | 2.5 mm cutting edge (alternative for tungsten needle) |
| Sylgard | Krayden | Sylgard 184 | |
| Syringe Filters | Sigma-Aldrich | SLGVM33RS | Millex-GV Syringe Filter Unit, 0.22 µm, PVDF, 33 mm, gamma sterilized |
| Tissue culture dishes | Sarstedt | 83-3900 | 35 mm culture dishes for bulk neural fold cultures |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Tungsten wire | Variety of sources | 0.01" diameter for tungsten needle (alternative for spring scissors) |
References
- Pla, P., Monsoro-Burq, A. H. The neural border: Induction, specification and maturation of the territory that generates neural crest cells. Developmental Biology. 444, 36-46 (2018).
- Tang, W., Bronner, M. E. Neural crest lineage analysis: From past to future trajectory. Development. 147 (20), (2021).
- Piacentino, M. L., Li, Y., Bronner, M. E. Epithelial-to-mesenchymal transition and different migration strategies as viewed from the neural crest. Current Opinion in Cell Biology. 66, 43-50 (2020).
- McLennan, R., et al. Neural crest cells bulldoze through the microenvironment using Aquaporin 1 to stabilize filopodia. Development. 147 (1), 185231 (2020).
- Carmona-Fontaine, C., et al. Complement fragment C3a controls mutual cell attraction during collective cell migration. Developmental Cell. 21 (6), 1026-1037 (2011).
- Giovannone, D., et al. Slits affect the timely migration of neural crest cells via robo receptor. Developmental Dynamics. 241 (8), 1274-1288 (2012).
- Vermillion, K. L., Lidberg, K. A., Gammill, L. S. Cytoplasmic protein methylation is essential for neural crest migration. Journal of Cell Biology. 204 (1), 95-109 (2014).
- Yang, X., Li, J., Zeng, W., Li, C., Mao, B. Elongator Protein 3 (Elp3) stabilizes Snail1 and regulates neural crest migration in Xenopus. Scientific Reports. 6 (1), 1-9 (2016).
- Gonzalez Malagon, S. G., et al. Glycogen synthase kinase 3 controls migration of the neural crest lineage in mouse and Xenopus. Nature Communications. 9 (1), 1-15 (2018).
- Bhattacharya, D., Azambuja, A. P., Simoes-Costa, M. Metabolic reprogramming promotes neural crest migration via yap/tead signaling. Developmental Cell. 53 (2), 199-211 (2020).
- Jacques-Fricke, B. T., et al. Profiling NSD3-dependent neural crest gene expression reveals known and novel candidate regulatory factors. Developmental Biology. 475, 118-130 (2021).
- Bronner-Fraser, M., García-Castro, M. Chapter 4 manipulations of neural crest cells or their migratory pathways. Methods in Cell Biology. 87, 75-96 (2008).
- Milet, C., Monsoro-Burq, A. H. Dissection of xenopus laevis neural crest for in vitro explant culture or in vivo transplantation. Journal of Visualized Experiments. (85), e51118 (2014).
- Malagon, S. G. G., et al. Dissection, culture and analysis of primary cranial neural crest cells from mouse for the study of neural crest cell delamination and migration. Journal of Visualized Experiments. (152), e60051 (2019).
- Theveneau, E., Mayor, R. Neural crest delamination and migration: From epithelium-to-mesenchyme transition to collective cell migration. Developmental Biology. 366 (1), 34-54 (2012).
- Conrad, G. W., Bee, J. A., Roche, S. M., Teillet, M. A. Fabrication of microscalpels by electrolysis of tungsten wire in a meniscus. Journal of Neuroscience Methods. 50 (1), 123-127 (1993).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Gammill, L. S., Jacques-Fricke, B., Roffers-Agarwal, J. Embryological and genetic manipulation of chick development. Methods in Molecular Biology. 1920, 75-97 (2019).
- Vandekerckhove, J., Deboben, A., Nassal, M., Wieland, T. The phalloidin binding site of F-actin. The EMBO Journal. 4 (11), 2815-2818 (1985).
- Bronner-Fraser, M. Analysis of the early stages of trunk neural crest migration in avian embryos using monoclonal antibody HNK-1. Developmental Biology. 115 (1), 44-55 (1986).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Soille, P., Vincent, L. Determining watersheds in digital pictures via flooding simulations. Visual Communications and Image Processing ’90: Fifth in a Series. (1360), 240-250 (1990).
- Haupt, A., Minc, N. How cells sense their own shape – mechanisms to probe cell geometry and their implications in cellular organization and function. Journal of Cell Science. 131 (6), (2018).
- Ezin, M., Fraser, S. Chapter 11 time-lapse imaging of the early avian embryo. Methods in Cell Biology. 87, 211-236 (2008).
- Kulesa, P. M., Bailey, C. M., Cooper, C., Fraser, S. E. In ovo live imaging of avian embryos. Cold Spring Harbor Protocols. 5 (6), (2010).
- McKinney, M. C., Kulesa, P. M. Live imaging of the neural crest cell epithelial-to-mesenchymal transition in the chick embryo. Methods in Molecular Biology. 2179, 107-114 (2021).
- Gustafson, C. M., Roffers-Agarwal, J., Gammill, L. S. Chick cranial neural crest cells release extracellular vesicles that are critical for their migration. Journal of Cell Science. , (2022).
- Williams, R., Sauka-Spengler, T. Ex ovo electroporation of early chicken embryos. STAR Protocols. 2 (2), 100424 (2021).
- Moulton, J. D. Using morpholinos to control gene expression. Current Protocols in Nucleic Acid Chemistry. 68 (1), 4-30 (2017).
- Gandhi, S., et al. A single-plasmid approach for genome editing coupled with long-term lineage analysis in chick embryos. Development. 148 (7), (2021).
- Williams, R. M., et al. Reconstruction of the Global Neural Crest Gene Regulatory Network In Vivo. Developmental Cell. 51 (2), 255-267 (2019).

