ニワトリ頭蓋神経堤細胞培養物の作製と形態解析
Summary
この汎用性の高いプロトコルは、ニワトリ胚からの脳神経襞の切除による遊走性神経堤細胞(NCC)の単離について説明しています。プレーティングとインキュベーションを行うと、遊走性NCCが神経襞の外植片から出現し、単純化された2D環境での細胞形態と遊走の評価を可能にします。
Abstract
脊椎動物の発生中、神経堤細胞(NCC)は広範囲に移動し、頭蓋顔面骨格や末梢神経系などの構造に寄与するさまざまな細胞型に分化します。NCCの移動を3D胚の文脈で理解することは重要ですが、2D培養で遊走細胞を単離することで、可視化と機能特性評価が容易になり、胚研究を補完します。本プロトコルは、初代NCC培養物を生成するためにニワトリ脳神経襞を単離する方法を示す。遊走性NCCは、フィブロネクチンでコーティングされた基質に播種された神経襞の外植片から出現します。これにより、分散した付着性NCC集団が得られ、染色および定量的形態学的分析によって評価できます。この単純化された文化アプローチは適応性が高く、他の手法と組み合わせることができます。例えば、NCCの遊走および移動行動は、タイムラプスイメージングによって評価するか、または遺伝子発現の阻害剤または実験的操作(例えば、DNA、モルホリノ、またはCRISPRエレクトロポレーション)を含むことによって機能的に照会することができる。その汎用性のために、この方法は頭蓋NCC発達を調査するための強力なシステムを提供します。
Introduction
神経堤細胞(NCC)は、脊椎動物の胚の一過性細胞集団です。NCCは神経板の境界で特定され、背側神経管1から移行するために上皮間葉転換(EMT)を受けます。EMT後、NCCは胚全体に広範囲に分散し、最終的には頭蓋顔面骨格、心臓の流出路、末梢神経系の大部分など、さまざまな構造を分化させて寄与します2。細胞極性、細胞骨格、および接着特性の変化は、遊走性細胞集団から遊走性細胞集団へのこのシフトの根底にあります3。NCC EMTと遊走を研究することで、細胞の運動性の基本的なメカニズムについての洞察が得られ、先天性欠損症と癌転移を予防および治療するための取り組みに情報を提供します。
in vivo分析は、胚の文脈でNCC発生プロセスを理解するために不可欠ですが、in vitroメソッドは、追加の実験手段を容易にする視覚的および物理的なアクセシビリティを提供します。単純化された2D環境では、NCC形態、細胞骨格構造、および移動距離を評価できます。さらに、運動性NCCの移動行動に対する遺伝的または可溶性因子の摂動の影響を分析することができます4、5、6、7、8、9、10。さらに、単離された遊走性または移動性NCCを収集、プールし、プロテオミクス、トランスクリプトミクス、およびエピゲノムプロファイリングを通じてNCCの発生調節を研究するためのハイスループット方法論に使用することができます7,11。さまざまな発生モデル生物から頭蓋NCCを調製する方法が利用可能である12,13,14が利用可能ですが、この記事では、ニワトリ胚から頭蓋NCCを培養することを最初に学んだ人のためのアプローチの仕組みを示します。
現在のプロトコルは、ニワトリ頭蓋NCC培養物を調製するための汎用性の高い技術を記載しています(図1)。NCCは外植された神経襞から培養基質に容易に移動するため、ニワトリNCCは胚組織から自然に分離し、初代培養物が容易に生成されます。中脳NCCが脳神経襞から一斉に移動すると(体幹15の細胞ごとの層間剥離とは対照的に)、これらの培養物は主に遊走性脳神経堤細胞で構成され、最初の神経襞切除は遊走性NCCの収集方法を提供します。ニワトリ脳神経襞を解剖して培養するための基本的な方法を詳述し、この方法のさまざまな用途とバリエーションの提案を提供します。
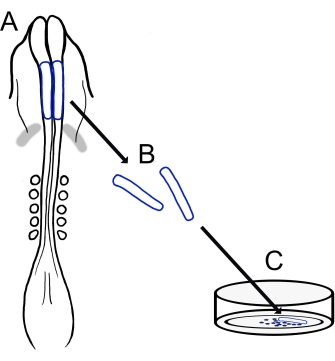
図1:ニワトリ脳神経襞培養プロトコルの概略図。 (A,B)脳神経襞(青色で輪郭が描かれている)は、5つの体節を持つニワトリ胚から切除されます(Aの背側図で示されています)。灰色の帯、心臓の三日月。(C)フィブロネクチンにプレーティングすると、遊走性神経堤細胞が神経襞から出現し、基質上に分散する。 この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
ここで説明する技術は、ニワトリの神経襞を分離し、それらをメッキして移動性頭蓋NCCの培養物を作成する適応可能な方法を提供します。これらの培養物は、ニワトリNCCの移動および形態の容易な分析のための単純化された2D条件を提供し、卵子イメージング法におけるより技術的に困難なものを補完することができる24、25、26<sup cl…
Disclosures
The authors have nothing to disclose.
Acknowledgements
コリーヌ・A・フェアチャイルドとケイティ・L・バーミリオンが、ニワトリ脳神経襞培養プロトコルの開発に参加してくださったことに感謝します。
Materials
| AxioObserver equipped with an LSM710 confocal scan head controlled by ZEN 3.0 SR software | Zeiss | Used alpha Plan-Apochromat 100x/1.46 Oil DIC M27 objective | |
| CaCl2 | Sigma-Aldrich | C3306 | |
| Chamber dishes (glass bottom, single or divided) | MatTek; Cell Vis | P35G-1.5-14-C (MatTek) X000NOJQGX (Cellvis) X000NOK1OJ (Cellvis) |
Single chamber 35 mm or 4 chamber 35 mm |
| Cover glass | Carolina Biological Supply Company | 633029, 633031, 633033, 633035, 633037 | circles, 0.13–0.17 mm thickness, available in 12-25 mm diameter |
| DMEM/F12 | ThermoFisher Scientific | 11320033 | Alternative for L15 media |
| Egg incubator | Sportsman | 1502 | |
| FBS | Life Technologies | 10437-028 | |
| Fibronectin | Fisher Scientific | CB-40008A | |
| Filter paper | Whatman | grade 3MM chromatography | |
| Forceps (blunt) | Fisher Scientific; Thomas Scientific | 08-890 (Fisher);1141W97 (Thomas) | |
| Forceps (fine) | Fine Science Tools | 11252-20 | Dumont #5 |
| Image J | https://fiji.sc/ | Free image analysis software | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P0662 | |
| L15 media | Invitrogen | 11415064 | |
| L-glutamine | Invitrogen | 25030 | |
| Mounting Media (Vectashield or ProLong Gold) | Vector Laboratories; Thermofisher Scientific | H-1700 (Vectashield); P36930 (ProLong Gold) | |
| Na2HPO4 | Sigma-Aldrich | S9638 | |
| NaCl | Sigma-Aldrich | S9888 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin/streptomycin | Life Technologies | 15140-148 | 10,000 Units/mL Penicillin; 10,000 mg/mL Streptomycin |
| Petri Dishes | VWR (or similar) | 60 mm, 100 mm | |
| Phalloidin | Sigma-Aldrich | P1951 | multiple flurophores available |
| Pin holder | Fine Science Tools | 26016-12 | For tungsten needle (alternative for spring scissors) |
| Scissors (dissection) | Fine Science Tools | 14061-10 | |
| Spring Scissors | Fine Science Tools | 15000-08 | 2.5 mm cutting edge (alternative for tungsten needle) |
| Sylgard | Krayden | Sylgard 184 | |
| Syringe Filters | Sigma-Aldrich | SLGVM33RS | Millex-GV Syringe Filter Unit, 0.22 µm, PVDF, 33 mm, gamma sterilized |
| Tissue culture dishes | Sarstedt | 83-3900 | 35 mm culture dishes for bulk neural fold cultures |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Tungsten wire | Variety of sources | 0.01" diameter for tungsten needle (alternative for spring scissors) |
References
- Pla, P., Monsoro-Burq, A. H. The neural border: Induction, specification and maturation of the territory that generates neural crest cells. Developmental Biology. 444, 36-46 (2018).
- Tang, W., Bronner, M. E. Neural crest lineage analysis: From past to future trajectory. Development. 147 (20), (2021).
- Piacentino, M. L., Li, Y., Bronner, M. E. Epithelial-to-mesenchymal transition and different migration strategies as viewed from the neural crest. Current Opinion in Cell Biology. 66, 43-50 (2020).
- McLennan, R., et al. Neural crest cells bulldoze through the microenvironment using Aquaporin 1 to stabilize filopodia. Development. 147 (1), 185231 (2020).
- Carmona-Fontaine, C., et al. Complement fragment C3a controls mutual cell attraction during collective cell migration. Developmental Cell. 21 (6), 1026-1037 (2011).
- Giovannone, D., et al. Slits affect the timely migration of neural crest cells via robo receptor. Developmental Dynamics. 241 (8), 1274-1288 (2012).
- Vermillion, K. L., Lidberg, K. A., Gammill, L. S. Cytoplasmic protein methylation is essential for neural crest migration. Journal of Cell Biology. 204 (1), 95-109 (2014).
- Yang, X., Li, J., Zeng, W., Li, C., Mao, B. Elongator Protein 3 (Elp3) stabilizes Snail1 and regulates neural crest migration in Xenopus. Scientific Reports. 6 (1), 1-9 (2016).
- Gonzalez Malagon, S. G., et al. Glycogen synthase kinase 3 controls migration of the neural crest lineage in mouse and Xenopus. Nature Communications. 9 (1), 1-15 (2018).
- Bhattacharya, D., Azambuja, A. P., Simoes-Costa, M. Metabolic reprogramming promotes neural crest migration via yap/tead signaling. Developmental Cell. 53 (2), 199-211 (2020).
- Jacques-Fricke, B. T., et al. Profiling NSD3-dependent neural crest gene expression reveals known and novel candidate regulatory factors. Developmental Biology. 475, 118-130 (2021).
- Bronner-Fraser, M., García-Castro, M. Chapter 4 manipulations of neural crest cells or their migratory pathways. Methods in Cell Biology. 87, 75-96 (2008).
- Milet, C., Monsoro-Burq, A. H. Dissection of xenopus laevis neural crest for in vitro explant culture or in vivo transplantation. Journal of Visualized Experiments. (85), e51118 (2014).
- Malagon, S. G. G., et al. Dissection, culture and analysis of primary cranial neural crest cells from mouse for the study of neural crest cell delamination and migration. Journal of Visualized Experiments. (152), e60051 (2019).
- Theveneau, E., Mayor, R. Neural crest delamination and migration: From epithelium-to-mesenchyme transition to collective cell migration. Developmental Biology. 366 (1), 34-54 (2012).
- Conrad, G. W., Bee, J. A., Roche, S. M., Teillet, M. A. Fabrication of microscalpels by electrolysis of tungsten wire in a meniscus. Journal of Neuroscience Methods. 50 (1), 123-127 (1993).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Gammill, L. S., Jacques-Fricke, B., Roffers-Agarwal, J. Embryological and genetic manipulation of chick development. Methods in Molecular Biology. 1920, 75-97 (2019).
- Vandekerckhove, J., Deboben, A., Nassal, M., Wieland, T. The phalloidin binding site of F-actin. The EMBO Journal. 4 (11), 2815-2818 (1985).
- Bronner-Fraser, M. Analysis of the early stages of trunk neural crest migration in avian embryos using monoclonal antibody HNK-1. Developmental Biology. 115 (1), 44-55 (1986).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Soille, P., Vincent, L. Determining watersheds in digital pictures via flooding simulations. Visual Communications and Image Processing ’90: Fifth in a Series. (1360), 240-250 (1990).
- Haupt, A., Minc, N. How cells sense their own shape – mechanisms to probe cell geometry and their implications in cellular organization and function. Journal of Cell Science. 131 (6), (2018).
- Ezin, M., Fraser, S. Chapter 11 time-lapse imaging of the early avian embryo. Methods in Cell Biology. 87, 211-236 (2008).
- Kulesa, P. M., Bailey, C. M., Cooper, C., Fraser, S. E. In ovo live imaging of avian embryos. Cold Spring Harbor Protocols. 5 (6), (2010).
- McKinney, M. C., Kulesa, P. M. Live imaging of the neural crest cell epithelial-to-mesenchymal transition in the chick embryo. Methods in Molecular Biology. 2179, 107-114 (2021).
- Gustafson, C. M., Roffers-Agarwal, J., Gammill, L. S. Chick cranial neural crest cells release extracellular vesicles that are critical for their migration. Journal of Cell Science. , (2022).
- Williams, R., Sauka-Spengler, T. Ex ovo electroporation of early chicken embryos. STAR Protocols. 2 (2), 100424 (2021).
- Moulton, J. D. Using morpholinos to control gene expression. Current Protocols in Nucleic Acid Chemistry. 68 (1), 4-30 (2017).
- Gandhi, S., et al. A single-plasmid approach for genome editing coupled with long-term lineage analysis in chick embryos. Development. 148 (7), (2021).
- Williams, R. M., et al. Reconstruction of the Global Neural Crest Gene Regulatory Network In Vivo. Developmental Cell. 51 (2), 255-267 (2019).

