토마토의 종자 개발 연구를위한 효율적인 청산 프로토콜 (Solanum lycopersicum L.)
Summary
토마토 씨앗은 식물 생식 중 유전학 및 발생 생물학을 연구하는 중요한 모델입니다. 이 프로토콜은 더 미세한 배아 구조를 관찰하기 위해 다양한 발달 단계에서 토마토 씨앗을 제거하는 데 유용합니다.
Abstract
토마토 (Solanum lycopersicum L.)는 전 세계적으로 주요 현금 작물 중 하나입니다. 토마토 씨앗은 식물 생식 중 유전학 및 발생 생물학을 연구하는 중요한 모델입니다. 토마토 종자 내에서 더 미세한 배아 구조의 시각화는 종종 종자 코트 점액, 다세포 층 외피 및 두꺼운 벽의 배유에 의해 방해를 받으며, 이는 힘든 매립 절단으로 해결해야 합니다. 더 간단한 대안은 화학 약품을 사용하여 종자를 거의 투명하게 만드는 조직 제거 기술을 사용하는 것입니다. 기존의 개간 절차를 통해 더 얇은 종자 코트로 더 작은 종자에 대한 깊은 통찰력을 얻을 수 있지만 토마토 종자를 제거하는 것은 특히 발달 후반 단계에서 기술적으로 계속 어렵습니다.
여기에 제시된 것은 배아 형태가 거의 완성 된 개화 후 3 일에서 23 일 사이에 토마토 종자 발달을 관찰하기위한 신속하고 노동력을 절약하는 개간 프로토콜입니다. 이 방법은 Arabidopsis 에서 널리 사용되는 클로랄 수화물 기반 클리어링 용액을 포르말린-아세토-알코올(FAA) 고정 생략, 종자의 차아염소산나트륨 처리 추가, 연화 종자 코트 점액 제거, 세척 및 진공 처리를 포함한 다른 수정과 결합합니다. 이 방법은 다양한 발달 단계에서 토마토 종자를 효율적으로 제거하는 데 적용 할 수 있으며 공간 분해능이 좋은 돌연변이 종자의 발달 과정을 완전히 모니터링하는 데 유용합니다. 이 클리어링 프로토콜은 Solanaceae에서 상업적으로 중요한 다른 종의 심층 이미징에도 적용될 수 있습니다.
Introduction
토마토(S. lycopersicum L.)는 전 세계에서 가장 중요한 채소 작물 중 하나이며 2020년 510만 헥타르에서 1억 8,680만 톤의 다육질 과일을 생산했습니다1. 그것은 가지, 고추, 감자 및 담배와 같은 상업적으로 중요한 많은 작물을 포함하여 약 2,716 종2의 큰 Solanaceae 가족에 속합니다. 재배 된 토마토는 게놈 크기가 약 900 Mb3 인 이배체 종 (2n = 2x = 24)입니다. 오랫동안 야생 Solanum spp에서 바람직한 형질을 선택하여 토마토 가축화 및 번식에 많은 노력을 기울였습니다. 토마토 유전학 자원 센터에는 5,000개 이상의 토마토 가입이 나열되어 있으며전 세계적으로 80,000개 이상의 토마토 생식질이 저장되어 있습니다4. 토마토 식물은 온실에서 다년생이며 씨앗으로 번식합니다. 성숙한 토마토 종자는 다 자란 배아, 잔류 세포형 배유 및 단단한 종자 코트 5,6의 세 가지 주요 구획으로 구성됩니다 (그림 1A). 이중 수정 후, 세포형 배유의 발달은 접합체의 발달에 선행한다. 개화 후 ~ 5-6 일 (DAF)에, 배유가 6-8 개의 핵으로 구성 될 때 2 세포 배아가 처음 관찰됩니다7. Solanum pimpinellifolium에서 배아는 20 DAF 후에 최종 크기에 접근하고 종자는 32 DAF8 후에 발아를 위해 생존 할 수 있습니다. 배아가 발달함에 따라 배유는 점차적으로 흡수되고 소량의 배젖 만 종자에 남아 있습니다. 잔류 배유는 방사상 끝을 둘러싸는 미세 정열 배유와 나머지 종자 9,10의 측면 배유로 구성됩니다. 외부 종자 코트는 외피의 두껍고 lignified 외부 표피에서 개발되며, 외피 잔해의 죽은 층과 함께 배아와 배유를 보호하기 위해 단단한 껍질을 형성합니다5.
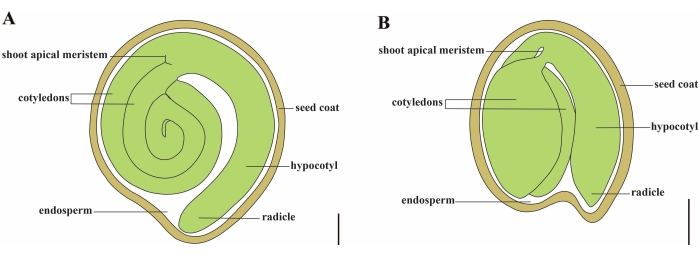
그림 1 : Solanum lycopersicum 및 Arabidopsis thaliana에서 성숙한 종자의 개략적 표현. (A) 성숙한 토마토 종자의 종단 해부학. (B) 성숙한 애기장대 종자의 종단 해부학. 성숙한 토마토 씨앗은 애기장대 씨앗보다 크기가 약 70 배 더 큽니다. 스케일 바 = (A) 400 μm, (B) 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
고품질 토마토 종자의 생산은 배아, 배유 및 모체 종자 성분 사이의 조정에 달려있다11. 종자 개발에서 핵심 유전자와 네트워크를 해부하려면 돌연변이 종자에 대한 심층적이고 완전한 표현형 기록이 필요합니다. 반박형 섹션 및 파라핀 섹션과 같은 종래의 임베딩-절편 기술은 배아12,13,14,15의 국소 및 미세 구조를 관찰하기 위해 토마토 종자에 널리 적용됩니다. 그러나 얇은 섹션에서 종자 발달을 분석하는 것은 일반적으로 힘들고 z 축 공간 해상도가 부족합니다. 이에 비해 조직 투명화는 발생할 가능성이 가장 높은 배아 결함의 발달 단계를 정확히 찾아내는 빠르고 효율적인 방법입니다16. 투명화 방법은 굴절률을 하나 이상의 생화학적 제제(16)로 균질화함으로써 내부 조직의 불투명도를 감소시킨다. 전체 조직 투명화는 그 완전성을 파괴하지 않으면서 식물 조직 구조의 관찰을 가능하게 하며, 투명화 기술과 3차원 이미징의 결합은 식물 기관의 형태 및 발달 상태에 대한 정보를 얻기 위한 이상적인 솔루션이 되었다(17,18). 수년에 걸쳐 종자 개간 기술은 Arabidopsis thaliana, Hordeum vulgare 및 Beta vulgaris 19,20,21,22,23을 포함한 다양한 식물 종에서 사용되었습니다. 이 중 전체 마운트 난자 제거 기술은 크기가 작고 종자 코트 세포의 4-5 층과 핵형 배유24,25로 인해 Arabidopsis의 종자 발달을 연구하는 효율적인 접근 방식이었습니다. Hoyer의 용액26의 출현과 같은 다양한 클리어링 혼합물의 지속적인 업데이트와 함께, 배젖이 종자의 대부분을 구성하지만 보리 난자의 내부 구조가 높은 수준의 선명도로 이미지화되었습니다. 사탕무의 배발생은 진공 처리와 결합 및 염산19로 연화함으로써 관찰할 수 있다. 그럼에도 불구하고 위에서 언급 한 종과 달리 토마토 종자의 프로토콜을 제거함으로써 발생 학적 관찰은보고되지 않았습니다. 이것은 토마토의 배아 및 종자 발달에 대한 상세한 조사를 방해합니다.
클로랄 수화물은 침지된 조직 및 세포가 상이한 광학 평면 상에 디스플레이될 수 있게 하고, 세포 또는 조직 성분(27,28,29)을 실질적으로 보존하는 클리어링 용액으로서 통상적으로 사용된다. 클로랄 하이드레이트 기반 클리어링 프로토콜은 Arabidopsis21,28의 배아와 배유를 관찰하기 위해 종자의 전체 마운트 클리어링에 성공적으로 사용되었습니다. 그러나이 청소 솔루션은 Arabidopsis 씨앗보다 불 침투성 토마토 씨앗을 제거하는 데 효율적이지 않습니다. 물리적 장벽은 다음과 같습니다 : (1) 토마토 외피는 3에서 15 DAF 30,31에 거의 20 개의 세포층을 가지고 있으며, (2) 토마토 배유는 핵 유형 32가 아닌 세포 유형이며, (3) 토마토 씨앗은 크기가 약 70 배 더 큽니다33,34 (4) 다량의 종자 코트 점액을 생성하여 투명 시약의 침투를 차단하고 배아 세포의 시각화에 영향을 미칩니다.
따라서 이 보고서는 다양한 단계에서 토마토 종자의 전체 마운트 제거를 위한 최적화된 클로랄 하이드레이트 기반 투명화 방법을 제시하여 배아 발달 과정을 심층 이미징할 수 있습니다(그림 2).
Protocol
Representative Results
Discussion
기계적 절편에 비해, 클리어링 기술은 식물 조직 또는 기관(16)의 완전성을 유지하므로 3차원 이미징에 더 유리하다. 기존의 클리어링 프로토콜은 화학 용액의 침투가 쉽기 때문에 종종 작은 샘플로 제한됩니다. 토마토 씨앗은 크기가 Arabidopsis 종자보다 약 70 배 크고 투과성 장벽이 더 많기 때문에 조직 청소에 문제가되는 샘플입니다. 애기장대 종자 코트는 외부 외?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
저자는 각각 미분 간섭 대비 현미경과 기존 투명화 방법에 대한 유용한 제안을 해준 Jie Le 박사와 Xiufen Song 박사에게 감사드립니다. 이 연구는 중국 국립 자연 과학 재단 (31870299)과 중국 과학원 청소년 혁신 촉진 협회의 재정 지원을 받았습니다. 그림 2는 BioRender.com 로 작성되었습니다.
Materials
| 1,000 µL pipette | GILSON | FA10006M | |
| 1,000 µL pipette tips | Corning | T-1000-B | |
| 2 ml centrifuge tube | Axygen | MCT-200-C | |
| 37% formaldehyde | DAMAO | 685-2013 | |
| 5,000 µL pipette | Eppendorf | 3120000275 | |
| 5,000 µL pipette tips | biosharp | BS-5000-TL | |
| 50 ml centrifuge tube | Corning | 430829 | |
| Absolute Ethanol | BOYUAN | 678-2002 | |
| Bottle glass | Fisher | FB800-100 | |
| Chloral Hydrate | Meryer | M13315-100G | |
| Coverslip | Leica | 384200 | |
| DIC microscope | Zeiss | Axio Imager A1 | 10x, 20x and 40x magnification |
| Disinfectant | QIKELONGAN | 17-9185 | |
| Dissecting needle | Bioroyee | 17-9140 | |
| Flower nutrient soil | FANGJIE | ||
| Forceps | HAIOU | 4-94 | |
| Glacial Acetic Acid | BOYUAN | 676-2007 | |
| Glycerol | Solarbio | G8190 | |
| Magnetic stirrer | IKA | RET basic | |
| Micro-Tom | Tomato Genetics Resource Center | LA3911 | |
| Orbital shaker | QILINBEIER | QB-206 | |
| Seeding substrate | PINDSTRUP | LV713/018-LV252 | Screening:0-10 mm |
| Single concave slide | HUABODEYI | HBDY1895 | |
| Slide | Leica | 3800381 | |
| Stereomicroscope | Leica | S8 APO | 1x to 4x magnification |
| Tin foil | ZAOWUFANG | 613 | |
| Tween 20 | Sigma | P1379 | |
| Vacuum pump | SHIDING | SHB-III | |
| Vortex meter | Silogex | MX-S |
References
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data/QCL (2022)
- Olmstead, R. G., Bohs, L. A summary of molecular systematic research in Solanaceae: 1982-2006. Acta Horticulturae. 745, 255-268 (2007).
- Consortium, T. G. The tomato genome sequence provides insights into fleshy fruit evolution. Nature. 485 (7400), 635-641 (2012).
- Ebert, A. W., Chou, Y. Y. The tomato collection maintained by AVRDC – The World Vegetable Center: composition, germplasm dissemination and use in breeding. Acta Horticulturae. 1101, 169-176 (2015).
- Hilhorst, H., Groot, S., Bino, R. J. The tomato seed as a model system to study seed development and germination. Acta Botanica Neerlandica. 47, 169-183 (1998).
- Chaban, I. A., Gulevich, A. A., Kononenko, N. V., Khaliluev, M. R., Baranova, E. N. Morphological and structural details of tomato seed coat formation: A different functional role of the inner and outer epidermises in unitegmic ovule. Plants-Basel. 11 (9), 1101 (2022).
- Iwahori, S. High temperature injuries in tomato. V. Fertilization and development of embryo with special reference to the abnormalities caused by high temperature. Journal of The Japanese Society for Horticultural Science. 35 (4), 379-386 (1966).
- Xiao, H., et al. Integration of tomato reproductive developmental landmarks and expression profiles, and the effect of SUN. on fruit shape. BMC Plant Biology. 9 (1), 49 (2009).
- Karssen, C. M., Haigh, A. M., Toorn, P., Weges, R., Taylorson, R. B. Physiological mechanisms involved in seed priming. Recent advances in the development and germination of seeds. NATO ASI Series. 187, (1989).
- Nonogaki, H. Seed dormancy and germination-emerging mechanisms and new hypotheses. Frontiers in Plant Science. 5, 233 (2014).
- Doll, N. M., Ingram, G. C. Embryo-endosperm interactions. Annual Review of Plant Biology. 73, 293-321 (2022).
- Serrani, J. C., Fos, M., Atarés, A., García-Martínez, J. L. Effect of gibberellin and auxin on parthenocarpic fruit growth induction in the cv micro-tom of tomato. Journal of Plant Growth Regulation. 26 (3), 211-221 (2007).
- Yang, C., et al. A regulatory gene induces trichome formation and embryo lethality in tomato. Proceedings of the National Academy of Sciences USA. 108 (29), 11836-11841 (2011).
- Goetz, S., et al. Role of cis-12-oxo-phytodienoic acid in tomato embryo development. Plant Physiology. 158 (4), 1715-1727 (2012).
- Ko, H. Y., Ho, L. H., Neuhaus, H. E., Guo, W. J. Transporter SlSWEET15 unloads sucrose from phloem and seed coat for fruit and seed development in tomato. Plant Physiology. 187 (4), 2230-2245 (2021).
- Richardson, D. S., Lichtman, J. W. Clarifying tissue clearing. Cell. 162 (2), 246-257 (2015).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Kwiatkowska, M., Kadłuczka, D., Wędzony, M., Dedicova, B., Grzebelus, E. Refinement of a clearing protocol to study crassinucellate ovules of the sugar beet (Beta vulgaris L., Amaranthaceae). Plant Methods. 15, 71 (2019).
- Ponitka, A., Ślusarkiewicz-Jarzina, A. Cleared-ovule technique used for rapid access to early embryo development in Secale cereale × Zea mays crosses. Acta Biologica Cracoviensia. Series Botanica. 46, 133-137 (2014).
- Ceccato, L., et al. Maternal control of PIN1 is required for female gametophyte development in Arabidopsis. PLoS One. 8 (6), 66148 (2013).
- Wilkinson, L. G., Tucker, M. R. An optimised clearing protocol for the quantitative assessment of sub-epidermal ovule tissues within whole cereal pistils. Plant Methods. 13, 67 (2017).
- Hedhly, A., Vogler, H., Eichenberger, C., Grossniklaus, U. Whole-mount clearing and staining of Arabidopsis flower organs and Siliques. Journal of Visualized Experiments. (134), e56441 (2018).
- Creff, A., Brocard, L., Ingram, G. A mechanically sensitive cell layer regulates the physical properties of the Arabidopsis seed coat. Nature Communications. 6, 6382 (2015).
- Yang, T., et al. The B3 domain-containing transcription factor ZmABI19 coordinates expression of key factors required for maize seed development and grain filling. Plant Cell. 33 (1), 104-128 (2021).
- Anderson, L. E. Hoyer’s solution as a rapid permanent mounting medium for bryophytes. Bryologist. 57 (3), 242-244 (1954).
- Herr, J. M. A new clearing-squash technique for the study of ovule development in angiosperms. American Journal of Botany. 58 (8), 785-790 (1971).
- Yadegari, R., et al. Cell differentiation and morphogenesis are uncoupled in Arabidopsis raspberry embryos. The Plant Cell. 6 (12), 1713-1729 (1995).
- Grini, P. E., Jurgens, G., Hulskamp, M. Embryo and endosperm development is disrupted in the female gametophytic capulet mutants of Arabidopsis. Genetics. 162 (4), 1911-1925 (2002).
- Kataoka, K., Uemachi, A., Yazawa, S. Fruit growth and pseudoembryo development affected by uniconazole, an inhibitor of gibberellin biosynthesis, in pat-2 and auxin-Induced parthenocarpic tomato fruits. Scientia Horticulturae. 98 (1), 9-16 (2003).
- de Jong, M., Wolters-Arts, M., Feron, R., Mariani, C., Vriezen, W. H. The Solanum lycopersicum auxin response factor 7 (SlARF7) regulates auxin signaling during tomato fruit set and development. Plant Journal. 57 (1), 160-170 (2009).
- Roth, M., Florez-Rueda, A. M., Paris, M., Stadler, T. Wild tomato endosperm transcriptomes reveal common roles of genomic imprinting in both nuclear and cellular endosperm. Plant Journal. 95 (6), 1084-1101 (2018).
- Orsi, C. H., Tanksley, S. D. Natural variation in an ABC transporter gene associated with seed size evolution in tomato species. PLoS Genetics. 5 (1), 1000347 (2009).
- Herridge, R. P., Day, R. C., Baldwin, S., Macknight, R. C. Rapid analysis of seed size in Arabidopsis for mutant and QTL discovery. Plant Methods. 7 (1), 3 (2011).
- Xu, T. T., Ren, S. C., Song, X. F., Liu, C. M. CLE19 expressed in the embryo regulates both cotyledon establishment and endosperm development in Arabidopsis. Journal of Experimental Botany. 66 (17), 5217-5227 (2015).
- Ghadiri Alamdari, N., Salmasi, S., Almasi, H. Tomato seed mucilage as a new source of biodegradable film-forming material: effect of glycerol and cellulose nanofibers on the characteristics of resultant films. Food and Bioprocess Technology. 14 (12), 2380-2400 (2021).
- Gardner, R. O. An overview of botanical clearing technique. Stain Technology. 50 (2), 99-105 (1975).
- Beresniewicz, M. M., Taylor, A. G., Goffinet, M. C., Terhune, B. T. Characterization and location of a semipermeable layer in seed coats of leek and onion (Liliaceae), tomato and pepper (Solanaceae). Seed Science and Technology. 23 (1), 123-134 (1995).
- Stebbins, G. L. A bleaching and clearing method for plant tissues. Science. 87 (2245), 21-22 (1938).
- Debenham, E. M. A modified technique for the microscopic examination of the xylem of whole plants or plant organs. Annals of Botany. 3 (2), 369-373 (1939).
- Morley, T. Accelerated clearing of plant leaves by NaOH in association with oxygen. Stain Technology. 43 (6), 315-319 (1968).

