Ein effizientes Clearing-Protokoll zur Untersuchung der Saatgutentwicklung bei Tomaten (Solanum lycopersicum L.)
Summary
Der Tomatensamen ist ein wichtiges Modell für das Studium der Genetik und Entwicklungsbiologie während der Pflanzenvermehrung. Dieses Protokoll ist nützlich, um Tomatensamen in verschiedenen Entwicklungsstadien zu entfernen, um die feinere embryonale Struktur zu beobachten.
Abstract
Tomate (Solanum lycopersicum L.) ist eine der wichtigsten Cash Crops weltweit. Der Tomatensamen ist ein wichtiges Modell für das Studium der Genetik und Entwicklungsbiologie während der Pflanzenvermehrung. Die Visualisierung einer feineren embryonalen Struktur innerhalb eines Tomatensamens wird oft durch Samenhüllenschleim, mehrzellige Schichtintegument und ein dickwandiges Endosperm behindert, das durch mühsames Einbetten aufgelöst werden muss. Eine einfachere Alternative ist der Einsatz von Gewebereinigungstechniken, die das Saatgut mit chemischen Mitteln nahezu transparent machen. Obwohl herkömmliche Clearingverfahren einen tiefen Einblick in kleinere Samen mit dünnerer Samenhülle ermöglichen, ist die Klärung von Tomatensamen vor allem in den späten Entwicklungsstadien eine technische Herausforderung.
Hier wird ein schnelles und arbeitssparendes Clearing-Protokoll vorgestellt, um die Entwicklung von Tomatensamen 3 bis 23 Tage nach der Blüte zu beobachten, wenn die embryonale Morphologie fast abgeschlossen ist. Diese Methode kombiniert eine in Arabidopsis weit verbreitete Chloralhydrat-basierte Reinigungslösung mit anderen Modifikationen, einschließlich des Wegfalls der Formalin-Aceto-Alkohol (FAA) -Fixierung, der Zugabe von Natriumhypochlorit-Behandlung von Samen, der Entfernung der erweichten Samenschichtschleimhaut sowie des Waschens und der Vakuumbehandlung. Diese Methode kann zur effizienten Reinigung von Tomatensamen in verschiedenen Entwicklungsstadien angewendet werden und ist nützlich bei der vollständigen Überwachung des Entwicklungsprozesses von mutierten Samen mit guter räumlicher Auflösung. Dieses Clearing-Protokoll kann auch auf die Tiefenbildgebung anderer kommerziell wichtiger Arten in den Solanaceae angewendet werden.
Introduction
Tomate (S. lycopersicum L.) ist eine der wichtigsten Gemüsekulturen der Welt, mit einer Produktion von 186,8 Millionen Tonnen fleischigen Früchten von 5,1 Millionen Hektar im Jahr 20201. Es gehört zur großen Familie der Solanaceae mit etwa 2.716 Arten2, darunter viele kommerziell wichtige Kulturen wie Auberginen, Paprika, Kartoffeln und Tabak. Die Kulturtomate ist eine diploide Art (2n = 2x = 24) mit einer Genomgröße von ca. 900Mb3. Seit langem werden große Anstrengungen unternommen, um Tomatendomestizierung und -züchtung zu züchten, indem wünschenswerte Merkmale aus wilden Solanum spp. Es gibt über 5.000 Tomatenakzessionen, die im Tomato Genetics Resource Center aufgeführt sind, und mehr als 80.000 Keimplasma von Tomaten werden weltweit gelagert4. Die Tomatenpflanze ist mehrjährig im Gewächshaus und vermehrt sich durch Samen. Ein reifer Tomatensamen besteht aus drei Hauptkompartimenten: einem ausgewachsenen Embryo, einem zellulären Endosperm und einer harten Samenschale 5,6 (Abbildung 1A). Nach doppelter Befruchtung geht die Entwicklung von zellulärem Endosperm der Entwicklung von Zygoten voraus. Bei ~5-6 Tagen nach der Blüte (DAF) wird erstmals ein zweizelliger Proembryo beobachtet, wenn das Endosperm aus sechs bis acht Kernen besteht7. Bei Solanum pimpinellifolium nähert sich der Embryo nach 20 DAF seiner endgültigen Größe, und die Samen sind nach 32 DAF8 für die Keimung geeignet. Wenn sich der Embryo entwickelt, wird das Endosperm allmählich absorbiert und nur eine kleine Menge Endosperm verbleibt im Samen. Das restliche Endosperm besteht aus mikropylarem Endosperm, das die Radikelspitze umgibt, und seitlichem Endosperm im Rest des Samens 9,10. Die äußere Samenhülle wird aus verdickter und verholzter äußerer Epidermis des Integuments entwickelt, und mit den abgestorbenen Schichten von Integumentresten bilden sie eine harte Schale, um den Embryo und das Endosperm zu schützen5.
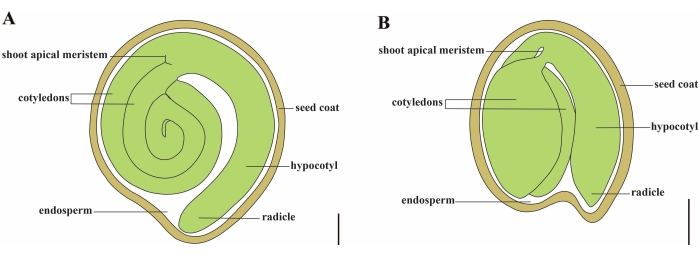
Abbildung 1: Schematische Darstellung eines reifen Samens in Solanum lycopersicum und Arabidopsis thaliana. (A) Längsanatomie eines reifen Tomatensamens. (B) Längsanatomie eines reifen Arabidopsis-Samens. Ein reifer Tomatensamen ist etwa 70-mal größer als ein Arabidopsis-Samen. Maßstabsbalken = (A) 400 μm, (B) 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die Produktion hochwertiger Tomatensamen hängt von der Koordination zwischen dem Embryo, dem Endosperm und den mütterlichen Samenbestandteilen ab11. Die Analyse von Schlüsselgenen und Netzwerken in der Samenentwicklung erfordert eine tiefe und vollständige phänotypische Aufzeichnung von mutierten Samen. Konventionelle Einbettungsschnitttechniken, wie der Halbdünnschliff und der Paraffinschnitt, werden häufig auf Tomatensamen angewendet, um die lokalen und feineren Strukturen des Embryoszu beobachten 12,13,14,15. Die Analyse der Seed-Entwicklung aus dünnen Schnitten ist jedoch in der Regel mühsam und es fehlt die räumliche Auflösung der z-Achse. Im Vergleich dazu ist die Gewebereinigung eine schnelle und effiziente Methode, um das Entwicklungsstadium von embryonalen Defekten zu bestimmen, die am wahrscheinlichsten auftreten16. Das Clearing-Verfahren verringert die Undurchsichtigkeit des inneren Gewebes durch Homogenisierung des Brechungsindex mit einem oder mehreren biochemischen Mitteln16. Die gesamte Gewebereinigung ermöglicht die Beobachtung einer pflanzlichen Gewebestruktur, ohne ihre Integrität zu zerstören, und die Kombination von Clearing-Technologie und dreidimensionaler Bildgebung ist zu einer idealen Lösung geworden, um Informationen über die Morphologie und den Entwicklungszustand eines Pflanzenorgans zu erhalten17,18. Im Laufe der Jahre wurden Samenreinigungstechniken bei verschiedenen Pflanzenarten eingesetzt, darunter Arabidopsis thaliana, Hordeum vulgare und Beta vulgaris 19,20,21,22,23. Unter diesen war die Whole-mount-Eizellenreinigungstechnologie ein effizienter Ansatz zur Untersuchung der Samenentwicklung von Arabidopsis, aufgrund ihrer geringen Größe, 4-5 Schichten der Samenhüllenzelle und des nuklearen Endosperms24,25. Mit der kontinuierlichen Aktualisierung verschiedener Clearing-Mischungen, wie dem Auftauchen der Hoyer-Lösung26, wurden die inneren Strukturen der Gerstenzelle mit einem hohen Grad an Klarheit abgebildet, obwohl ihr Endosperm den Großteil der Samen ausmacht. Die Embryogenese von Zuckerrüben kann durch Reinigung in Kombination mit Vakuumbehandlung und Erweichung mit Salzsäurebeobachtet werden 19. Im Gegensatz zu den oben genannten Arten wurden jedoch keine embryologischen Beobachtungen durch Clearing-Protokolle in Tomatensamen berichtet. Dies verhindert eine detaillierte Untersuchung der Embryonal- und Samenentwicklung von Tomaten.
Chloralhydrat wird üblicherweise als Reinigungslösung verwendet, die es ermöglicht, die eingetauchten Gewebe und Zellen auf verschiedenen optischen Ebenen darzustellen und die Zellen oder Gewebekomponenten im Wesentlichen zu erhalten 27,28,29. Das auf Chloralhydrat basierende Clearing-Protokoll wurde erfolgreich für die gesamte Reinigung von Samen verwendet, um den Embryo und das Endosperm von Arabidopsis21,28 zu beobachten. Diese Clearing-Lösung ist jedoch nicht effizient bei der Reinigung von Tomatensamen, die undurchlässiger sind als Arabidopsis-Samen. Zu den physischen Barrieren gehören: (1) das Tomatenintegument hat fast 20 Zellschichten bei 3 bis 15 DAF 30,31, (2) das Tomatenendosperm ist zellulär, nicht vom Kerntyp 32, und (3) Tomatensamen sind etwa70-mal größer in der Größe33,34 und (4) produzieren große Mengen an Samenmantelschleimstoffen, die das Eindringen von Reinigungsreagenzien blockieren und die Visualisierung von Embryozellen beeinträchtigen.
Daher stellt dieser Bericht eine optimierte Chloralhydrat-basierte Clearing-Methode für die vollständige Reinigung von Tomatensamen in verschiedenen Stadien vor, die eine tiefe Bildgebung des Embryo-Entwicklungsprozesses ermöglicht (Abbildung 2).
Protocol
Representative Results
Discussion
Im Vergleich zum mechanischen Schneiden ist die Clearing-Technologie für die dreidimensionale Bildgebung vorteilhafter, da sie die Integrität von Pflanzengeweben oder Organen bewahrt16. Herkömmliche Clearing-Protokolle sind aufgrund des leichteren Eindringens chemischer Lösungen oft auf kleine Proben beschränkt. Tomatensamen sind eine problematische Probe für die Gewebereinigung, da sie etwa 70-mal größer sind als ein Arabidopsis-Samen und mehr Durchlässigkeitsbarrieren aufweisen…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Autoren danken Dr. Jie Le und Dr. Xiufen Song für ihre hilfreichen Vorschläge zur differentiellen Interferenzkontrastmikroskopie bzw. zur konventionellen Clearing-Methode. Diese Forschung wurde von der National Natural Science Foundation of China (31870299) und der Youth Innovation Promotion Association der Chinesischen Akademie der Wissenschaften finanziert. Abbildung 2 wurde mit BioRender.com erstellt.
Materials
| 1,000 µL pipette | GILSON | FA10006M | |
| 1,000 µL pipette tips | Corning | T-1000-B | |
| 2 ml centrifuge tube | Axygen | MCT-200-C | |
| 37% formaldehyde | DAMAO | 685-2013 | |
| 5,000 µL pipette | Eppendorf | 3120000275 | |
| 5,000 µL pipette tips | biosharp | BS-5000-TL | |
| 50 ml centrifuge tube | Corning | 430829 | |
| Absolute Ethanol | BOYUAN | 678-2002 | |
| Bottle glass | Fisher | FB800-100 | |
| Chloral Hydrate | Meryer | M13315-100G | |
| Coverslip | Leica | 384200 | |
| DIC microscope | Zeiss | Axio Imager A1 | 10x, 20x and 40x magnification |
| Disinfectant | QIKELONGAN | 17-9185 | |
| Dissecting needle | Bioroyee | 17-9140 | |
| Flower nutrient soil | FANGJIE | ||
| Forceps | HAIOU | 4-94 | |
| Glacial Acetic Acid | BOYUAN | 676-2007 | |
| Glycerol | Solarbio | G8190 | |
| Magnetic stirrer | IKA | RET basic | |
| Micro-Tom | Tomato Genetics Resource Center | LA3911 | |
| Orbital shaker | QILINBEIER | QB-206 | |
| Seeding substrate | PINDSTRUP | LV713/018-LV252 | Screening:0-10 mm |
| Single concave slide | HUABODEYI | HBDY1895 | |
| Slide | Leica | 3800381 | |
| Stereomicroscope | Leica | S8 APO | 1x to 4x magnification |
| Tin foil | ZAOWUFANG | 613 | |
| Tween 20 | Sigma | P1379 | |
| Vacuum pump | SHIDING | SHB-III | |
| Vortex meter | Silogex | MX-S |
References
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data/QCL (2022)
- Olmstead, R. G., Bohs, L. A summary of molecular systematic research in Solanaceae: 1982-2006. Acta Horticulturae. 745, 255-268 (2007).
- Consortium, T. G. The tomato genome sequence provides insights into fleshy fruit evolution. Nature. 485 (7400), 635-641 (2012).
- Ebert, A. W., Chou, Y. Y. The tomato collection maintained by AVRDC – The World Vegetable Center: composition, germplasm dissemination and use in breeding. Acta Horticulturae. 1101, 169-176 (2015).
- Hilhorst, H., Groot, S., Bino, R. J. The tomato seed as a model system to study seed development and germination. Acta Botanica Neerlandica. 47, 169-183 (1998).
- Chaban, I. A., Gulevich, A. A., Kononenko, N. V., Khaliluev, M. R., Baranova, E. N. Morphological and structural details of tomato seed coat formation: A different functional role of the inner and outer epidermises in unitegmic ovule. Plants-Basel. 11 (9), 1101 (2022).
- Iwahori, S. High temperature injuries in tomato. V. Fertilization and development of embryo with special reference to the abnormalities caused by high temperature. Journal of The Japanese Society for Horticultural Science. 35 (4), 379-386 (1966).
- Xiao, H., et al. Integration of tomato reproductive developmental landmarks and expression profiles, and the effect of SUN. on fruit shape. BMC Plant Biology. 9 (1), 49 (2009).
- Karssen, C. M., Haigh, A. M., Toorn, P., Weges, R., Taylorson, R. B. Physiological mechanisms involved in seed priming. Recent advances in the development and germination of seeds. NATO ASI Series. 187, (1989).
- Nonogaki, H. Seed dormancy and germination-emerging mechanisms and new hypotheses. Frontiers in Plant Science. 5, 233 (2014).
- Doll, N. M., Ingram, G. C. Embryo-endosperm interactions. Annual Review of Plant Biology. 73, 293-321 (2022).
- Serrani, J. C., Fos, M., Atarés, A., García-Martínez, J. L. Effect of gibberellin and auxin on parthenocarpic fruit growth induction in the cv micro-tom of tomato. Journal of Plant Growth Regulation. 26 (3), 211-221 (2007).
- Yang, C., et al. A regulatory gene induces trichome formation and embryo lethality in tomato. Proceedings of the National Academy of Sciences USA. 108 (29), 11836-11841 (2011).
- Goetz, S., et al. Role of cis-12-oxo-phytodienoic acid in tomato embryo development. Plant Physiology. 158 (4), 1715-1727 (2012).
- Ko, H. Y., Ho, L. H., Neuhaus, H. E., Guo, W. J. Transporter SlSWEET15 unloads sucrose from phloem and seed coat for fruit and seed development in tomato. Plant Physiology. 187 (4), 2230-2245 (2021).
- Richardson, D. S., Lichtman, J. W. Clarifying tissue clearing. Cell. 162 (2), 246-257 (2015).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Kwiatkowska, M., Kadłuczka, D., Wędzony, M., Dedicova, B., Grzebelus, E. Refinement of a clearing protocol to study crassinucellate ovules of the sugar beet (Beta vulgaris L., Amaranthaceae). Plant Methods. 15, 71 (2019).
- Ponitka, A., Ślusarkiewicz-Jarzina, A. Cleared-ovule technique used for rapid access to early embryo development in Secale cereale × Zea mays crosses. Acta Biologica Cracoviensia. Series Botanica. 46, 133-137 (2014).
- Ceccato, L., et al. Maternal control of PIN1 is required for female gametophyte development in Arabidopsis. PLoS One. 8 (6), 66148 (2013).
- Wilkinson, L. G., Tucker, M. R. An optimised clearing protocol for the quantitative assessment of sub-epidermal ovule tissues within whole cereal pistils. Plant Methods. 13, 67 (2017).
- Hedhly, A., Vogler, H., Eichenberger, C., Grossniklaus, U. Whole-mount clearing and staining of Arabidopsis flower organs and Siliques. Journal of Visualized Experiments. (134), e56441 (2018).
- Creff, A., Brocard, L., Ingram, G. A mechanically sensitive cell layer regulates the physical properties of the Arabidopsis seed coat. Nature Communications. 6, 6382 (2015).
- Yang, T., et al. The B3 domain-containing transcription factor ZmABI19 coordinates expression of key factors required for maize seed development and grain filling. Plant Cell. 33 (1), 104-128 (2021).
- Anderson, L. E. Hoyer’s solution as a rapid permanent mounting medium for bryophytes. Bryologist. 57 (3), 242-244 (1954).
- Herr, J. M. A new clearing-squash technique for the study of ovule development in angiosperms. American Journal of Botany. 58 (8), 785-790 (1971).
- Yadegari, R., et al. Cell differentiation and morphogenesis are uncoupled in Arabidopsis raspberry embryos. The Plant Cell. 6 (12), 1713-1729 (1995).
- Grini, P. E., Jurgens, G., Hulskamp, M. Embryo and endosperm development is disrupted in the female gametophytic capulet mutants of Arabidopsis. Genetics. 162 (4), 1911-1925 (2002).
- Kataoka, K., Uemachi, A., Yazawa, S. Fruit growth and pseudoembryo development affected by uniconazole, an inhibitor of gibberellin biosynthesis, in pat-2 and auxin-Induced parthenocarpic tomato fruits. Scientia Horticulturae. 98 (1), 9-16 (2003).
- de Jong, M., Wolters-Arts, M., Feron, R., Mariani, C., Vriezen, W. H. The Solanum lycopersicum auxin response factor 7 (SlARF7) regulates auxin signaling during tomato fruit set and development. Plant Journal. 57 (1), 160-170 (2009).
- Roth, M., Florez-Rueda, A. M., Paris, M., Stadler, T. Wild tomato endosperm transcriptomes reveal common roles of genomic imprinting in both nuclear and cellular endosperm. Plant Journal. 95 (6), 1084-1101 (2018).
- Orsi, C. H., Tanksley, S. D. Natural variation in an ABC transporter gene associated with seed size evolution in tomato species. PLoS Genetics. 5 (1), 1000347 (2009).
- Herridge, R. P., Day, R. C., Baldwin, S., Macknight, R. C. Rapid analysis of seed size in Arabidopsis for mutant and QTL discovery. Plant Methods. 7 (1), 3 (2011).
- Xu, T. T., Ren, S. C., Song, X. F., Liu, C. M. CLE19 expressed in the embryo regulates both cotyledon establishment and endosperm development in Arabidopsis. Journal of Experimental Botany. 66 (17), 5217-5227 (2015).
- Ghadiri Alamdari, N., Salmasi, S., Almasi, H. Tomato seed mucilage as a new source of biodegradable film-forming material: effect of glycerol and cellulose nanofibers on the characteristics of resultant films. Food and Bioprocess Technology. 14 (12), 2380-2400 (2021).
- Gardner, R. O. An overview of botanical clearing technique. Stain Technology. 50 (2), 99-105 (1975).
- Beresniewicz, M. M., Taylor, A. G., Goffinet, M. C., Terhune, B. T. Characterization and location of a semipermeable layer in seed coats of leek and onion (Liliaceae), tomato and pepper (Solanaceae). Seed Science and Technology. 23 (1), 123-134 (1995).
- Stebbins, G. L. A bleaching and clearing method for plant tissues. Science. 87 (2245), 21-22 (1938).
- Debenham, E. M. A modified technique for the microscopic examination of the xylem of whole plants or plant organs. Annals of Botany. 3 (2), 369-373 (1939).
- Morley, T. Accelerated clearing of plant leaves by NaOH in association with oxygen. Stain Technology. 43 (6), 315-319 (1968).

