トマトの種子発育の研究のための効率的な清算プロトコル(Solanum lycopersicum L.)
Summary
トマトの種子は、植物の繁殖中の遺伝学と発生生物学を研究するための重要なモデルです。このプロトコルは、さまざまな発生段階でトマトの種子をきれいにして、より細かい胚構造を観察するのに役立ちます。
Abstract
トマト(Solanum lycopersicum L.)は、世界中の主要な換金作物の1つです。トマトの種子は、植物の繁殖中の遺伝学と発生生物学を研究するための重要なモデルです。トマト種子内のより微細な胚構造の可視化は、種皮粘液、多細胞層外皮、および厚肉胚乳によって妨げられることが多く、これは面倒な埋め込み切片によって解決する必要があります。より簡単な代替案は、化学薬品を使用して種子をほぼ透明にする組織透明化技術を採用することです。従来のクリアリング手順では、より薄い種皮で小さな種子を深く洞察することができますが、トマトの種子のクリアは、特に発育後期段階では、技術的に引き続き困難です。
ここに提示されているのは、胚の形態がほぼ完了する開花後3日から23日までのトマト種子の発達を観察するための迅速で省力化のクリアリングプロトコルです。この方法は、 シロイヌナ ズナで広く用いられている抱水クロラール系清澄液に、ホルマリン-アセト-アルコール(FAA)固定の省略、種子の次亜塩素酸ナトリウム処理の添加、軟化した種皮粘液の除去、洗浄・減圧処理などの改良を加えたものです。この方法は、さまざまな発生段階でトマト種子を効率的に除去するために適用でき、良好な空間分解能で変異種子の発生過程を完全に監視するのに役立ちます。このクリアリングプロトコルは、ナス科の他の商業的に重要な種のディープイメージングにも適用できます。
Introduction
トマト(S. lycopersicum L.)は、世界で最も重要な野菜作物の1つであり、2020年には510万ヘクタールから1億8,680万トンの肉質の果物が生産されています1。ナス、ピーマン、ジャガイモ、タバコなどの多くの商業的に重要な作物を含む、約2,716種2の大きなナス科に属しています。栽培トマトは二倍体種(2n = 2x = 24)で、ゲノムサイズは約900 Mb3です。長い間、野生のナス属から望ましい形質を選択することにより、トマトの家畜化と育種に多大な努力が払われてきました。トマト遺伝学リソースセンターには5,000を超えるトマトのアクセッションがリストされており、世界中で80,000を超えるトマトの生殖質が保管されています4。トマト植物は温室内で多年生であり、種子によって繁殖します。成熟したトマト種子は、完全に成長した胚、残留細胞型胚乳、および硬い種皮の3つの主要な区画で構成されています5,6(図1A)。二重受精後、細胞型胚乳の発生は接合子の発生に先行する。開花後~5~6日(DAF)に、胚乳が6〜8個の核7からなるときに2細胞前胚が最初に観察される。Solanum pimpinellifoliumでは、胚は20 DAF後に最終サイズに近づき、種子は32 DAF8の後に発芽するために生存可能です。胚が成長するにつれて、胚乳は徐々に吸収され、少量の胚乳だけが種子に残ります。残留胚乳は、幼根先端を囲む小毛洞胚乳と、種子の残りの部分の外側胚乳9,10からなる。外側の種皮は、外皮の肥厚して木化した外側表皮から発達し、外皮の残骸の死んだ層とともに、胚と胚乳を保護するために硬い殻を形成します5。
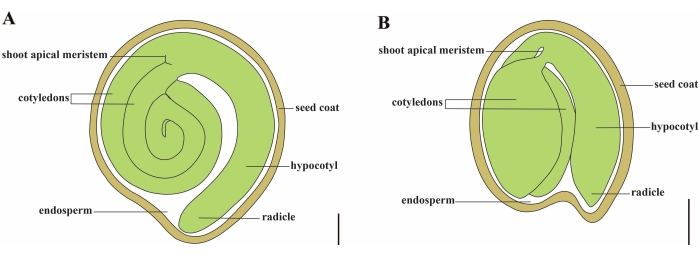
図1:ソラナム・リコペルシカムとシロイヌナズナの成熟種子の模式図。 (A)成熟トマト種子の縦断的解剖学的構造。(B)成熟したシロイヌナズナ種子の縦断的解剖学的構造。成熟したトマトの種子は、シロイヌナズナの種子の約70倍の大きさです。スケールバー = (A) 400 μm、(B) 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。
高品質のトマト種子の生産は、胚、胚乳、および母体の種子成分間の調整に依存します11。種子発生における重要な遺伝子とネットワークを解剖するには、変異種子の深くフルトラックの表現型記録が必要です。半薄切片やパラフィン切片などの従来の包埋切片技術は、胚の局所的で微細な構造を観察するためにトマト種子に広く適用されています12、13、14、15。ただし、薄い切片からシードの発達を分析することは通常面倒であり、z軸の空間分解能が不足しています。それに比べて、組織クリアリングは、発生する可能性が最も高い胚の欠陥の発生段階を特定するための迅速かつ効率的な方法です16。透明化方法は、1つ以上の生化学物質16で屈折率を均質化することによって内部組織の不透明さを低減する。全組織クリアリングは、その完全性を損なうことなく植物組織構造の観察を可能にし、クリアリング技術と3次元イメージングの組み合わせは、植物器官の形態および発生状態に関する情報を得るための理想的なソリューションとなっている17,18。長年にわたり、種子除去技術は、シロイヌナズナ、尋常性ホルデウム、および尋常性ベータ19,20,21,22,23を含む様々な植物種で使用されてきた。これらのうち、ホールマウント胚珠除去技術は、サイズが小さく、種皮細胞の4〜5層、および核型胚乳24,25のために、シロイヌナズナの種子発達を研究するための効率的なアプローチでした。Hoyerの溶液26の出現など、さまざまな透明混合物の継続的な更新により、大麦胚珠の内部構造は、その胚乳が種子の大部分を占めているにもかかわらず、高度な明瞭さで画像化されました。テンサイの胚形成は、減圧処理と塩酸19を組み合わせた透明化によって観察できます。それにもかかわらず、上記の種とは異なり、トマト種子のプロトコルをクリアすることによる発生学的観察は報告されていません。これにより、トマトの胚発生と種子発生の詳細な調査が妨げられます。
抱水クロラールは、浸漬された組織および細胞を異なる光学面上に表示させることを可能にし、細胞または組織成分を実質的に保存する透明化溶液として一般的に使用される27、28、29。抱水クロラールベースのクリアリングプロトコルは、シロイヌナズナの胚と胚乳を観察するための種子のホールマウントクリアリングに使用されています21,28。しかし、この清澄化液は、シロイヌナズナの種子よりも不浸透性であるトマトの種子の除去には効率的ではありません。物理的障壁には、(1)トマトの外皮は3〜15 DAF 30,31で約20の細胞層を有する、(2)トマトの胚乳は核型ではなく細胞型である32、(3)トマト種子のサイズは約70倍大きい33,34、(4)大量の種皮粘液を生成し、透明化試薬の浸透をブロックし、胚細胞の可視化に影響を与える。
そこで本報告では、トマト種子をさまざまな段階で全マウントで除去するための最適化された抱水クロラールベースの透明化方法を提示し、胚発生過程の深部イメージングを可能にします(図2)。
Protocol
Representative Results
Discussion
機械的切片化と比較して、透明化技術は、植物組織または器官の完全性を保持するので、三次元イメージングにとってより有利である16。従来の清澄処理プロトコルは、化学溶液の浸透が容易であるため、小さなサンプルに限定されることがよくあります。トマト種子は、シロイヌナズナの種子の約70倍の大きさで、透過性障壁が高いため、組織透明化に問題のあるサ…
Disclosures
The authors have nothing to disclose.
Acknowledgements
著者らは、微分干渉コントラスト顕微鏡法と従来の透明化法に関する有益な提案をしてくれたJie Le博士とXiufen Song博士に感謝しています。この研究は、中国国家自然科学財団(31870299)と中国科学院青年イノベーション振興協会から資金提供を受けました。図 2 は BioRender.com で作成されました。
Materials
| 1,000 µL pipette | GILSON | FA10006M | |
| 1,000 µL pipette tips | Corning | T-1000-B | |
| 2 ml centrifuge tube | Axygen | MCT-200-C | |
| 37% formaldehyde | DAMAO | 685-2013 | |
| 5,000 µL pipette | Eppendorf | 3120000275 | |
| 5,000 µL pipette tips | biosharp | BS-5000-TL | |
| 50 ml centrifuge tube | Corning | 430829 | |
| Absolute Ethanol | BOYUAN | 678-2002 | |
| Bottle glass | Fisher | FB800-100 | |
| Chloral Hydrate | Meryer | M13315-100G | |
| Coverslip | Leica | 384200 | |
| DIC microscope | Zeiss | Axio Imager A1 | 10x, 20x and 40x magnification |
| Disinfectant | QIKELONGAN | 17-9185 | |
| Dissecting needle | Bioroyee | 17-9140 | |
| Flower nutrient soil | FANGJIE | ||
| Forceps | HAIOU | 4-94 | |
| Glacial Acetic Acid | BOYUAN | 676-2007 | |
| Glycerol | Solarbio | G8190 | |
| Magnetic stirrer | IKA | RET basic | |
| Micro-Tom | Tomato Genetics Resource Center | LA3911 | |
| Orbital shaker | QILINBEIER | QB-206 | |
| Seeding substrate | PINDSTRUP | LV713/018-LV252 | Screening:0-10 mm |
| Single concave slide | HUABODEYI | HBDY1895 | |
| Slide | Leica | 3800381 | |
| Stereomicroscope | Leica | S8 APO | 1x to 4x magnification |
| Tin foil | ZAOWUFANG | 613 | |
| Tween 20 | Sigma | P1379 | |
| Vacuum pump | SHIDING | SHB-III | |
| Vortex meter | Silogex | MX-S |
References
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data/QCL (2022)
- Olmstead, R. G., Bohs, L. A summary of molecular systematic research in Solanaceae: 1982-2006. Acta Horticulturae. 745, 255-268 (2007).
- Consortium, T. G. The tomato genome sequence provides insights into fleshy fruit evolution. Nature. 485 (7400), 635-641 (2012).
- Ebert, A. W., Chou, Y. Y. The tomato collection maintained by AVRDC – The World Vegetable Center: composition, germplasm dissemination and use in breeding. Acta Horticulturae. 1101, 169-176 (2015).
- Hilhorst, H., Groot, S., Bino, R. J. The tomato seed as a model system to study seed development and germination. Acta Botanica Neerlandica. 47, 169-183 (1998).
- Chaban, I. A., Gulevich, A. A., Kononenko, N. V., Khaliluev, M. R., Baranova, E. N. Morphological and structural details of tomato seed coat formation: A different functional role of the inner and outer epidermises in unitegmic ovule. Plants-Basel. 11 (9), 1101 (2022).
- Iwahori, S. High temperature injuries in tomato. V. Fertilization and development of embryo with special reference to the abnormalities caused by high temperature. Journal of The Japanese Society for Horticultural Science. 35 (4), 379-386 (1966).
- Xiao, H., et al. Integration of tomato reproductive developmental landmarks and expression profiles, and the effect of SUN. on fruit shape. BMC Plant Biology. 9 (1), 49 (2009).
- Karssen, C. M., Haigh, A. M., Toorn, P., Weges, R., Taylorson, R. B. Physiological mechanisms involved in seed priming. Recent advances in the development and germination of seeds. NATO ASI Series. 187, (1989).
- Nonogaki, H. Seed dormancy and germination-emerging mechanisms and new hypotheses. Frontiers in Plant Science. 5, 233 (2014).
- Doll, N. M., Ingram, G. C. Embryo-endosperm interactions. Annual Review of Plant Biology. 73, 293-321 (2022).
- Serrani, J. C., Fos, M., Atarés, A., García-Martínez, J. L. Effect of gibberellin and auxin on parthenocarpic fruit growth induction in the cv micro-tom of tomato. Journal of Plant Growth Regulation. 26 (3), 211-221 (2007).
- Yang, C., et al. A regulatory gene induces trichome formation and embryo lethality in tomato. Proceedings of the National Academy of Sciences USA. 108 (29), 11836-11841 (2011).
- Goetz, S., et al. Role of cis-12-oxo-phytodienoic acid in tomato embryo development. Plant Physiology. 158 (4), 1715-1727 (2012).
- Ko, H. Y., Ho, L. H., Neuhaus, H. E., Guo, W. J. Transporter SlSWEET15 unloads sucrose from phloem and seed coat for fruit and seed development in tomato. Plant Physiology. 187 (4), 2230-2245 (2021).
- Richardson, D. S., Lichtman, J. W. Clarifying tissue clearing. Cell. 162 (2), 246-257 (2015).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Kwiatkowska, M., Kadłuczka, D., Wędzony, M., Dedicova, B., Grzebelus, E. Refinement of a clearing protocol to study crassinucellate ovules of the sugar beet (Beta vulgaris L., Amaranthaceae). Plant Methods. 15, 71 (2019).
- Ponitka, A., Ślusarkiewicz-Jarzina, A. Cleared-ovule technique used for rapid access to early embryo development in Secale cereale × Zea mays crosses. Acta Biologica Cracoviensia. Series Botanica. 46, 133-137 (2014).
- Ceccato, L., et al. Maternal control of PIN1 is required for female gametophyte development in Arabidopsis. PLoS One. 8 (6), 66148 (2013).
- Wilkinson, L. G., Tucker, M. R. An optimised clearing protocol for the quantitative assessment of sub-epidermal ovule tissues within whole cereal pistils. Plant Methods. 13, 67 (2017).
- Hedhly, A., Vogler, H., Eichenberger, C., Grossniklaus, U. Whole-mount clearing and staining of Arabidopsis flower organs and Siliques. Journal of Visualized Experiments. (134), e56441 (2018).
- Creff, A., Brocard, L., Ingram, G. A mechanically sensitive cell layer regulates the physical properties of the Arabidopsis seed coat. Nature Communications. 6, 6382 (2015).
- Yang, T., et al. The B3 domain-containing transcription factor ZmABI19 coordinates expression of key factors required for maize seed development and grain filling. Plant Cell. 33 (1), 104-128 (2021).
- Anderson, L. E. Hoyer’s solution as a rapid permanent mounting medium for bryophytes. Bryologist. 57 (3), 242-244 (1954).
- Herr, J. M. A new clearing-squash technique for the study of ovule development in angiosperms. American Journal of Botany. 58 (8), 785-790 (1971).
- Yadegari, R., et al. Cell differentiation and morphogenesis are uncoupled in Arabidopsis raspberry embryos. The Plant Cell. 6 (12), 1713-1729 (1995).
- Grini, P. E., Jurgens, G., Hulskamp, M. Embryo and endosperm development is disrupted in the female gametophytic capulet mutants of Arabidopsis. Genetics. 162 (4), 1911-1925 (2002).
- Kataoka, K., Uemachi, A., Yazawa, S. Fruit growth and pseudoembryo development affected by uniconazole, an inhibitor of gibberellin biosynthesis, in pat-2 and auxin-Induced parthenocarpic tomato fruits. Scientia Horticulturae. 98 (1), 9-16 (2003).
- de Jong, M., Wolters-Arts, M., Feron, R., Mariani, C., Vriezen, W. H. The Solanum lycopersicum auxin response factor 7 (SlARF7) regulates auxin signaling during tomato fruit set and development. Plant Journal. 57 (1), 160-170 (2009).
- Roth, M., Florez-Rueda, A. M., Paris, M., Stadler, T. Wild tomato endosperm transcriptomes reveal common roles of genomic imprinting in both nuclear and cellular endosperm. Plant Journal. 95 (6), 1084-1101 (2018).
- Orsi, C. H., Tanksley, S. D. Natural variation in an ABC transporter gene associated with seed size evolution in tomato species. PLoS Genetics. 5 (1), 1000347 (2009).
- Herridge, R. P., Day, R. C., Baldwin, S., Macknight, R. C. Rapid analysis of seed size in Arabidopsis for mutant and QTL discovery. Plant Methods. 7 (1), 3 (2011).
- Xu, T. T., Ren, S. C., Song, X. F., Liu, C. M. CLE19 expressed in the embryo regulates both cotyledon establishment and endosperm development in Arabidopsis. Journal of Experimental Botany. 66 (17), 5217-5227 (2015).
- Ghadiri Alamdari, N., Salmasi, S., Almasi, H. Tomato seed mucilage as a new source of biodegradable film-forming material: effect of glycerol and cellulose nanofibers on the characteristics of resultant films. Food and Bioprocess Technology. 14 (12), 2380-2400 (2021).
- Gardner, R. O. An overview of botanical clearing technique. Stain Technology. 50 (2), 99-105 (1975).
- Beresniewicz, M. M., Taylor, A. G., Goffinet, M. C., Terhune, B. T. Characterization and location of a semipermeable layer in seed coats of leek and onion (Liliaceae), tomato and pepper (Solanaceae). Seed Science and Technology. 23 (1), 123-134 (1995).
- Stebbins, G. L. A bleaching and clearing method for plant tissues. Science. 87 (2245), 21-22 (1938).
- Debenham, E. M. A modified technique for the microscopic examination of the xylem of whole plants or plant organs. Annals of Botany. 3 (2), 369-373 (1939).
- Morley, T. Accelerated clearing of plant leaves by NaOH in association with oxygen. Stain Technology. 43 (6), 315-319 (1968).

