Эффективный клиринговый протокол для изучения развития семян в томатах (Solanum lycopersicum L.)
Summary
Семена томатов являются важной моделью для изучения генетики и биологии развития во время размножения растений. Этот протокол полезен для очистки семян томатов на разных стадиях развития, чтобы наблюдать более тонкую эмбриональную структуру.
Abstract
Помидор (Solanum lycopersicum L.) является одной из основных товарных культур во всем мире. Семена томатов являются важной моделью для изучения генетики и биологии развития во время размножения растений. Визуализация более тонкой эмбриональной структуры внутри семени томата часто затруднена слизистой оболочкой семян, многоклеточным слоистым покровом и толстостенным эндоспермом, который необходимо устранить трудоемким встраиванием-сечением. Более простой альтернативой является использование методов очистки тканей, которые делают семена почти прозрачными с помощью химических агентов. Хотя обычные процедуры очистки позволяют глубоко проникнуть в более мелкие семена с более тонкой семенной оболочкой, очистка семян томатов по-прежнему является технически сложной задачей, особенно на поздних стадиях развития.
Здесь представлен быстрый и трудосберегающий протокол очистки для наблюдения за развитием семян томатов от 3 до 23 дней после цветения, когда эмбриональная морфология почти завершена. Этот метод сочетает в себе раствор очистки на основе хлоралгидрата, широко используемый в Арабидопсисе , с другими модификациями, включая пропуск фиксации формалин-ацето-спирта (FAA), добавление обработки семян гипохлоритом натрия, удаление размягченной слизи семенной оболочки, а также промывку и вакуумную обработку. Этот метод может быть применен для эффективной очистки семян томатов на разных стадиях развития и полезен при полном мониторинге процесса развития мутантных семян с хорошим пространственным разрешением. Этот протокол очистки может также применяться для глубокой визуализации других коммерчески важных видов в Solanaceae.
Introduction
Томат (S. lycopersicum L.) является одной из важнейших овощных культур во всем мире, с объемом производства 186,8 млн. тонн мясистых фруктов с 5,1 млн. га в 2020 году1. Он принадлежит к большому семейству пасленовых, насчитывающему около 2 716 видов2, включая многие коммерчески важные культуры, такие как баклажаны, перец, картофель и табак. Культивируемый помидор является диплоидным видом (2n = 2x = 24) с размером генома около 900 Mb3. В течение долгого времени были приложены большие усилия для одомашнивания и селекции томатов путем отбора желаемых признаков из дикого Solanum spp. В Центре генетических ресурсов томатов зарегистрировано более 5000 томатов, и во всем мире хранится более 80 000 зародышевой плазмы помидоров4. Растение томат является многолетним в теплице и размножается семенами. Зрелое семя томата состоит из трех основных отсеков: полноценного эмбриона, остаточного эндосперма клеточного типа и твердой семенной оболочки 5,6 (рисунок 1А). После двойного оплодотворения развитию эндосперма клеточного типа предшествует развитие зигот. Через ~5-6 дней после цветения (DAF) впервые наблюдается двухклеточное проэмбрио, когда эндосперм состоит из шести-восьми ядер7. В Solanum pimpinellifolium эмбрион приближается к своему окончательному размеру после 20 DAF, а семена жизнеспособны для прорастания после 32 DAF8. По мере развития эмбриона эндосперм постепенно всасывается и в семени остается лишь небольшое количество эндосперма. Остаточный эндосперм состоит из микропирлярного эндосперма, окружающего кончик радика, и бокового эндосперма в остальной части семени 9,10. Наружная семенная оболочка развивается из утолщенного и одревесного наружного эпидермиса покрова, а с отмершими слоями остатков покрова они образуют твердую оболочку для защиты эмбриона и эндосперма5.
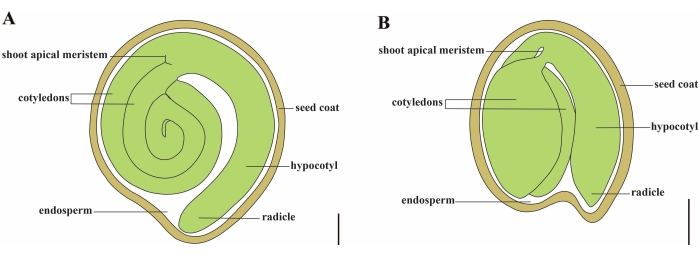
Рисунок 1: Схематическое изображение зрелого семени у Solanum lycopersicum и Arabidopsis thaliana. (A) Продольная анатомия зрелого семени томата. (B) Продольная анатомия зрелого семени Arabidopsis . Зрелое семя помидора примерно в 70 раз больше по размеру, чем семя арабидопсиса . Шкала = (A) 400 мкм, (B) 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Производство высококачественных семян томатов зависит от координации между компонентами эмбриона, эндосперма и материнского семенного компонента11. Препарирование ключевых генов и сетей в развитии семян требует глубокой и полной фенотипической регистрации мутантных семян. Традиционные методы встраивания-сечения, такие как полутонкое сечение и парафиновое сечение, широко применяются к семенам томатов для наблюдения за местными и более тонкими структурами эмбриона 12,13,14,15. Однако анализ развития семян из тонких участков обычно трудоемкий и не имеет пространственного разрешения по оси Z. Для сравнения, очистка тканей является быстрым и эффективным методом для точного определения стадии развития дефектов эмбриона, которые, скорее всего, произойдут16. Способ очистки уменьшает непрозрачность внутренней ткани путем гомогенизации показателя преломления одним или несколькими биохимическими агентами16. Очистка всей ткани позволяет наблюдать структуру растительной ткани, не разрушая ее целостность, а сочетание технологии очистки и трехмерной визуализации стало идеальным решением для получения информации о морфологии и состоянии развития растительного органа17,18. На протяжении многих лет методы очистки семян использовались у различных видов растений, включая Arabidopsis thaliana, Hordeum vulgare и Beta vulgaris 19,20,21,22,23. Среди них технология очистки яйцеклеток с цельной горой была эффективным подходом к изучению развития семян Arabidopsis, благодаря его небольшому размеру, 4-5 слоям клетки семенной оболочки и эндосперму ядерного типа24,25. При постоянном обновлении различных очищающих смесей, таких как появление раствораХойера 26, внутренние структуры яйцеклетки ячменя были изображены с высокой степенью прозрачности, хотя ее эндосперм составляет основную часть семян. Эмбриогенез сахарной свеклы можно наблюдать путем очистки в сочетании с вакуумной обработкой и размягчения соляной кислотой19. Тем не менее, в отличие от видов, упомянутых выше, об эмбриологических наблюдениях путем очистки протоколов в семенах томатов не сообщалось. Это препятствует детальному исследованию эмбрионального и семенного развития томатов.
Хлоралгидрат обычно используется в качестве очищающего раствора, который позволяет погружаться тканям и клеткам отображаться на различных оптических плоскостях и по существу сохраняет клетки или тканевые компоненты 27,28,29. Протокол очистки на основе хлоралгидрата был успешно использован для очистки семян по всей установке для наблюдения за зародышем и эндоспермом Arabidopsis 21,28. Однако этот очистительный раствор не эффективен при очистке семян томатов, которые более непроницаемы, чем семена арабидопсиса. Физические барьеры включают: (1) кожный покров томата имеет почти 20 клеточных слоев при 3-15 DAF30,31, (2) эндосперм томата клеточного типа, а не ядерного типа32, и (3) семена томатов примерно в 70 раз больше поразмеру 33,34 и (4) производят большое количество слизи семенной оболочки, что блокирует проникновение очищающих реагентов и влияет на визуализацию эмбриональных клеток.
Таким образом, в настоящем отчете представлен оптимизированный метод очистки на основе хлоралгидрата для полной очистки семян томатов на разных стадиях, который позволяет глубоко визуализировать процесс развития эмбриона (рисунок 2).
Protocol
Representative Results
Discussion
По сравнению с механическим сечением, технология очистки более выгодна для трехмерной визуализации, поскольку она сохраняет целостность растительных тканей или органов16. Обычные протоколы очистки часто ограничиваются небольшими образцами из-за более легкого проникнове…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Авторы благодарны доктору Цзе Ле и доктору Сюфэнь Сун за их полезные предложения по дифференциальной интерференционной контрастной микроскопии и традиционному методу очистки соответственно. Это исследование финансировалось Национальным фондом естественных наук Китая (31870299) и Ассоциацией содействия инновациям молодежи Китайской академии наук. Рисунок 2 был создан с помощью BioRender.com.
Materials
| 1,000 µL pipette | GILSON | FA10006M | |
| 1,000 µL pipette tips | Corning | T-1000-B | |
| 2 ml centrifuge tube | Axygen | MCT-200-C | |
| 37% formaldehyde | DAMAO | 685-2013 | |
| 5,000 µL pipette | Eppendorf | 3120000275 | |
| 5,000 µL pipette tips | biosharp | BS-5000-TL | |
| 50 ml centrifuge tube | Corning | 430829 | |
| Absolute Ethanol | BOYUAN | 678-2002 | |
| Bottle glass | Fisher | FB800-100 | |
| Chloral Hydrate | Meryer | M13315-100G | |
| Coverslip | Leica | 384200 | |
| DIC microscope | Zeiss | Axio Imager A1 | 10x, 20x and 40x magnification |
| Disinfectant | QIKELONGAN | 17-9185 | |
| Dissecting needle | Bioroyee | 17-9140 | |
| Flower nutrient soil | FANGJIE | ||
| Forceps | HAIOU | 4-94 | |
| Glacial Acetic Acid | BOYUAN | 676-2007 | |
| Glycerol | Solarbio | G8190 | |
| Magnetic stirrer | IKA | RET basic | |
| Micro-Tom | Tomato Genetics Resource Center | LA3911 | |
| Orbital shaker | QILINBEIER | QB-206 | |
| Seeding substrate | PINDSTRUP | LV713/018-LV252 | Screening:0-10 mm |
| Single concave slide | HUABODEYI | HBDY1895 | |
| Slide | Leica | 3800381 | |
| Stereomicroscope | Leica | S8 APO | 1x to 4x magnification |
| Tin foil | ZAOWUFANG | 613 | |
| Tween 20 | Sigma | P1379 | |
| Vacuum pump | SHIDING | SHB-III | |
| Vortex meter | Silogex | MX-S |
References
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data/QCL (2022)
- Olmstead, R. G., Bohs, L. A summary of molecular systematic research in Solanaceae: 1982-2006. Acta Horticulturae. 745, 255-268 (2007).
- Consortium, T. G. The tomato genome sequence provides insights into fleshy fruit evolution. Nature. 485 (7400), 635-641 (2012).
- Ebert, A. W., Chou, Y. Y. The tomato collection maintained by AVRDC – The World Vegetable Center: composition, germplasm dissemination and use in breeding. Acta Horticulturae. 1101, 169-176 (2015).
- Hilhorst, H., Groot, S., Bino, R. J. The tomato seed as a model system to study seed development and germination. Acta Botanica Neerlandica. 47, 169-183 (1998).
- Chaban, I. A., Gulevich, A. A., Kononenko, N. V., Khaliluev, M. R., Baranova, E. N. Morphological and structural details of tomato seed coat formation: A different functional role of the inner and outer epidermises in unitegmic ovule. Plants-Basel. 11 (9), 1101 (2022).
- Iwahori, S. High temperature injuries in tomato. V. Fertilization and development of embryo with special reference to the abnormalities caused by high temperature. Journal of The Japanese Society for Horticultural Science. 35 (4), 379-386 (1966).
- Xiao, H., et al. Integration of tomato reproductive developmental landmarks and expression profiles, and the effect of SUN. on fruit shape. BMC Plant Biology. 9 (1), 49 (2009).
- Karssen, C. M., Haigh, A. M., Toorn, P., Weges, R., Taylorson, R. B. Physiological mechanisms involved in seed priming. Recent advances in the development and germination of seeds. NATO ASI Series. 187, (1989).
- Nonogaki, H. Seed dormancy and germination-emerging mechanisms and new hypotheses. Frontiers in Plant Science. 5, 233 (2014).
- Doll, N. M., Ingram, G. C. Embryo-endosperm interactions. Annual Review of Plant Biology. 73, 293-321 (2022).
- Serrani, J. C., Fos, M., Atarés, A., García-Martínez, J. L. Effect of gibberellin and auxin on parthenocarpic fruit growth induction in the cv micro-tom of tomato. Journal of Plant Growth Regulation. 26 (3), 211-221 (2007).
- Yang, C., et al. A regulatory gene induces trichome formation and embryo lethality in tomato. Proceedings of the National Academy of Sciences USA. 108 (29), 11836-11841 (2011).
- Goetz, S., et al. Role of cis-12-oxo-phytodienoic acid in tomato embryo development. Plant Physiology. 158 (4), 1715-1727 (2012).
- Ko, H. Y., Ho, L. H., Neuhaus, H. E., Guo, W. J. Transporter SlSWEET15 unloads sucrose from phloem and seed coat for fruit and seed development in tomato. Plant Physiology. 187 (4), 2230-2245 (2021).
- Richardson, D. S., Lichtman, J. W. Clarifying tissue clearing. Cell. 162 (2), 246-257 (2015).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Kwiatkowska, M., Kadłuczka, D., Wędzony, M., Dedicova, B., Grzebelus, E. Refinement of a clearing protocol to study crassinucellate ovules of the sugar beet (Beta vulgaris L., Amaranthaceae). Plant Methods. 15, 71 (2019).
- Ponitka, A., Ślusarkiewicz-Jarzina, A. Cleared-ovule technique used for rapid access to early embryo development in Secale cereale × Zea mays crosses. Acta Biologica Cracoviensia. Series Botanica. 46, 133-137 (2014).
- Ceccato, L., et al. Maternal control of PIN1 is required for female gametophyte development in Arabidopsis. PLoS One. 8 (6), 66148 (2013).
- Wilkinson, L. G., Tucker, M. R. An optimised clearing protocol for the quantitative assessment of sub-epidermal ovule tissues within whole cereal pistils. Plant Methods. 13, 67 (2017).
- Hedhly, A., Vogler, H., Eichenberger, C., Grossniklaus, U. Whole-mount clearing and staining of Arabidopsis flower organs and Siliques. Journal of Visualized Experiments. (134), e56441 (2018).
- Creff, A., Brocard, L., Ingram, G. A mechanically sensitive cell layer regulates the physical properties of the Arabidopsis seed coat. Nature Communications. 6, 6382 (2015).
- Yang, T., et al. The B3 domain-containing transcription factor ZmABI19 coordinates expression of key factors required for maize seed development and grain filling. Plant Cell. 33 (1), 104-128 (2021).
- Anderson, L. E. Hoyer’s solution as a rapid permanent mounting medium for bryophytes. Bryologist. 57 (3), 242-244 (1954).
- Herr, J. M. A new clearing-squash technique for the study of ovule development in angiosperms. American Journal of Botany. 58 (8), 785-790 (1971).
- Yadegari, R., et al. Cell differentiation and morphogenesis are uncoupled in Arabidopsis raspberry embryos. The Plant Cell. 6 (12), 1713-1729 (1995).
- Grini, P. E., Jurgens, G., Hulskamp, M. Embryo and endosperm development is disrupted in the female gametophytic capulet mutants of Arabidopsis. Genetics. 162 (4), 1911-1925 (2002).
- Kataoka, K., Uemachi, A., Yazawa, S. Fruit growth and pseudoembryo development affected by uniconazole, an inhibitor of gibberellin biosynthesis, in pat-2 and auxin-Induced parthenocarpic tomato fruits. Scientia Horticulturae. 98 (1), 9-16 (2003).
- de Jong, M., Wolters-Arts, M., Feron, R., Mariani, C., Vriezen, W. H. The Solanum lycopersicum auxin response factor 7 (SlARF7) regulates auxin signaling during tomato fruit set and development. Plant Journal. 57 (1), 160-170 (2009).
- Roth, M., Florez-Rueda, A. M., Paris, M., Stadler, T. Wild tomato endosperm transcriptomes reveal common roles of genomic imprinting in both nuclear and cellular endosperm. Plant Journal. 95 (6), 1084-1101 (2018).
- Orsi, C. H., Tanksley, S. D. Natural variation in an ABC transporter gene associated with seed size evolution in tomato species. PLoS Genetics. 5 (1), 1000347 (2009).
- Herridge, R. P., Day, R. C., Baldwin, S., Macknight, R. C. Rapid analysis of seed size in Arabidopsis for mutant and QTL discovery. Plant Methods. 7 (1), 3 (2011).
- Xu, T. T., Ren, S. C., Song, X. F., Liu, C. M. CLE19 expressed in the embryo regulates both cotyledon establishment and endosperm development in Arabidopsis. Journal of Experimental Botany. 66 (17), 5217-5227 (2015).
- Ghadiri Alamdari, N., Salmasi, S., Almasi, H. Tomato seed mucilage as a new source of biodegradable film-forming material: effect of glycerol and cellulose nanofibers on the characteristics of resultant films. Food and Bioprocess Technology. 14 (12), 2380-2400 (2021).
- Gardner, R. O. An overview of botanical clearing technique. Stain Technology. 50 (2), 99-105 (1975).
- Beresniewicz, M. M., Taylor, A. G., Goffinet, M. C., Terhune, B. T. Characterization and location of a semipermeable layer in seed coats of leek and onion (Liliaceae), tomato and pepper (Solanaceae). Seed Science and Technology. 23 (1), 123-134 (1995).
- Stebbins, G. L. A bleaching and clearing method for plant tissues. Science. 87 (2245), 21-22 (1938).
- Debenham, E. M. A modified technique for the microscopic examination of the xylem of whole plants or plant organs. Annals of Botany. 3 (2), 369-373 (1939).
- Morley, T. Accelerated clearing of plant leaves by NaOH in association with oxygen. Stain Technology. 43 (6), 315-319 (1968).

