टमाटर में बीज विकास के अध्ययन के लिए एक कुशल समाशोधन प्रोटोकॉल (सोलनम लाइकोपर्सिकम एल।
Summary
टमाटर का बीज पौधे के प्रजनन के दौरान आनुवंशिकी और विकासात्मक जीव विज्ञान का अध्ययन करने के लिए एक महत्वपूर्ण मॉडल है। यह प्रोटोकॉल बेहतर भ्रूण संरचना का निरीक्षण करने के लिए विभिन्न विकास चरणों में टमाटर के बीज को साफ करने के लिए उपयोगी है।
Abstract
टमाटर (सोलनम लाइकोपर्सिकम एल) दुनिया भर में प्रमुख नकदी फसलों में से एक है। टमाटर का बीज पौधे के प्रजनन के दौरान आनुवंशिकी और विकासात्मक जीव विज्ञान का अध्ययन करने के लिए एक महत्वपूर्ण मॉडल है। टमाटर के बीज के भीतर महीन भ्रूण संरचना का विज़ुअलाइज़ेशन अक्सर बीज कोट म्यूसिलेज, मल्टी-सेल-लेयर्ड इंटेगुमेंट और एक मोटी दीवार वाले एंडोस्पर्म द्वारा बाधित होता है, जिसे श्रमसाध्य एम्बेडिंग-सेक्शनिंग द्वारा हल करने की आवश्यकता होती है। एक सरल विकल्प ऊतक समाशोधन तकनीकों को नियोजित करना है जो रासायनिक एजेंटों का उपयोग करके बीज को लगभग पारदर्शी बनाते हैं। यद्यपि पारंपरिक समाशोधन प्रक्रियाएं पतले बीज कोट के साथ छोटे बीजों में गहरी अंतर्दृष्टि की अनुमति देती हैं, टमाटर के बीज को साफ करना तकनीकी रूप से चुनौतीपूर्ण बना हुआ है, खासकर देर से विकास के चरणों में।
यहां प्रस्तुत एक तेजी से और श्रम-बचत समाशोधन प्रोटोकॉल है जो फूल आने के 3 से 23 दिनों बाद टमाटर के बीज के विकास का निरीक्षण करता है जब भ्रूण आकृति विज्ञान लगभग पूरा हो जाता है। यह विधि एराबिडोप्सिस में व्यापक रूप से उपयोग किए जाने वाले क्लोरल हाइड्रेट-आधारित समाशोधन समाधान को अन्य संशोधनों के साथ जोड़ती है, जिसमें फॉर्मलिन-एसिटो-अल्कोहल (एफएए) निर्धारण, बीजों के सोडियम हाइपोक्लोराइट उपचार को जोड़ना, नरम बीज कोट म्यूसिलेज को हटाना और धोने और वैक्यूम उपचार शामिल हैं। इस विधि को विभिन्न विकास चरणों में टमाटर के बीजों के कुशल समाशोधन के लिए लागू किया जा सकता है और अच्छे स्थानिक संकल्प के साथ उत्परिवर्ती बीजों की विकास प्रक्रिया की पूर्ण निगरानी में उपयोगी है। इस समाशोधन प्रोटोकॉल को सोलानासी में अन्य व्यावसायिक रूप से महत्वपूर्ण प्रजातियों की गहरी इमेजिंग पर भी लागू किया जा सकता है।
Introduction
टमाटर (एस लाइकोपर्सिकम एल) दुनिया भर में सबसे महत्वपूर्ण सब्जी फसलों में से एक है, जिसमें 2020 में 5.1 मिलियन हेक्टेयर से 186.8 मिलियन टन मांसल फलों का उत्पादन होता है। यह लगभग 2,716 प्रजातियों2 के साथ बड़े सोलानासी परिवार से संबंधित है, जिसमें बैंगन, मिर्च, आलू और तंबाकू जैसी कई व्यावसायिक रूप से महत्वपूर्ण फसलें शामिल हैं। खेती की गई टमाटर एक द्विगुणित प्रजाति (2n = 2x = 24) है जिसका जीनोम आकार लगभग 900 Mb3 है। लंबे समय से, जंगली सोलनम एसपीपी से वांछनीय लक्षणों का चयन करके टमाटर को पालतू बनाने और प्रजनन की दिशा में बहुत प्रयास किया गया है। टमाटर जेनेटिक्स रिसोर्स सेंटर में 5,000 से अधिक टमाटर परिग्रहण सूचीबद्ध हैंऔर टमाटर के 80,000 से अधिक जर्मप्लाज्म दुनिया भर में संग्रहीत हैं। टमाटर का पौधा ग्रीनहाउस में बारहमासी होता है और बीजों द्वारा फैलता है। एक परिपक्व टमाटर के बीज में तीन प्रमुख डिब्बे होते हैं: एक पूर्ण विकसित भ्रूण, अवशिष्ट सेलुलर-प्रकार एंडोस्पर्म, और एक कठोर बीज कोट 5,6 (चित्रा 1 ए)। दोहरे निषेचन के बाद, सेलुलर-प्रकार के एंडोस्पर्म का विकास युग्मनज के विकास से पहले होता है। फूल (डीएएफ) के ~ 5-6 दिनों के बाद, दो-कोशिका वाले प्रोम्ब्रायो को पहली बार देखा जाता है जब एंडोस्पर्म में छह से आठ नाभिकहोते हैं। सोलनम पिंपिनेलिफोलियम में, भ्रूण 20 डीएएफ के बाद अपने अंतिम आकार तक पहुंचता है, और बीज 32 डीएएफ 8 के बाद अंकुरण के लिए व्यवहार्यहोते हैं। जैसे-जैसे भ्रूण विकसित होता है, एंडोस्पर्म धीरे-धीरे अवशोषित हो जाता है और बीज में एंडोस्पर्म की केवल थोड़ी मात्रा रह जाती है। अवशिष्ट एंडोस्पर्म में रेडियल टिप के आसपास माइक्रोपाइलर एंडोस्पर्म और शेष बीज 9,10 में पार्श्व एंडोस्पर्म होते हैं। बाहरी बीज कोट को इन्टेगुमेंट के मोटे और लिग्निफाइड बाहरी एपिडर्मिस से विकसित किया जाता है, और इन्टेगुमेंट अवशेषों की मृत परतों के साथ, वे भ्रूण और एंडोस्पर्म5 की रक्षा के लिए एक कठोर खोल बनाते हैं।
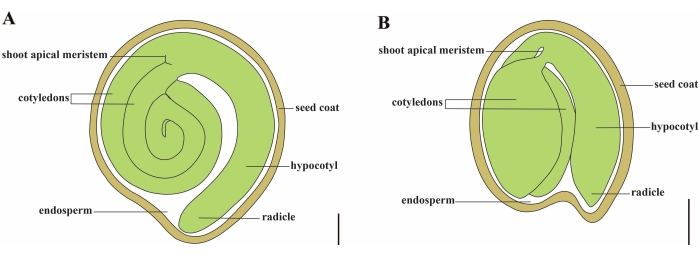
चित्र 1: सोलनम लाइकोपर्सिकम और एराबिडोप्सिस थैलियाना में एक परिपक्व बीज का योजनाबद्ध प्रतिनिधित्व। (ए) एक परिपक्व टमाटर के बीज की अनुदैर्ध्य शारीरिक रचना। (बी) एक परिपक्व एराबिडोप्सिस बीज की अनुदैर्ध्य शारीरिक रचना। एक परिपक्व टमाटर का बीज एराबिडोप्सिस बीज की तुलना में आकार में लगभग 70 गुना बड़ा होता है। स्केल पट्टियाँ = (A) 400 μm, (B) 100 μm. कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें.
उच्च गुणवत्ता वाले टमाटर के बीज का उत्पादन भ्रूण, एंडोस्पर्म और मातृ बीज घटकों के बीच समन्वय पर निर्भर करताहै। बीज विकास में प्रमुख जीन और नेटवर्क को विच्छेदित करने के लिए उत्परिवर्ती बीजों की गहरी और पूर्ण-ट्रैक फेनोटाइपिक रिकॉर्डिंग की आवश्यकता होती है। पारंपरिक एम्बेडिंग-सेक्शनिंग तकनीक, जैसे अर्ध-पतले खंड और पैराफिन अनुभाग, भ्रूण 12,13,14,15 की स्थानीय और महीन संरचनाओं का निरीक्षण करने के लिए टमाटर के बीज पर व्यापक रूप से लागू होते हैं। हालांकि, पतले वर्गों से बीज विकास का विश्लेषण करना आमतौर पर श्रमसाध्य होता है और जेड-अक्ष स्थानिक संकल्प का अभाव होता है। इसकी तुलना में, ऊतक समाशोधन भ्रूण दोषों के विकास चरण को इंगित करने के लिए एक तेज़ और कुशल तरीका हैजो होने की सबसे अधिक संभावना है। समाशोधन विधि एक या अधिक जैव रासायनिक एजेंटों के साथ अपवर्तक सूचकांक को समरूप करके आंतरिक ऊतक की अपारदर्शिता को कम करतीहै। संपूर्ण ऊतक समाशोधन इसकी अखंडता को नष्ट किए बिना एक पौधे के ऊतक संरचना के अवलोकन की अनुमति देता है, और समाशोधन तकनीक और त्रि-आयामी इमेजिंग का संयोजन एक पौधे के अंग17,18 की आकृति विज्ञान और विकासात्मक स्थिति पर जानकारी प्राप्त करने के लिए एक आदर्श समाधान बन गया है। वर्षों से, विभिन्न पौधों की प्रजातियों में बीज समाशोधन तकनीकों का उपयोग किया गया है, जिसमें एराबिडोप्सिस थैलियाना, होर्डियम वल्गर और बीटा वल्गरिस19,20,21,22,23 शामिल हैं। इनमें से, होल-माउंट डिंब समाशोधन तकनीक एराबिडोप्सिस के बीज विकास का अध्ययन करने के लिए एक कुशल दृष्टिकोण रही है, इसके छोटे आकार, बीज कोट सेल की 4-5 परतों और परमाणु-प्रकार एंडोस्पर्म24,25 के कारण। विभिन्न समाशोधन मिश्रणों के निरंतर अद्यतन के साथ, जैसे कि होयर के समाधान26 के उद्भव के साथ, जौ के अंडाणु की आंतरिक संरचनाओं को उच्च स्तर की स्पष्टता के साथ चित्रित किया गया था, हालांकि इसके एंडोस्पर्म बीज का बड़ा हिस्सा बनाते हैं। चीनी बीट के भ्रूणजनन को वैक्यूम उपचार के साथ संयुक्त रूप से साफ़ करके और हाइड्रोक्लोरिक एसिड19 के साथ नरम करके देखा जा सकता है। बहरहाल, ऊपर उल्लिखित प्रजातियों के विपरीत, टमाटर के बीज में प्रोटोकॉल को साफ़ करके भ्रूण संबंधी अवलोकनों की सूचना नहीं दी गई है। यह टमाटर के भ्रूण और बीज विकास में विस्तृत जांच को रोकता है।
क्लोरल हाइड्रेट का उपयोग आमतौर पर एक समाशोधन समाधान के रूप में किया जाता है जो डूबे हुए ऊतकों और कोशिकाओं को विभिन्न ऑप्टिकल विमानों पर प्रदर्शित करने की अनुमति देता है, और कोशिकाओं या ऊतक घटकों 27,28,29 को काफी हद तक संरक्षित करता है। एराबिडोप्सिस21,28 के भ्रूण और एंडोस्पर्म का निरीक्षण करने के लिए बीजों के पूरे माउंट क्लियरिंग के लिए क्लोरल हाइड्रेट-आधारित क्लियरिंग प्रोटोकॉल का सफलतापूर्वक उपयोग किया गया है। हालांकि, यह समाशोधन समाधान टमाटर के बीज को साफ करने में कुशल नहीं है, जो एराबिडोप्सिस बीजों की तुलना में अधिक अभेद्य हैं। भौतिक बाधाओं में शामिल हैं: (1) टमाटर के आंत में 3 से 15 डीएएफ 30,31 पर लगभग20 सेल परतें होती हैं, (2) टमाटर एंडोस्पर्म सेलुलर-प्रकार होता है, परमाणु-प्रकार32 नहीं, और (3) टमाटर के बीज आकार में लगभग 70 गुना बड़ेहोते हैं 33,34 और (4) बड़ी मात्रा में बीज कोट म्यूसिलेज का उत्पादन करते हैं, जो समाशोधन अभिकर्मकों के प्रवेश को अवरुद्ध करता है और भ्रूण कोशिकाओं के दृश्य को प्रभावित करता है।
इसलिए, यह रिपोर्ट विभिन्न चरणों में टमाटर के बीज के पूरे माउंट क्लियरिंग के लिए एक अनुकूलित क्लोरल हाइड्रेट-आधारित समाशोधन विधि प्रस्तुत करती है, जो भ्रूण विकास प्रक्रिया की गहरी इमेजिंग की अनुमति देती है (चित्रा 2)।
Protocol
Representative Results
Discussion
यांत्रिक सेक्शनिंग की तुलना में, समाशोधन तकनीक त्रि-आयामी इमेजिंग के लिए अधिक फायदेमंद है क्योंकि यह पौधे के ऊतकों या अंगों की अखंडता को बरकरार रखतीहै। रासायनिक समाधानों के आसान प्रवेश के का…
Disclosures
The authors have nothing to disclose.
Acknowledgements
लेखक क्रमशः अंतर हस्तक्षेप कंट्रास्ट माइक्रोस्कोपी और पारंपरिक समाशोधन विधि पर उनके उपयोगी सुझावों के लिए डॉ जी ले और डॉ जियूफेन सोंग के आभारी हैं। इस शोध को चीन के राष्ट्रीय प्राकृतिक विज्ञान फाउंडेशन (31870299) और चीनी विज्ञान अकादमी के युवा नवाचार संवर्धन संघ द्वारा वित्तपोषित किया गया था। चित्र 2 BioRender.com के साथ बनाया गया था।
Materials
| 1,000 µL pipette | GILSON | FA10006M | |
| 1,000 µL pipette tips | Corning | T-1000-B | |
| 2 ml centrifuge tube | Axygen | MCT-200-C | |
| 37% formaldehyde | DAMAO | 685-2013 | |
| 5,000 µL pipette | Eppendorf | 3120000275 | |
| 5,000 µL pipette tips | biosharp | BS-5000-TL | |
| 50 ml centrifuge tube | Corning | 430829 | |
| Absolute Ethanol | BOYUAN | 678-2002 | |
| Bottle glass | Fisher | FB800-100 | |
| Chloral Hydrate | Meryer | M13315-100G | |
| Coverslip | Leica | 384200 | |
| DIC microscope | Zeiss | Axio Imager A1 | 10x, 20x and 40x magnification |
| Disinfectant | QIKELONGAN | 17-9185 | |
| Dissecting needle | Bioroyee | 17-9140 | |
| Flower nutrient soil | FANGJIE | ||
| Forceps | HAIOU | 4-94 | |
| Glacial Acetic Acid | BOYUAN | 676-2007 | |
| Glycerol | Solarbio | G8190 | |
| Magnetic stirrer | IKA | RET basic | |
| Micro-Tom | Tomato Genetics Resource Center | LA3911 | |
| Orbital shaker | QILINBEIER | QB-206 | |
| Seeding substrate | PINDSTRUP | LV713/018-LV252 | Screening:0-10 mm |
| Single concave slide | HUABODEYI | HBDY1895 | |
| Slide | Leica | 3800381 | |
| Stereomicroscope | Leica | S8 APO | 1x to 4x magnification |
| Tin foil | ZAOWUFANG | 613 | |
| Tween 20 | Sigma | P1379 | |
| Vacuum pump | SHIDING | SHB-III | |
| Vortex meter | Silogex | MX-S |
References
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data/QCL (2022)
- Olmstead, R. G., Bohs, L. A summary of molecular systematic research in Solanaceae: 1982-2006. Acta Horticulturae. 745, 255-268 (2007).
- Consortium, T. G. The tomato genome sequence provides insights into fleshy fruit evolution. Nature. 485 (7400), 635-641 (2012).
- Ebert, A. W., Chou, Y. Y. The tomato collection maintained by AVRDC – The World Vegetable Center: composition, germplasm dissemination and use in breeding. Acta Horticulturae. 1101, 169-176 (2015).
- Hilhorst, H., Groot, S., Bino, R. J. The tomato seed as a model system to study seed development and germination. Acta Botanica Neerlandica. 47, 169-183 (1998).
- Chaban, I. A., Gulevich, A. A., Kononenko, N. V., Khaliluev, M. R., Baranova, E. N. Morphological and structural details of tomato seed coat formation: A different functional role of the inner and outer epidermises in unitegmic ovule. Plants-Basel. 11 (9), 1101 (2022).
- Iwahori, S. High temperature injuries in tomato. V. Fertilization and development of embryo with special reference to the abnormalities caused by high temperature. Journal of The Japanese Society for Horticultural Science. 35 (4), 379-386 (1966).
- Xiao, H., et al. Integration of tomato reproductive developmental landmarks and expression profiles, and the effect of SUN. on fruit shape. BMC Plant Biology. 9 (1), 49 (2009).
- Karssen, C. M., Haigh, A. M., Toorn, P., Weges, R., Taylorson, R. B. Physiological mechanisms involved in seed priming. Recent advances in the development and germination of seeds. NATO ASI Series. 187, (1989).
- Nonogaki, H. Seed dormancy and germination-emerging mechanisms and new hypotheses. Frontiers in Plant Science. 5, 233 (2014).
- Doll, N. M., Ingram, G. C. Embryo-endosperm interactions. Annual Review of Plant Biology. 73, 293-321 (2022).
- Serrani, J. C., Fos, M., Atarés, A., García-Martínez, J. L. Effect of gibberellin and auxin on parthenocarpic fruit growth induction in the cv micro-tom of tomato. Journal of Plant Growth Regulation. 26 (3), 211-221 (2007).
- Yang, C., et al. A regulatory gene induces trichome formation and embryo lethality in tomato. Proceedings of the National Academy of Sciences USA. 108 (29), 11836-11841 (2011).
- Goetz, S., et al. Role of cis-12-oxo-phytodienoic acid in tomato embryo development. Plant Physiology. 158 (4), 1715-1727 (2012).
- Ko, H. Y., Ho, L. H., Neuhaus, H. E., Guo, W. J. Transporter SlSWEET15 unloads sucrose from phloem and seed coat for fruit and seed development in tomato. Plant Physiology. 187 (4), 2230-2245 (2021).
- Richardson, D. S., Lichtman, J. W. Clarifying tissue clearing. Cell. 162 (2), 246-257 (2015).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Kwiatkowska, M., Kadłuczka, D., Wędzony, M., Dedicova, B., Grzebelus, E. Refinement of a clearing protocol to study crassinucellate ovules of the sugar beet (Beta vulgaris L., Amaranthaceae). Plant Methods. 15, 71 (2019).
- Ponitka, A., Ślusarkiewicz-Jarzina, A. Cleared-ovule technique used for rapid access to early embryo development in Secale cereale × Zea mays crosses. Acta Biologica Cracoviensia. Series Botanica. 46, 133-137 (2014).
- Ceccato, L., et al. Maternal control of PIN1 is required for female gametophyte development in Arabidopsis. PLoS One. 8 (6), 66148 (2013).
- Wilkinson, L. G., Tucker, M. R. An optimised clearing protocol for the quantitative assessment of sub-epidermal ovule tissues within whole cereal pistils. Plant Methods. 13, 67 (2017).
- Hedhly, A., Vogler, H., Eichenberger, C., Grossniklaus, U. Whole-mount clearing and staining of Arabidopsis flower organs and Siliques. Journal of Visualized Experiments. (134), e56441 (2018).
- Creff, A., Brocard, L., Ingram, G. A mechanically sensitive cell layer regulates the physical properties of the Arabidopsis seed coat. Nature Communications. 6, 6382 (2015).
- Yang, T., et al. The B3 domain-containing transcription factor ZmABI19 coordinates expression of key factors required for maize seed development and grain filling. Plant Cell. 33 (1), 104-128 (2021).
- Anderson, L. E. Hoyer’s solution as a rapid permanent mounting medium for bryophytes. Bryologist. 57 (3), 242-244 (1954).
- Herr, J. M. A new clearing-squash technique for the study of ovule development in angiosperms. American Journal of Botany. 58 (8), 785-790 (1971).
- Yadegari, R., et al. Cell differentiation and morphogenesis are uncoupled in Arabidopsis raspberry embryos. The Plant Cell. 6 (12), 1713-1729 (1995).
- Grini, P. E., Jurgens, G., Hulskamp, M. Embryo and endosperm development is disrupted in the female gametophytic capulet mutants of Arabidopsis. Genetics. 162 (4), 1911-1925 (2002).
- Kataoka, K., Uemachi, A., Yazawa, S. Fruit growth and pseudoembryo development affected by uniconazole, an inhibitor of gibberellin biosynthesis, in pat-2 and auxin-Induced parthenocarpic tomato fruits. Scientia Horticulturae. 98 (1), 9-16 (2003).
- de Jong, M., Wolters-Arts, M., Feron, R., Mariani, C., Vriezen, W. H. The Solanum lycopersicum auxin response factor 7 (SlARF7) regulates auxin signaling during tomato fruit set and development. Plant Journal. 57 (1), 160-170 (2009).
- Roth, M., Florez-Rueda, A. M., Paris, M., Stadler, T. Wild tomato endosperm transcriptomes reveal common roles of genomic imprinting in both nuclear and cellular endosperm. Plant Journal. 95 (6), 1084-1101 (2018).
- Orsi, C. H., Tanksley, S. D. Natural variation in an ABC transporter gene associated with seed size evolution in tomato species. PLoS Genetics. 5 (1), 1000347 (2009).
- Herridge, R. P., Day, R. C., Baldwin, S., Macknight, R. C. Rapid analysis of seed size in Arabidopsis for mutant and QTL discovery. Plant Methods. 7 (1), 3 (2011).
- Xu, T. T., Ren, S. C., Song, X. F., Liu, C. M. CLE19 expressed in the embryo regulates both cotyledon establishment and endosperm development in Arabidopsis. Journal of Experimental Botany. 66 (17), 5217-5227 (2015).
- Ghadiri Alamdari, N., Salmasi, S., Almasi, H. Tomato seed mucilage as a new source of biodegradable film-forming material: effect of glycerol and cellulose nanofibers on the characteristics of resultant films. Food and Bioprocess Technology. 14 (12), 2380-2400 (2021).
- Gardner, R. O. An overview of botanical clearing technique. Stain Technology. 50 (2), 99-105 (1975).
- Beresniewicz, M. M., Taylor, A. G., Goffinet, M. C., Terhune, B. T. Characterization and location of a semipermeable layer in seed coats of leek and onion (Liliaceae), tomato and pepper (Solanaceae). Seed Science and Technology. 23 (1), 123-134 (1995).
- Stebbins, G. L. A bleaching and clearing method for plant tissues. Science. 87 (2245), 21-22 (1938).
- Debenham, E. M. A modified technique for the microscopic examination of the xylem of whole plants or plant organs. Annals of Botany. 3 (2), 369-373 (1939).
- Morley, T. Accelerated clearing of plant leaves by NaOH in association with oxygen. Stain Technology. 43 (6), 315-319 (1968).

