Isolement, caractérisation et extraction totale de l’ADN pour identifier les champignons endophytes chez les plantes mycohétérotrophes
Summary
Le présent article vise à fournir des protocoles détaillés et adéquats pour l’isolement des champignons endophytes associés aux plantes, la conservation à long terme des isolats, la caractérisation morphologique et l’extraction totale de l’ADN pour l’identification moléculaire ultérieure et les analyses métagénomiques.
Abstract
Les plantes mycohétérotrophes présentent l’une des formes les plus extrêmes de dépendance mycorhizienne, ayant totalement perdu leur capacité autotrophe. Aussi essentiels que toute autre ressource vitale, les champignons auxquels ces plantes s’associent intimement leur sont essentiels. Par conséquent, certaines des techniques les plus pertinentes dans l’étude des espèces mycohétérotrophes sont celles qui permettent d’étudier les champignons associés, en particulier ceux qui habitent les racines et les organes souterrains. Dans ce contexte, des techniques d’identification des champignons endophytes dépendants et indépendants de la culture sont couramment appliquées. L’isolement des endophytes fongiques permet de les identifier morphologiquement, d’analyser leur diversité et de maintenir les inocules pour des applications dans la germination symbiotique des graines d’orchidées. Cependant, on sait qu’il existe une grande variété de champignons non cultivables qui habitent les tissus végétaux. Ainsi, les techniques d’identification moléculaire indépendantes de la culture offrent une couverture plus large de la diversité et de l’abondance des espèces. L’objectif de cet article est d’apporter le soutien méthodologique nécessaire à la mise en place de deux procédures d’investigation : l’une dépendante de la culture et l’autre indépendante. En ce qui concerne le protocole dépendant de la culture, les processus de collecte et de conservation des échantillons de plantes des sites de collecte aux installations de laboratoire sont détaillés, ainsi que l’isolement des champignons filamenteux des organes souterrains et aériens des plantes mycohétérotrophes, la conservation d’une collection d’isolats, la caractérisation morphologique des hyphes par la méthodologie de culture sur lame et l’identification moléculaire des champignons par extraction totale de l’ADN. Englobant des méthodologies indépendantes de la culture, les procédures détaillées comprennent la collecte d’échantillons de plantes pour des analyses métagénomiques et l’extraction totale de l’ADN à partir d’organes végétaux achlorophylliens à l’aide d’un kit commercial. Enfin, des protocoles de continuité (p. ex., réaction en chaîne par polymérase [PCR], séquençage) sont également suggérés pour les analyses, et les techniques sont présentées ici.
Introduction
Les champignons endophytes sont, par définition, ceux qui habitent l’intérieur des organes et des tissus végétaux lors d’infections discrètes (c’est-à-dire sans causer de dommages à leur hôte)1,2. Ces champignons peuvent interagir de manière neutre ou bénéfique avec les plantes hôtes, peuvent conférer une résistance aux agents pathogènes et aux conditions environnementales défavorables, et peuvent contribuer à la synthèse de composés bénéfiques pour la plante (par exemple, les facteurs de croissance et d’autres phytohormones)1,3. Les endophytes mycorhiziens sont des champignons qui établissent des associations mycorhiziennes avec la plante, participant au transfert des nutriments4. Chez les Orchidaceae, l’interaction avec les endophytes mycorhiziens est fondamentale pour la germination des graines chez la grande majorité des espèces, et l’établissement des plantules chez toutes les plantes de la famille5. Dans de tels contextes, les orchidées mycohétérotrophes représentent un cas de dépendance totale vis-à-vis de leurs partenaires mycorhiziens, car elles dépendent du transfert de nutriments minéraux et de composés carbonés par ces champignons pendant tout leur cycle de vie6. Par conséquent, l’isolement et l’identification des champignons associés est une base fondamentale lors de l’étude des stratégies de vie mycohétérotrophes. De plus, on sait peu de choses sur les rôles des endophytes fongiques chez les plantes mycohétérotrophes ou même sur la diversité réelle de ces champignons 7,8.
L’étude des champignons endophytes peut être menée à l’aide de différentes techniques, traditionnellement décrites comme indépendantes ou dépendantes de la culture, par exemple : (a) l’observation directe, (b) l’isolement fongique et l’identification morphologique et/ou moléculaire, et (c) l’extraction totale de l’ADN des tissus végétaux et l’identification moléculaire9. Dans l’observation directe (a), les champignons endophytes peuvent être étudiés alors qu’ils sont encore à l’intérieur des cellules et des tissus végétaux par microscopie optique ou électronique9, car différents protocoles de microscopie sont détaillés par Pena-Passos et al.10. Par des méthodes d’isolement (b), les endophytes fongiques peuvent être caractérisés en fonction de leurs colonies, de leurs hyphes et de la morphologie de leur structure de reproduction ou de résistance. De plus, grâce à des techniques d’isolement, il est possible d’effectuer l’identification moléculaire des isolats par extraction d’ADN, amplification de séquences d’identification moléculaire (codes-barres ou empreintes digitales) et séquençage11. Cette dernière technique (c) permet l’identification moléculaire de champignons endophytes par extraction d’ADN à l’intérieur des tissus végétaux (métabarcoding), suivie d’une préparation et d’un séquençage de la bibliothèque12.
De plus, des isolats fongiques peuvent être appliqués dans des essais de germination symbiotique, en utilisant des graines d’orchidées autotrophes ou mycohétérotrophes. Un exemple d’une telle application est l’étude menée par Sisti et al.13, décrivant la germination et les premiers stades de développement du protocorme chez Pogoniopsis schenckii, une orchidée mycohétérotrophe, en association avec certains de ses isolats, comprenant des champignons endophytes non mycorhiziens. Le protocole de germination symbiotique appliqué est détaillé et présenté dans une vidéo par Pena-Passos et al.10. L’isolement des champignons en association avec différents organes végétaux permet d’orienter diverses recherches sur la nature des interactions plantes-champignons (par exemple, pour comprendre les aspects écologiques ou physiologiques de l’association, ainsi que des enquêtes sur le transfert des nutriments des champignons à la plante)9.
Les méthodologies présentées dans la section 1 sont basées sur une collecte d’échantillons d’organes souterrains, car ces organes présentent le plus de difficultés à collecter, et ils présentent un intérêt majeur puisque les endophytes mycorhiziens les colonisent. Cependant, les deux protocoles inclus (étapes 1.1 et 1.2) peuvent être appliqués à d’autres organes végétaux mycohétérotrophes (p. ex., rhizomes, tiges florales et fruits). La méthode de collecte décrite à l’étape 1.1 est destinée à l’isolement des champignons endophytes (section 2) pour la caractérisation morphologique (sections 4 et 5) et/ou à l’extraction totale de l’ADN pour l’identification des isolats (section 6). D’autre part, la méthodologie de collecte décrite à l’étape 1.2 est exclusivement attribuée à l’extraction totale de l’ADN des tissus végétaux pour les techniques de métabarcoding (section 7). Dans la section 3, quatre méthodes de stockage et de conservation des champignons filamenteux sont présentées, deux pour le stockage à court terme (3 à 6 mois) et les deux autres adéquates pour le stockage à long terme (>1 an). La caractérisation morphologique (sections 4 et 5) peut être associée à l’identification moléculaire pour la renforcer et fournir des informations importantes sur la macro- et micromorphologie fongique. La figure 1 résume les méthodologies collectives décrites ci-dessous.
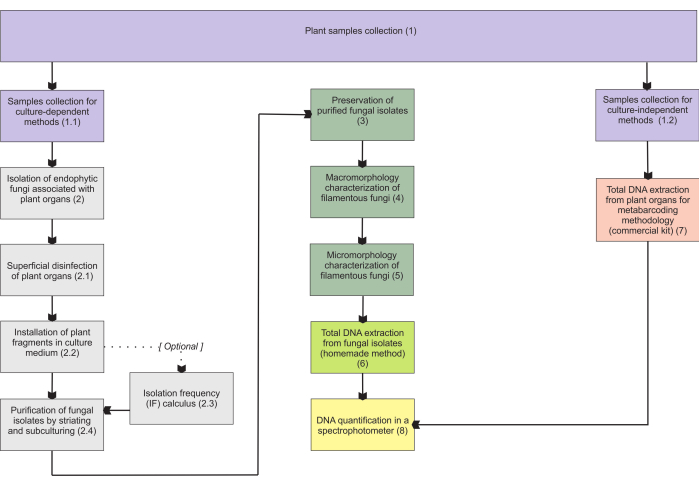
Figure 1 : Résumé schématique des méthodes présentées. Collecte de plantes et isolement fongique, préservation et identification moléculaire par des méthodologies dépendantes et indépendantes de la culture. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
La désinfestation superficielle des échantillons de plantes est l’une des étapes les plus critiques du protocole présenté. Il est fortement souhaitable qu’il n’y ait pas de contamination de la vaisselle PDA par des gouttes provenant du dernier lavage. Les bactéries sont fréquemment observées en tant que contaminants dans les boîtes d’isolement, généralement plus que les champignons sporulants en suspension dans l’air, étant donné que les bactéries endophytes sont également…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nous remercions les financements de la FAPESP (2015/26479-6) et du CNPq (447453/2014-9). JLSM remercie le CNPq pour les subventions à la productivité (303664/2020-7). Le MPP remercie Capes (bourse de maîtrise, processus 88887.600591/2021-00) et CNPq.
Materials
| Adhesive tape | (from any company, for adhesive tape mount in micromorphological analyses) | ||
| Ampicillin | Sigma-Aldrich | A5354 | (for installation of plant fragments; other antibiotics may be used – check step 2.2.1) |
| Autoclave | (from any company, for materials sterilization in many steps) | ||
| Bacteriological agar | Sigma-Aldrich | A1296 | (for many steps) |
| C1, C2, C3, C4, C5, and C6 solutions | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Centrifuge | Merck/Eppendorf | 5810 G | (for total DNA extraction from fungal isolates) |
| Centrifuge tubes | Merck | CLS430828 | (for samples collection) |
| Chloroform | Sigma-Aldrich | C2432 | (for total DNA extraction from fungal isolates) |
| Congo red | Supelco | 75768 | (for hyphae staining) |
| Cryotubes | Merck | BR114831 | (for many steps) |
| Ethanol | Supelco | 100983 | It will be necessary to carry out the appropriate dilutions (for many steps) |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 3609 | (for total DNA extraction from fungal isolates) |
| Filter paper | Merck | WHA10010155 | (for many steps) |
| Glass test tubes | Merck | CLS7082516 | (for cryopreservation in unhulled rice grains) |
| Glass wool | Supelco | 20411 | (for cryopreservation in unhulled rice grains) |
| Glucose | Sigma-Aldrich | G8270 | Or dextrose (for cryopreservation in vermiculite) |
| Glycerol | Sigma-Aldrich | G5516 | Or glycerin (for cryopreservation in vermiculite, for preparing LPCB) |
| Isopropanol | Sigma-Aldrich | 563935 | (for total DNA extraction from fungal isolates) |
| Lactic acid | Sigma-Aldrich | 252476 | (for preparing LPCB – hyphae staining) |
| Lactophenol blue solution (LPCB) | Sigma-Aldrich | 61335 | (for hyphae staining) |
| Laminar flow hood | (class I, from any company, for many steps) | ||
| Light microscope | (from any company, for hyphae observation) | ||
| MB Spin Columns | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Methyl blue (cotton blue) | Sigma-Aldrich | M5528 | (for preparing LPCB – hyphae staining) |
| Microcentrifuge tube (1.5 mL) | Merck | HS4323 | (for total DNA extraction from fungal isolates) |
| Microcentrifuge tube (2 mL) | Merck | BR780546 | (for many steps) |
| Mineral oil | (for preservation of fungal isolates) | ||
| Paper bags | Average size 150 mm x 200 mm (for samples collection) | ||
| Petri dish (Glass, 120 mm x 20 mm) | Merck/Pyrex | SLW1480/10D | (autoclavable, for fungi slide culture, prefer higher ones) |
| Petri dish (Glass, 50 mm x 17 mm) | Merck/Aldrich | Z740618 | (for purification of fungal isolates); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Petri dish (Glass, 80 mm x 15 mm) | Merck/Brand | BR455732 | (for installation of plant fragments); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Phenol | Sigma-Aldrich | P1037 | (for total DNA extraction from fungal isolates, for preparing LPCB) |
| Porcelain mortar | Sigma-Aldrich | Z247464 | (for total DNA extraction from fungal isolates) |
| Porcelain pestle | Sigma-Aldrich | Z247502 | (for total DNA extraction from fungal isolates) |
| Potato dextrose agar (PDA) | Millipore | P2182 | (for many steps) |
| PowerBead tubes | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Rapid mounting medium (Entellan) | Sigma-Aldrich | 1.0796 | (for fungi slide culture) |
| Silica gel | Supelco | 717185 | (for cryopreservation in unhulled rice grains) |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | (for total DNA extraction from fungal isolates) |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | Lauryl sulfate sodium salt (for total DNA extraction from fungal isolates) |
| Sodium hypochlorite (w/ 2% active chlorine) | (commercial product, for superficial desinfestation) | ||
| Soil DNA extraction kit (DNeasy PowerSoil kit) | Qiagen | 12888-50 | (for total DNA extraction from plant organs) |
| Spectrophotometer – Nanodrop 2000/2000c | ThermoFisher Scientific | ND2000CLAPTOP | (for total DNA extraction from plant organs) |
| Stereomicroscope | (=dissecting microscope, from any company, for macromorphological analyses) | ||
| Tetracycline | Sigma-Aldrich | T7660 | (for installation of plant fragments) |
| Thermoblock | Merck/Eppendorf | EP5362000035 | (or from other companies) |
| Tissue homogenizer and cell lyzer | SPEX SamplePrep | 2010 Geno/Grinder – Automated Tissue Homogenizer and Cell Lyzer (for total DNA extraction from plant organs) | |
| Toluidine blue O | Sigma-Aldrich/Harleco | 364-M | (for hyphae staining) |
| Trehalose | Sigma-Aldrich | T9531 | (for cryopreservation in vermiculite) |
| Tris Base Solution (Tris) | Sigma-Aldrich | T1699 | (for total DNA extraction from fungal isolates) |
| Unhulled rice grains | (for cryopreservation) | ||
| U-shaped glass rod | (or an adaptation – check step 5.4.1, for fungi slide culture) | ||
| Vermiculite | Fine granulometry (for cryopreservation in vermiculite) | ||
| Vortexer | Sigma-Aldrich/BenchMixer | BMSBV1000 | (for total DNA extraction from fungal isolates) |
| Yeast extract | Sigma-Aldrich | Y1625 | (for cryopreservation in vermiculite) |
References
- de Azevedo, J. L. Endophytic microorganisms. Ecologia Microbiana. , 117-137 (1998).
- Stone, J. K., Bacon, C. W., White, J. F. An overview of endophytic microbes: endophytism defined. Microbial Endophytes. , 17-44 (2000).
- Schulz, B., Boyle, C. What are Endophytes. Microbial Root Endophytes. , 1-13 (2006).
- Smith, S. E., Read, D. J. . Mycorrhizal Symbiosis. , (2008).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Ma, X., Kang, J., Nontachaiyapoom, S., Wen, T., Hyde, K. D. Non-mycorrhizal endophytic fungi from orchids. Current Science. 109 (1), 72-87 (2015).
- Favre-Godal, Q., Gourguillon, L., Lordel-Madeleine, S., Gindro, K., Choisy, P. Orchids and their mycorrhizal fungi: an insufficiently explored relationship. Mycorrhiza. 30 (1), 5-22 (2020).
- Sun, X., Guo, L. -. D. Endophytic fungal diversity: review of traditional and molecular techniques. Mycology. 3 (1), 65-76 (2012).
- Pena-Passos, M., Sisti, L. S., Mayer, J. L. S. Microscopy techniques for interpreting fungal colonization in mycoheterotrophic plants tissues and symbiotic germination of seeds. Journal of Visualized Experiments. (183), e63777 (2022).
- Araújo, W. L., et al. . Endophytic microorganisms: Theoretical and Practical Aspects of Isolation and Characterization. 1st ed. 1, 257 (2014).
- de Souza, R. S. C., et al. Unlocking the bacterial and fungal communities assemblages of sugarcane microbiome. Scientific Reports. 6, 28774 (2016).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Araújo, W. L., et al. Variability and interactions between endophytic bacteria and fungi isolated from leaf tissues of citrus rootstocks. Canadian Journal of Microbiology. 47 (3), 229-236 (2001).
- Castellani, A. Further researches on the long viability and growth of many pathogenic fungi and some bacteria in sterile distilled water. Mycopathologia. 20 (1-2), 1-6 (1963).
- Currah, R. S., Zelmer, C. D., Hambleton, S., Richardson, K. A. Fungi from orchid mycorrhizas. Orchid Biology: Reviews and Perspectives, VII. , 117-170 (1997).
- Freitas, E. F. S., et al. Diversity of mycorrhizal Tulasnella associated with epiphytic and rupicolous orchids from the Brazilian Atlantic Forest, including four new species. Scientific Reports. 10 (1), 7069 (2020).
- Sato, M., Inaba, S., Noguchi, M., Nakagiri, A. Vermiculite as a culture substrate greatly improves the viability of frozen cultures of ectomycorrhizal basidiomycetes. Fungal Biology. 124 (8), 742-751 (2020).
- Pereira, O. L., Kasuya, M. C. M., Borges, A. C., Araújo, E. F. D. Morphological and molecular characterization of mycorrhizal fungi isolated from neotropical orchids in Brazil. Canadian Journal of Botany. 83 (1), 54-65 (2005).
- Riddell, R. W. Permanent stained mycological preparations obtained by slide culture. Mycologia. 42 (2), 265-270 (1950).
- Walsh, T. J., Hayden, R. T., Larone, D. H. . Larone’s Medically Important Fungi: A Guide to Identification. , (2018).
- Microscopy: Chemical Reagents. British Mycological Society Available from: https://www.britmycolsoc.org.uk/field_mycology/microscopy/reagents (2022)
- Senanayake, I. C., et al. Morphological approaches in studying fungi: Collection, examination, isolation, sporulation and preservation. Mycosphere. 11 (1), 2678-2754 (2020).
- Slifkin, M., Cumbie, R. Congo red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Raeder, U., Broda, P. Rapid preparation of DNA from filamentous fungi. Letters in Applied Microbiology. 1 (1), 17-20 (1985).
- Martins, M. K., et al. Molecular characterization of endophytic microorganisms. Endophytic microorganisms: theoretical and practical aspects of isolation and characterization. 1st edition. , 189-211 (2014).
- Rayner, R. W. A Mycological Colour Chart. Commonwealth Mycological Institute. , (1970).
- Kornerup, A., Wanscher, J. H. . Methuen Handbook of Colour. Methuen handbook of colour. , (1967).
- Ridgway, R. . Color Standards and Color Nomenclature. , (1912).
- McGinnis, M. R. . Laboratory Handbook of Medical Mycology. , (2012).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sridharan, G., Shankar, A. A. Toluidine blue: A review of its chemistry and clinical utility. Journal of Oral and Maxillofacial Pathology. 16 (2), 251-255 (2012).
- Smith, D., Onions, A. H. S. A comparison of some preservation techniques for fungi. Transactions of the British Mycological Society. 81 (3), 535-540 (1983).
- Ryan, M. J., Smith, D., Jeffries, P. A decision-based key to determine the most appropriate protocol for the preservation of fungi. World Journal of Microbiology and Biotechnology. 16 (2), 183-186 (2000).
- Lalaymia, I., Cranenbrouck, S., Declerck, S. Maintenance and preservation of ectomycorrhizal and arbuscular mycorrhizal fungi. Mycorrhiza. 24 (5), 323-337 (2014).
- Zettler, L. W., Corey, L. L. Orchid mycorrhizal fungi: isolation and identification techniques. Orchid Propagation: From Laboratories to Greenhouses-Methods and Protocols. , 27-59 (2018).
- Yu, S., Wang, Y., Li, X., Yu, F., Li, W. The factors affecting the reproducibility of micro-volume DNA mass quantification in Nanodrop 2000 spectrophotometer. Optik. 145, 555-560 (2017).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Schoch, C. L., et al. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi. Proceedings of the National Academy of Sciences. 109 (16), 6241-6246 (2012).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols: A Guide to Methods and Applications. 18 (1), 315-322 (1990).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proceedings of the National Academy of Sciences. 74 (12), 5463-5467 (1977).
- Ranjard, L., et al. Characterization of bacterial and fungal soil communities by automated ribosomal intergenic spacer analysis fingerprints: biological and methodological variability. Applied and Environmental Microbiology. 67 (10), 4479-4487 (2001).
- Metzker, M. L. Sequencing technologies-the next generation. Nature Reviews Genetics. 11 (1), 31-46 (2010).

