Mycoheterotrophic 식물에서 내생균 균류를 식별하기 위한 분리, 특성화 및 전체 DNA 추출
Summary
현재 논문은 식물 관련 내생균의 분리, 분리물의 장기 보존, 형태학적 특성 분석 및 후속 분자 식별 및 균유전체 분석을 위한 전체 DNA 추출을 위한 상세하고 적절한 프로토콜을 제공하는 것을 목표로 합니다.
Abstract
Mycoheterotrophic 식물은 가장 극단적 인 형태의 균근 의존성 중 하나를 나타내며 독립 영양 능력을 완전히 잃었습니다. 다른 중요한 자원과 마찬가지로 이 식물과 밀접하게 연관되어 있는 균류는 식물에게 필수적입니다. 따라서 mycoheterotrophic 종을 연구하는 데 가장 관련성이 높은 기술 중 일부는 관련 균류, 특히 뿌리 및 지하 기관에 서식하는 균류를 조사할 수 있는 기술입니다. 이러한 맥락에서, 배양 의존적 및 배양 비의존성 내생균을 식별하기 위한 기술이 일반적으로 적용된다. 곰팡이 내생식물을 분리하는 것은 형태학적으로 식별하고, 다양성을 분석하고, 난초 종자의 공생 발아에 적용하기 위한 접종물을 유지하는 수단을 제공합니다. 그러나 식물 조직에 서식하는 다양한 비배양 균류가 있는 것으로 알려져 있습니다. 따라서 배양에 독립적인 분자 식별 기술은 종의 다양성과 풍부도에 대한 더 넓은 범위를 제공합니다. 이 기사는 두 가지 조사 절차, 즉 문화 종속 및 독립 조사 절차를 시작하는 데 필요한 방법론적 지원을 제공하는 것을 목표로 합니다. 배양 의존적 프로토콜과 관련하여, 균종속영양 식물의 지하 및 공중 기관에서 사상균을 분리하고, 분리물을 수집하고, 슬라이드 배양 방법론에 의한 균사를 형태학적으로 특성화하고, 전체 DNA 추출을 통해 균류의 분자 식별과 함께 채취 장소에서 실험실 시설까지 식물 샘플을 수집하고 유지하는 과정이 자세히 설명되어 있습니다. 배양에 독립적인 방법론을 포괄하는 세부 절차에는 메타게놈 분석을 위한 식물 샘플 수집과 상용 키트를 사용하여 아클로로필 식물 장기에서 전체 DNA 추출이 포함됩니다. 마지막으로, 연속성 프로토콜(예: 중합효소연쇄반응[PCR], 염기서열분석)도 분석을 위해 제안되며, 여기에 기술이 제시됩니다.
Introduction
내생균(endophytic fungi)은 식물 장기와 조직의 내부에 눈에 띄지 않는 감염(즉, 숙주에게 해를 끼치지 않고)에 서식하는 균류입니다.1,2. 이러한 균류는 숙주 식물과 중성 또는 유익하게 상호 작용할 수 있고, 병원균 및 불리한 환경 조건에 대한 저항성을 부여할 수 있으며, 식물에 유익한 화합물(예: 성장 인자 및 기타 식물 호르몬)의 합성에 기여할 수 있습니다1,3. 균근 내생식물(Mycorrhizal endophytes)은 식물과 균근 결합을 이루는 균류로, 영양소 전달에 참여한다4. Orchidaceae에서 균근 내생식물과의 상호 작용은 대다수의 종에서 종자 발아와 가족의 모든 식물에서 묘목 설립에 기본입니다5. 이러한 맥락에서, 진균 종속영양 난초는 전체 생애 주기 동안 이러한 균류에 의한 미네랄 영양소와 탄소 화합물 전달에 의존하기 때문에 균근 파트너에 대한 완전한 의존의 경우를 나타낸다6. 따라서 연관 균류의 분리 및 식별은 mycoheterotrophic life 전략을 조사할 때 기본 기반입니다. 더욱이, 균 종속 영양 식물에서 곰팡이 내생식물의 역할이나 이러한 곰팡이 7,8의 실제 다양성에 대해서는 거의 알려져 있지 않습니다.
내생균의 조사는 전통적으로 배양 독립적 또는 의존적이라고 설명되는 다양한 기술을 통해 수행될 수 있는데, 예를 들어 (a) 직접 관찰, (b) 곰팡이 분리 및 형태학적 및/또는 분자 식별, (c) 식물 조직의 전체 DNA 추출 및 분자 식별9. 직접 관찰 (a)에서, 내생균류는 식물 세포 및 조직의 내부에 있는 동안 광 또는 전자 현미경(light or electron microscopy)9에 의해 조사될 수 있으며, 이는 Pena-Passos et al.10에 의해 상이한 현미경 프로토콜이 상세히 기술되어 있기 때문이다. 분리 방법 (b)에 의해, 곰팡이 내생식물은 그들의 군집, 균사 및 생식 또는 저항 구조 형태에 따라 특성화될 수 있다. 또한 분리 기술을 통해 DNA 추출, 분자 식별 서열(바코드 또는 지문)의 증폭 및 염기서열분석을 통해 분리물의 분자 식별을 수행할 수 있습니다11. 후자의 기술(c)은 식물 조직의 내부(메타바코드화)에 있는 동안 DNA 추출에 따라 내생균의 분자 식별을 가능하게 하고, 라이브러리 준비 및 염기서열분석12을 수행한다.
또한, 곰팡이 분리물은 독립 영양 또는 mycoheterotrophic 난초의 종자를 사용하여 공생 발아 시험에 적용될 수 있습니다. 이러한 응용의 예는 Sisti et al.13에 의해 수행된 조사로, 비균근 내생균을 포함하는 일부 분리물과 관련하여 진균종속영양 난초인 Pogoniopsis schenckii에서 원시관 발달의 발아 및 초기 단계를 설명합니다. 적용된 공생 발아 프로토콜은 Pena-Passos et al.10의 비디오에 자세히 설명되어 있습니다. 균류를 다른 식물 기관과 연관시켜 분리하면 식물-균류 상호 작용의 특성에 대한 다양한 조사에 초점을 맞출 수 있습니다(예: 연관성의 생태학적 또는 생리학적 측면을 이해하고 균류에서 식물로의 영양분 전달에 대한 조사)9.
섹션 1에 제시된 방법론은 지하 장기 샘플 수집을 기반으로 하는데, 이러한 장기는 수집에 가장 어려움을 나타내며 균근 내생식물이 군집을 이루기 때문에 주요 관심사입니다. 그러나, 포함된 프로토콜(단계 1.1 및 1.2)은 다른 진균종속영양 식물 기관(예를 들어, 뿌리줄기, 꽃줄기 및 과일)에 적용될 수 있다. 1.1단계에서 설명된 수집 방법은 형태학적 특성화(섹션 4 및 5)를 위한 내생균(섹션 2) 및/또는 분리 식별을 위한 전체 DNA 추출(섹션 6)을 위해 지정됩니다. 반면에, 1.2단계에서 설명한 수집 방법론은 메타바코딩 기법을 위한 식물 조직의 전체 DNA 추출에만 할당됩니다(섹션 7). 섹션 3에서는 사상균 저장 및 보존을 위한 4가지 방법을 제시하는데, 2개는 단기 보관(3-6개월)이고 다른 2개는 장기 보관(>1년)에 적합합니다. 형태학적 특성화(섹션 4 및 5)는 이를 강화하고 곰팡이 거대 및 미세 형태에 대한 중요한 정보를 제공하기 위해 분자 식별과 관련될 수 있습니다. 그림 1 은 그 이후에 설명된 집합적 방법론을 요약한 것입니다.
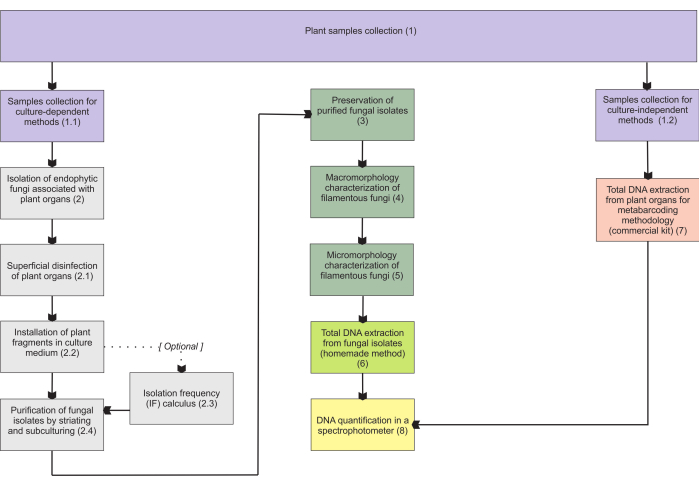
그림 1: 제시된 방법의 개략적 요약. 식물 수집 및 곰팡이 분리, 보존 및 배양 의존적 및 독립적 방법론에 의한 분자 식별. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
식물 샘플의 표면적 소독은 제시된 프로토콜에서 가장 중요한 단계 중 하나입니다. PDA 접시에 마지막 세척 물방울이 있는 오염이 없는 것은 매우 바람직합니다. 박테리아는 격리 접시에서 오염 물질로 자주 관찰되며, 일반적으로 공기 중 포자 균류보다 더 많으며, 내생균은 식물 조직 내에서도 흔하다는 점을 고려하면 3,11. 따라서 장기 절편을 설치할 ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
FAPESP(2015/26479-6) 및 CNPq(447453/2014-9)의 자금 지원에 감사드립니다. JLSM은 생산성 보조금에 대해 CNPq에 감사드립니다(303664/2020-7). MPP는 Capes(석사 학위 장학금, 프로세스 88887.600591/2021-00)와 CNPq에 감사드립니다.
Materials
| Adhesive tape | (from any company, for adhesive tape mount in micromorphological analyses) | ||
| Ampicillin | Sigma-Aldrich | A5354 | (for installation of plant fragments; other antibiotics may be used – check step 2.2.1) |
| Autoclave | (from any company, for materials sterilization in many steps) | ||
| Bacteriological agar | Sigma-Aldrich | A1296 | (for many steps) |
| C1, C2, C3, C4, C5, and C6 solutions | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Centrifuge | Merck/Eppendorf | 5810 G | (for total DNA extraction from fungal isolates) |
| Centrifuge tubes | Merck | CLS430828 | (for samples collection) |
| Chloroform | Sigma-Aldrich | C2432 | (for total DNA extraction from fungal isolates) |
| Congo red | Supelco | 75768 | (for hyphae staining) |
| Cryotubes | Merck | BR114831 | (for many steps) |
| Ethanol | Supelco | 100983 | It will be necessary to carry out the appropriate dilutions (for many steps) |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 3609 | (for total DNA extraction from fungal isolates) |
| Filter paper | Merck | WHA10010155 | (for many steps) |
| Glass test tubes | Merck | CLS7082516 | (for cryopreservation in unhulled rice grains) |
| Glass wool | Supelco | 20411 | (for cryopreservation in unhulled rice grains) |
| Glucose | Sigma-Aldrich | G8270 | Or dextrose (for cryopreservation in vermiculite) |
| Glycerol | Sigma-Aldrich | G5516 | Or glycerin (for cryopreservation in vermiculite, for preparing LPCB) |
| Isopropanol | Sigma-Aldrich | 563935 | (for total DNA extraction from fungal isolates) |
| Lactic acid | Sigma-Aldrich | 252476 | (for preparing LPCB – hyphae staining) |
| Lactophenol blue solution (LPCB) | Sigma-Aldrich | 61335 | (for hyphae staining) |
| Laminar flow hood | (class I, from any company, for many steps) | ||
| Light microscope | (from any company, for hyphae observation) | ||
| MB Spin Columns | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Methyl blue (cotton blue) | Sigma-Aldrich | M5528 | (for preparing LPCB – hyphae staining) |
| Microcentrifuge tube (1.5 mL) | Merck | HS4323 | (for total DNA extraction from fungal isolates) |
| Microcentrifuge tube (2 mL) | Merck | BR780546 | (for many steps) |
| Mineral oil | (for preservation of fungal isolates) | ||
| Paper bags | Average size 150 mm x 200 mm (for samples collection) | ||
| Petri dish (Glass, 120 mm x 20 mm) | Merck/Pyrex | SLW1480/10D | (autoclavable, for fungi slide culture, prefer higher ones) |
| Petri dish (Glass, 50 mm x 17 mm) | Merck/Aldrich | Z740618 | (for purification of fungal isolates); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Petri dish (Glass, 80 mm x 15 mm) | Merck/Brand | BR455732 | (for installation of plant fragments); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Phenol | Sigma-Aldrich | P1037 | (for total DNA extraction from fungal isolates, for preparing LPCB) |
| Porcelain mortar | Sigma-Aldrich | Z247464 | (for total DNA extraction from fungal isolates) |
| Porcelain pestle | Sigma-Aldrich | Z247502 | (for total DNA extraction from fungal isolates) |
| Potato dextrose agar (PDA) | Millipore | P2182 | (for many steps) |
| PowerBead tubes | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Rapid mounting medium (Entellan) | Sigma-Aldrich | 1.0796 | (for fungi slide culture) |
| Silica gel | Supelco | 717185 | (for cryopreservation in unhulled rice grains) |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | (for total DNA extraction from fungal isolates) |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | Lauryl sulfate sodium salt (for total DNA extraction from fungal isolates) |
| Sodium hypochlorite (w/ 2% active chlorine) | (commercial product, for superficial desinfestation) | ||
| Soil DNA extraction kit (DNeasy PowerSoil kit) | Qiagen | 12888-50 | (for total DNA extraction from plant organs) |
| Spectrophotometer – Nanodrop 2000/2000c | ThermoFisher Scientific | ND2000CLAPTOP | (for total DNA extraction from plant organs) |
| Stereomicroscope | (=dissecting microscope, from any company, for macromorphological analyses) | ||
| Tetracycline | Sigma-Aldrich | T7660 | (for installation of plant fragments) |
| Thermoblock | Merck/Eppendorf | EP5362000035 | (or from other companies) |
| Tissue homogenizer and cell lyzer | SPEX SamplePrep | 2010 Geno/Grinder – Automated Tissue Homogenizer and Cell Lyzer (for total DNA extraction from plant organs) | |
| Toluidine blue O | Sigma-Aldrich/Harleco | 364-M | (for hyphae staining) |
| Trehalose | Sigma-Aldrich | T9531 | (for cryopreservation in vermiculite) |
| Tris Base Solution (Tris) | Sigma-Aldrich | T1699 | (for total DNA extraction from fungal isolates) |
| Unhulled rice grains | (for cryopreservation) | ||
| U-shaped glass rod | (or an adaptation – check step 5.4.1, for fungi slide culture) | ||
| Vermiculite | Fine granulometry (for cryopreservation in vermiculite) | ||
| Vortexer | Sigma-Aldrich/BenchMixer | BMSBV1000 | (for total DNA extraction from fungal isolates) |
| Yeast extract | Sigma-Aldrich | Y1625 | (for cryopreservation in vermiculite) |
References
- de Azevedo, J. L. Endophytic microorganisms. Ecologia Microbiana. , 117-137 (1998).
- Stone, J. K., Bacon, C. W., White, J. F. An overview of endophytic microbes: endophytism defined. Microbial Endophytes. , 17-44 (2000).
- Schulz, B., Boyle, C. What are Endophytes. Microbial Root Endophytes. , 1-13 (2006).
- Smith, S. E., Read, D. J. . Mycorrhizal Symbiosis. , (2008).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Ma, X., Kang, J., Nontachaiyapoom, S., Wen, T., Hyde, K. D. Non-mycorrhizal endophytic fungi from orchids. Current Science. 109 (1), 72-87 (2015).
- Favre-Godal, Q., Gourguillon, L., Lordel-Madeleine, S., Gindro, K., Choisy, P. Orchids and their mycorrhizal fungi: an insufficiently explored relationship. Mycorrhiza. 30 (1), 5-22 (2020).
- Sun, X., Guo, L. -. D. Endophytic fungal diversity: review of traditional and molecular techniques. Mycology. 3 (1), 65-76 (2012).
- Pena-Passos, M., Sisti, L. S., Mayer, J. L. S. Microscopy techniques for interpreting fungal colonization in mycoheterotrophic plants tissues and symbiotic germination of seeds. Journal of Visualized Experiments. (183), e63777 (2022).
- Araújo, W. L., et al. . Endophytic microorganisms: Theoretical and Practical Aspects of Isolation and Characterization. 1st ed. 1, 257 (2014).
- de Souza, R. S. C., et al. Unlocking the bacterial and fungal communities assemblages of sugarcane microbiome. Scientific Reports. 6, 28774 (2016).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Araújo, W. L., et al. Variability and interactions between endophytic bacteria and fungi isolated from leaf tissues of citrus rootstocks. Canadian Journal of Microbiology. 47 (3), 229-236 (2001).
- Castellani, A. Further researches on the long viability and growth of many pathogenic fungi and some bacteria in sterile distilled water. Mycopathologia. 20 (1-2), 1-6 (1963).
- Currah, R. S., Zelmer, C. D., Hambleton, S., Richardson, K. A. Fungi from orchid mycorrhizas. Orchid Biology: Reviews and Perspectives, VII. , 117-170 (1997).
- Freitas, E. F. S., et al. Diversity of mycorrhizal Tulasnella associated with epiphytic and rupicolous orchids from the Brazilian Atlantic Forest, including four new species. Scientific Reports. 10 (1), 7069 (2020).
- Sato, M., Inaba, S., Noguchi, M., Nakagiri, A. Vermiculite as a culture substrate greatly improves the viability of frozen cultures of ectomycorrhizal basidiomycetes. Fungal Biology. 124 (8), 742-751 (2020).
- Pereira, O. L., Kasuya, M. C. M., Borges, A. C., Araújo, E. F. D. Morphological and molecular characterization of mycorrhizal fungi isolated from neotropical orchids in Brazil. Canadian Journal of Botany. 83 (1), 54-65 (2005).
- Riddell, R. W. Permanent stained mycological preparations obtained by slide culture. Mycologia. 42 (2), 265-270 (1950).
- Walsh, T. J., Hayden, R. T., Larone, D. H. . Larone’s Medically Important Fungi: A Guide to Identification. , (2018).
- Microscopy: Chemical Reagents. British Mycological Society Available from: https://www.britmycolsoc.org.uk/field_mycology/microscopy/reagents (2022)
- Senanayake, I. C., et al. Morphological approaches in studying fungi: Collection, examination, isolation, sporulation and preservation. Mycosphere. 11 (1), 2678-2754 (2020).
- Slifkin, M., Cumbie, R. Congo red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Raeder, U., Broda, P. Rapid preparation of DNA from filamentous fungi. Letters in Applied Microbiology. 1 (1), 17-20 (1985).
- Martins, M. K., et al. Molecular characterization of endophytic microorganisms. Endophytic microorganisms: theoretical and practical aspects of isolation and characterization. 1st edition. , 189-211 (2014).
- Rayner, R. W. A Mycological Colour Chart. Commonwealth Mycological Institute. , (1970).
- Kornerup, A., Wanscher, J. H. . Methuen Handbook of Colour. Methuen handbook of colour. , (1967).
- Ridgway, R. . Color Standards and Color Nomenclature. , (1912).
- McGinnis, M. R. . Laboratory Handbook of Medical Mycology. , (2012).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sridharan, G., Shankar, A. A. Toluidine blue: A review of its chemistry and clinical utility. Journal of Oral and Maxillofacial Pathology. 16 (2), 251-255 (2012).
- Smith, D., Onions, A. H. S. A comparison of some preservation techniques for fungi. Transactions of the British Mycological Society. 81 (3), 535-540 (1983).
- Ryan, M. J., Smith, D., Jeffries, P. A decision-based key to determine the most appropriate protocol for the preservation of fungi. World Journal of Microbiology and Biotechnology. 16 (2), 183-186 (2000).
- Lalaymia, I., Cranenbrouck, S., Declerck, S. Maintenance and preservation of ectomycorrhizal and arbuscular mycorrhizal fungi. Mycorrhiza. 24 (5), 323-337 (2014).
- Zettler, L. W., Corey, L. L. Orchid mycorrhizal fungi: isolation and identification techniques. Orchid Propagation: From Laboratories to Greenhouses-Methods and Protocols. , 27-59 (2018).
- Yu, S., Wang, Y., Li, X., Yu, F., Li, W. The factors affecting the reproducibility of micro-volume DNA mass quantification in Nanodrop 2000 spectrophotometer. Optik. 145, 555-560 (2017).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Schoch, C. L., et al. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi. Proceedings of the National Academy of Sciences. 109 (16), 6241-6246 (2012).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols: A Guide to Methods and Applications. 18 (1), 315-322 (1990).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proceedings of the National Academy of Sciences. 74 (12), 5463-5467 (1977).
- Ranjard, L., et al. Characterization of bacterial and fungal soil communities by automated ribosomal intergenic spacer analysis fingerprints: biological and methodological variability. Applied and Environmental Microbiology. 67 (10), 4479-4487 (2001).
- Metzker, M. L. Sequencing technologies-the next generation. Nature Reviews Genetics. 11 (1), 31-46 (2010).

