בידוד, אפיון ומיצוי DNA כולל לזיהוי פטריות אנדופיטיות בצמחים מיקוהטרוטרופיים
Summary
המאמר הנוכחי נועד לספק פרוטוקולים מפורטים ונאותים לבידוד פטריות אנדופיטיות הקשורות לצמחים, שימור ארוך טווח של מבודדים, אפיון מורפולוגי ומיצוי DNA כולל לצורך זיהוי מולקולרי וניתוחים מטאגנומיים לאחר מכן.
Abstract
צמחים Mycoheterotrophic להציג את אחת הצורות הקיצוניות ביותר של תלות mycorrhizal, לאחר שאיבדו לחלוטין את היכולת האוטוטרופית שלהם. חיוני כמו כל משאב חיוני אחר, הפטריות שצמחים אלה מתקשרים איתן באופן אינטימי חיוניות עבורם. לפיכך, כמה מהטכניקות הרלוונטיות ביותר בחקר מינים מיקוהטרוטרופיים הן אלה המאפשרות חקירה של פטריות הקשורות, במיוחד אלה המאכלסות שורשים ואיברים תת קרקעיים. בהקשר זה, טכניקות לזיהוי פטריות אנדופיטיות תלויות תרבית ובלתי תלויות תרבית מיושמות בדרך כלל. בידוד אנדופיטים פטרייתיים מספק אמצעי לזיהוי מורפולוגי שלהם, ניתוח המגוון שלהם ושמירה על החיסון ליישומים בנביטה סימביוטית של זרעי סחלבים. עם זאת, ידוע כי יש מגוון גדול של פטריות שאינן ניתנות לגידול המאכלסות רקמות צמחים. לפיכך, טכניקות זיהוי מולקולרי תלויות תרבות מציעות כיסוי רחב יותר של מגוון המינים ושפע. מאמר זה נועד לספק את התמיכה המתודולוגית הדרושה להתחלת שני הליכי חקירה: תלוי תרבות והליך עצמאי. באשר לפרוטוקול תלוי התרבית, מפורטים תהליכי איסוף ושמירה של דגימות צמחים מאתרי איסוף למתקני מעבדה, לצד בידוד פטריות נימה מאיברים תת-קרקעיים ואוויריים של צמחים מיקוהטרוטרופיים, שמירה על אוסף של מבודדים, אפיון מורפולוגי של קורים על ידי מתודולוגיית תרבית שקופיות, וזיהוי מולקולרי של פטריות על ידי מיצוי DNA כולל. הנהלים המפורטים, הכוללים מתודולוגיות שאינן תלויות בתרבות, כוללים איסוף דגימות צמחים לצורך ניתוח מטאגנומי ומיצוי DNA כולל מאיברי צמח אכלורופילוסים באמצעות ערכה מסחרית. לבסוף, פרוטוקולי המשכיות (למשל, תגובת שרשרת פולימראז [PCR], ריצוף) מוצעים גם הם לניתוחים, וטכניקות מוצגות כאן.
Introduction
פטריות אנדופיטיות הן, מעצם הגדרתן, אלה המאכלסות את פנים איברי הצמח ורקמותיהן בזיהומים לא בולטים (כלומר, מבלי לגרום נזק לפונדקאי שלהן)1,2. פטריות אלה יכולות לקיים אינטראקציה ניטרלית או מועילה עם צמחים מארחים, עשויות להעניק עמידות לפתוגנים ולתנאי סביבה שליליים, ועשויות לתרום לסינתזה של תרכובות מועילות לצמח (למשל, גורמי גדילה ופיטוהורמונים אחרים)1,3. אנדופיטים מיקוריזים הם פטריות המקימות קשרים מיקוריזליים עם הצמח, ולוקחות חלק בהעברת חומרים מזינים4. ב Orchidaceae, האינטראקציה עם אנדופיטים mycorrhizal היא בסיסית נביטת זרעים ברוב המכריע של המינים, והתבססות שתילים בכל הצמחים במשפחה5. בהקשרים כאלה, סחלבים מיקוהטרוטרופיים מייצגים מקרה של תלות מוחלטת בבני זוגם המיקוריזליים, שכן הם תלויים בחומרים מזינים מינרליים ובהעברת תרכובות פחמן על ידי פטריות אלה במהלך כל מחזור החיים שלהם6. לכן, בידוד וזיהוי של שיוך פטריות הוא בסיס בסיסי בעת חקירת אסטרטגיות חיים mycoheterotrophic. יתר על כן, מעט ידוע על תפקידם של אנדופיטים פטרייתיים בצמחים מיקוהטרוטרופיים או אפילו על המגוון האמיתי של פטריות אלה 7,8.
חקירת פטריות אנדופיטיות יכולה להתבצע באמצעות טכניקות שונות, המתוארות באופן מסורתי כבלתי תלויות תרבית או תלויות תרבית, למשל: (א) תצפית ישירה, (ב) בידוד פטרייתי וזיהוי מורפולוגי ו/או מולקולרי, ו-(ג) מיצוי דנ”א כולל של רקמות צמחים וזיהוי מולקולרי9. בתצפית ישירה (a), פטריות אנדופיטיות עשויות להיחקר בעודן בפנים תאי צמחים ורקמות על ידי מיקרוסקופ אור או אלקטרונים9, כפי שפרוטוקולי מיקרוסקופיה שונים מפורטים על ידי Pena-Passos et al.10. בשיטות בידוד (b), אנדופיטים פטרייתיים יכולים להיות מאופיינים על פי מושבותיהם, קוריהם ומורפולוגיה של מבנה הרבייה או ההתנגדות שלהם. כמו כן, באמצעות טכניקות בידוד, ניתן לבצע זיהוי מולקולרי של מבודדים באמצעות מיצוי DNA, הגברה של רצפי זיהוי מולקולריים (ברקודים או טביעות אצבע), וריצוף11. הטכניקה האחרונה (c) מאפשרת זיהוי מולקולרי של פטריות אנדופיטיות לכל מיצוי DNA בפנים רקמות הצמח (metabarcoding), ולאחר מכן הכנת ספרייה וריצוף12.
יתר על כן, מבודדים פטרייתיים עשויים להיות מיושמים בניסויי נביטה סימביוטיים, באמצעות זרעים מסחלבים אוטוטרופיים או מיקוהטרוטרופיים. דוגמה ליישום כזה היא החקירה שנערכה על ידי Sisti et al.13, המתארת את הנביטה ואת השלבים הראשונים של התפתחות פרוטוקורם ב- Pogoniopsis schenckii, סחלב מיקוהטרוטרופי, בשיתוף עם חלק מהמבודדים שלו, הכוללים פטריות אנדופיטיות שאינן מיקוריזליות. פרוטוקול הנביטה הסימביוטי היישומי מפורט ומוצג בסרטון של Pena-Passos et al.10. בידוד פטריות בשיתוף עם איברי צמח שונים מאפשר חקירה מגוונת המתמקדת באופי יחסי הגומלין בין צמח לפטריות (למשל, להבין היבטים אקולוגיים או פיזיולוגיים של הקשר, כמו גם חקירת העברת חומרי מזון מפטריות לצמח)9.
המתודולוגיות המוצגות בסעיף 1 מבוססות על אוסף של דגימות איברים תת-קרקעיים, שכן איברים אלה מציגים את הקשיים הרבים ביותר באיסוף, והם בעלי עניין רב מכיוון שהאנדופיטים מיקוריזים מאכלסים אותם. עם זאת, שני הפרוטוקולים הכלולים (שלבים 1.1 ו-1.2) עשויים להיות מיושמים על איברי צמח מיקוהטרוטרופיים אחרים (למשל, קני שורש, גבעולי פרחים ופירות). מתודולוגיית האיסוף המתוארת בשלב 1.1 מיועדת לבידוד פטריות אנדופיטיות (סעיף 2) לאפיון מורפולוגי (סעיפים 4 ו-5) ו/או מיצוי DNA כולל לזיהוי מבודד (סעיף 6). מצד שני, מתודולוגיית האיסוף המתוארת בשלב 1.2 מוקצית באופן בלעדי למיצוי DNA כולל של רקמות צמחים עבור טכניקות metabarcoding (סעיף 7). בסעיף 3 מוצגות ארבע שיטות לאחסון ושימור פטריות נימה, שתיים לאחסון לטווח קצר (3-6 חודשים) והשתיים האחרות מתאימות לאחסון לטווח ארוך (> שנה). האפיון המורפולוגי (סעיפים 4 ו-5) עשוי להיות קשור לזיהוי מולקולרי כדי לחזק אותו ולספק מידע חשוב על מאקרו פטרייתי ומיקרומורפולוגיה. איור 1 מסכם את המתודולוגיות הקולקטיביות שתוארו להלן.
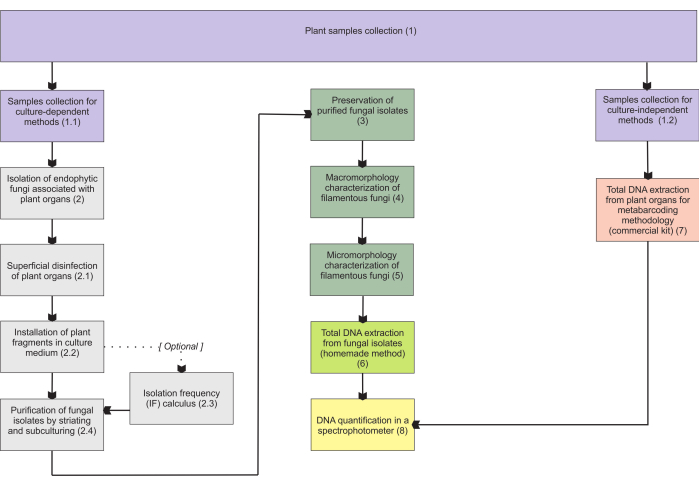
איור 1: סיכום סכמטי של השיטות המוצגות. איסוף צמחים ובידוד פטריות, שימור וזיהוי מולקולרי על ידי מתודולוגיות תלויות תרבות ובלתי תלויות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
Representative Results
Discussion
ההתפשטות השטחית של דגימות צמחים היא אחד השלבים הקריטיים ביותר בפרוטוקול המוצג. רצוי מאוד שלא יהיה זיהום בכלי מחשב כף היד עם טיפות מהשטיפה האחרונה. חיידקים נצפים לעתים קרובות כמזהמים בצלחות הבידוד, בדרך כלל יותר מאשר פטריות נבגים הנישאות באוויר, בהתחשב בכך שחיידקים אנדופיטיים נפוצים גם בר…
Disclosures
The authors have nothing to disclose.
Acknowledgements
אנו מודים למימון של FAPESP (2015/26479-6) ו- CNPq (447453/2014-9). JLSM מודה ל- CNPq על מענקי פרודוקטיביות (303664/2020-7). MPP מודה Capes (מלגת תואר שני, תהליך 88887.600591/2021-00) ו- CNPq.
Materials
| Adhesive tape | (from any company, for adhesive tape mount in micromorphological analyses) | ||
| Ampicillin | Sigma-Aldrich | A5354 | (for installation of plant fragments; other antibiotics may be used – check step 2.2.1) |
| Autoclave | (from any company, for materials sterilization in many steps) | ||
| Bacteriological agar | Sigma-Aldrich | A1296 | (for many steps) |
| C1, C2, C3, C4, C5, and C6 solutions | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Centrifuge | Merck/Eppendorf | 5810 G | (for total DNA extraction from fungal isolates) |
| Centrifuge tubes | Merck | CLS430828 | (for samples collection) |
| Chloroform | Sigma-Aldrich | C2432 | (for total DNA extraction from fungal isolates) |
| Congo red | Supelco | 75768 | (for hyphae staining) |
| Cryotubes | Merck | BR114831 | (for many steps) |
| Ethanol | Supelco | 100983 | It will be necessary to carry out the appropriate dilutions (for many steps) |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 3609 | (for total DNA extraction from fungal isolates) |
| Filter paper | Merck | WHA10010155 | (for many steps) |
| Glass test tubes | Merck | CLS7082516 | (for cryopreservation in unhulled rice grains) |
| Glass wool | Supelco | 20411 | (for cryopreservation in unhulled rice grains) |
| Glucose | Sigma-Aldrich | G8270 | Or dextrose (for cryopreservation in vermiculite) |
| Glycerol | Sigma-Aldrich | G5516 | Or glycerin (for cryopreservation in vermiculite, for preparing LPCB) |
| Isopropanol | Sigma-Aldrich | 563935 | (for total DNA extraction from fungal isolates) |
| Lactic acid | Sigma-Aldrich | 252476 | (for preparing LPCB – hyphae staining) |
| Lactophenol blue solution (LPCB) | Sigma-Aldrich | 61335 | (for hyphae staining) |
| Laminar flow hood | (class I, from any company, for many steps) | ||
| Light microscope | (from any company, for hyphae observation) | ||
| MB Spin Columns | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Methyl blue (cotton blue) | Sigma-Aldrich | M5528 | (for preparing LPCB – hyphae staining) |
| Microcentrifuge tube (1.5 mL) | Merck | HS4323 | (for total DNA extraction from fungal isolates) |
| Microcentrifuge tube (2 mL) | Merck | BR780546 | (for many steps) |
| Mineral oil | (for preservation of fungal isolates) | ||
| Paper bags | Average size 150 mm x 200 mm (for samples collection) | ||
| Petri dish (Glass, 120 mm x 20 mm) | Merck/Pyrex | SLW1480/10D | (autoclavable, for fungi slide culture, prefer higher ones) |
| Petri dish (Glass, 50 mm x 17 mm) | Merck/Aldrich | Z740618 | (for purification of fungal isolates); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Petri dish (Glass, 80 mm x 15 mm) | Merck/Brand | BR455732 | (for installation of plant fragments); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Phenol | Sigma-Aldrich | P1037 | (for total DNA extraction from fungal isolates, for preparing LPCB) |
| Porcelain mortar | Sigma-Aldrich | Z247464 | (for total DNA extraction from fungal isolates) |
| Porcelain pestle | Sigma-Aldrich | Z247502 | (for total DNA extraction from fungal isolates) |
| Potato dextrose agar (PDA) | Millipore | P2182 | (for many steps) |
| PowerBead tubes | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Rapid mounting medium (Entellan) | Sigma-Aldrich | 1.0796 | (for fungi slide culture) |
| Silica gel | Supelco | 717185 | (for cryopreservation in unhulled rice grains) |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | (for total DNA extraction from fungal isolates) |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | Lauryl sulfate sodium salt (for total DNA extraction from fungal isolates) |
| Sodium hypochlorite (w/ 2% active chlorine) | (commercial product, for superficial desinfestation) | ||
| Soil DNA extraction kit (DNeasy PowerSoil kit) | Qiagen | 12888-50 | (for total DNA extraction from plant organs) |
| Spectrophotometer – Nanodrop 2000/2000c | ThermoFisher Scientific | ND2000CLAPTOP | (for total DNA extraction from plant organs) |
| Stereomicroscope | (=dissecting microscope, from any company, for macromorphological analyses) | ||
| Tetracycline | Sigma-Aldrich | T7660 | (for installation of plant fragments) |
| Thermoblock | Merck/Eppendorf | EP5362000035 | (or from other companies) |
| Tissue homogenizer and cell lyzer | SPEX SamplePrep | 2010 Geno/Grinder – Automated Tissue Homogenizer and Cell Lyzer (for total DNA extraction from plant organs) | |
| Toluidine blue O | Sigma-Aldrich/Harleco | 364-M | (for hyphae staining) |
| Trehalose | Sigma-Aldrich | T9531 | (for cryopreservation in vermiculite) |
| Tris Base Solution (Tris) | Sigma-Aldrich | T1699 | (for total DNA extraction from fungal isolates) |
| Unhulled rice grains | (for cryopreservation) | ||
| U-shaped glass rod | (or an adaptation – check step 5.4.1, for fungi slide culture) | ||
| Vermiculite | Fine granulometry (for cryopreservation in vermiculite) | ||
| Vortexer | Sigma-Aldrich/BenchMixer | BMSBV1000 | (for total DNA extraction from fungal isolates) |
| Yeast extract | Sigma-Aldrich | Y1625 | (for cryopreservation in vermiculite) |
References
- de Azevedo, J. L. Endophytic microorganisms. Ecologia Microbiana. , 117-137 (1998).
- Stone, J. K., Bacon, C. W., White, J. F. An overview of endophytic microbes: endophytism defined. Microbial Endophytes. , 17-44 (2000).
- Schulz, B., Boyle, C. What are Endophytes. Microbial Root Endophytes. , 1-13 (2006).
- Smith, S. E., Read, D. J. . Mycorrhizal Symbiosis. , (2008).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Ma, X., Kang, J., Nontachaiyapoom, S., Wen, T., Hyde, K. D. Non-mycorrhizal endophytic fungi from orchids. Current Science. 109 (1), 72-87 (2015).
- Favre-Godal, Q., Gourguillon, L., Lordel-Madeleine, S., Gindro, K., Choisy, P. Orchids and their mycorrhizal fungi: an insufficiently explored relationship. Mycorrhiza. 30 (1), 5-22 (2020).
- Sun, X., Guo, L. -. D. Endophytic fungal diversity: review of traditional and molecular techniques. Mycology. 3 (1), 65-76 (2012).
- Pena-Passos, M., Sisti, L. S., Mayer, J. L. S. Microscopy techniques for interpreting fungal colonization in mycoheterotrophic plants tissues and symbiotic germination of seeds. Journal of Visualized Experiments. (183), e63777 (2022).
- Araújo, W. L., et al. . Endophytic microorganisms: Theoretical and Practical Aspects of Isolation and Characterization. 1st ed. 1, 257 (2014).
- de Souza, R. S. C., et al. Unlocking the bacterial and fungal communities assemblages of sugarcane microbiome. Scientific Reports. 6, 28774 (2016).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Araújo, W. L., et al. Variability and interactions between endophytic bacteria and fungi isolated from leaf tissues of citrus rootstocks. Canadian Journal of Microbiology. 47 (3), 229-236 (2001).
- Castellani, A. Further researches on the long viability and growth of many pathogenic fungi and some bacteria in sterile distilled water. Mycopathologia. 20 (1-2), 1-6 (1963).
- Currah, R. S., Zelmer, C. D., Hambleton, S., Richardson, K. A. Fungi from orchid mycorrhizas. Orchid Biology: Reviews and Perspectives, VII. , 117-170 (1997).
- Freitas, E. F. S., et al. Diversity of mycorrhizal Tulasnella associated with epiphytic and rupicolous orchids from the Brazilian Atlantic Forest, including four new species. Scientific Reports. 10 (1), 7069 (2020).
- Sato, M., Inaba, S., Noguchi, M., Nakagiri, A. Vermiculite as a culture substrate greatly improves the viability of frozen cultures of ectomycorrhizal basidiomycetes. Fungal Biology. 124 (8), 742-751 (2020).
- Pereira, O. L., Kasuya, M. C. M., Borges, A. C., Araújo, E. F. D. Morphological and molecular characterization of mycorrhizal fungi isolated from neotropical orchids in Brazil. Canadian Journal of Botany. 83 (1), 54-65 (2005).
- Riddell, R. W. Permanent stained mycological preparations obtained by slide culture. Mycologia. 42 (2), 265-270 (1950).
- Walsh, T. J., Hayden, R. T., Larone, D. H. . Larone’s Medically Important Fungi: A Guide to Identification. , (2018).
- Microscopy: Chemical Reagents. British Mycological Society Available from: https://www.britmycolsoc.org.uk/field_mycology/microscopy/reagents (2022)
- Senanayake, I. C., et al. Morphological approaches in studying fungi: Collection, examination, isolation, sporulation and preservation. Mycosphere. 11 (1), 2678-2754 (2020).
- Slifkin, M., Cumbie, R. Congo red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Raeder, U., Broda, P. Rapid preparation of DNA from filamentous fungi. Letters in Applied Microbiology. 1 (1), 17-20 (1985).
- Martins, M. K., et al. Molecular characterization of endophytic microorganisms. Endophytic microorganisms: theoretical and practical aspects of isolation and characterization. 1st edition. , 189-211 (2014).
- Rayner, R. W. A Mycological Colour Chart. Commonwealth Mycological Institute. , (1970).
- Kornerup, A., Wanscher, J. H. . Methuen Handbook of Colour. Methuen handbook of colour. , (1967).
- Ridgway, R. . Color Standards and Color Nomenclature. , (1912).
- McGinnis, M. R. . Laboratory Handbook of Medical Mycology. , (2012).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sridharan, G., Shankar, A. A. Toluidine blue: A review of its chemistry and clinical utility. Journal of Oral and Maxillofacial Pathology. 16 (2), 251-255 (2012).
- Smith, D., Onions, A. H. S. A comparison of some preservation techniques for fungi. Transactions of the British Mycological Society. 81 (3), 535-540 (1983).
- Ryan, M. J., Smith, D., Jeffries, P. A decision-based key to determine the most appropriate protocol for the preservation of fungi. World Journal of Microbiology and Biotechnology. 16 (2), 183-186 (2000).
- Lalaymia, I., Cranenbrouck, S., Declerck, S. Maintenance and preservation of ectomycorrhizal and arbuscular mycorrhizal fungi. Mycorrhiza. 24 (5), 323-337 (2014).
- Zettler, L. W., Corey, L. L. Orchid mycorrhizal fungi: isolation and identification techniques. Orchid Propagation: From Laboratories to Greenhouses-Methods and Protocols. , 27-59 (2018).
- Yu, S., Wang, Y., Li, X., Yu, F., Li, W. The factors affecting the reproducibility of micro-volume DNA mass quantification in Nanodrop 2000 spectrophotometer. Optik. 145, 555-560 (2017).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Schoch, C. L., et al. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi. Proceedings of the National Academy of Sciences. 109 (16), 6241-6246 (2012).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols: A Guide to Methods and Applications. 18 (1), 315-322 (1990).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proceedings of the National Academy of Sciences. 74 (12), 5463-5467 (1977).
- Ranjard, L., et al. Characterization of bacterial and fungal soil communities by automated ribosomal intergenic spacer analysis fingerprints: biological and methodological variability. Applied and Environmental Microbiology. 67 (10), 4479-4487 (2001).
- Metzker, M. L. Sequencing technologies-the next generation. Nature Reviews Genetics. 11 (1), 31-46 (2010).

