Mikoheterotrofik Bitkilerde Endofitik Mantarları Tanımlamak için İzolasyon, Karakterizasyon ve Toplam DNA Ekstraksiyonu
Summary
Bu makale, bitki ilişkili endofitik mantarların izolasyonu, izolatların uzun süreli korunması, morfolojik karakterizasyon ve sonraki moleküler tanımlama ve metagenomik analizler için toplam DNA ekstraksiyonu için ayrıntılı ve yeterli protokoller sağlamayı amaçlamaktadır.
Abstract
Mikoheterotrofik bitkiler, ototrofik kapasitelerini tamamen kaybetmiş, mikorizal bağımlılığın en aşırı biçimlerinden birini sunar. Diğer hayati kaynaklar kadar önemli olan bu bitkilerin yakından ilişkili olduğu mantarlar onlar için çok önemlidir. Bu nedenle, mikoheterotrofik türlerin incelenmesinde en uygun tekniklerden bazıları, özellikle köklerde ve yeraltı organlarında yaşayanlar olmak üzere, ilişkili mantarların araştırılmasını sağlayan tekniklerdir. Bu bağlamda, kültüre bağımlı ve kültürden bağımsız endofitik mantarların tanımlanması için teknikler yaygın olarak uygulanmaktadır. Mantar endofitlerinin izole edilmesi, onları morfolojik olarak tanımlamak, çeşitliliklerini analiz etmek ve orkide tohumlarının simbiyotik çimlenmesindeki uygulamalar için aşılamayı korumak için bir araç sağlar. Bununla birlikte, bitki dokularında yaşayan çok çeşitli kültürlenemeyen mantarların olduğu bilinmektedir. Bu nedenle, kültürden bağımsız moleküler tanımlama teknikleri, tür çeşitliliği ve bolluğunun daha geniş bir kapsamını sunar. Bu makale, kültüre bağlı ve bağımsız olmak üzere iki soruşturma prosedürünü başlatmak için gerekli metodolojik desteği sağlamayı amaçlamaktadır. Kültüre bağlı protokol ile ilgili olarak, mikoheterotrofik bitkilerin yeraltı ve hava organlarından filamentli mantarların izole edilmesi, izolatların bir koleksiyonunun tutulması, slayt kültürü metodolojisi ile hiflerin morfolojik olarak karakterize edilmesi ve toplam DNA ekstraksiyonu ile mantarların moleküler olarak tanımlanması ile birlikte, toplama alanlarından laboratuvar tesislerine bitki örneklerinin toplanması ve muhafaza edilmesi süreçleri detaylandırılmıştır. Kültürden bağımsız metodolojileri kapsayan ayrıntılı prosedürler, metagenomik analizler için bitki örneklerinin toplanmasını ve ticari bir kit kullanılarak klorofilli bitki organlarından toplam DNA ekstraksiyonunu içerir. Son olarak, analizler için süreklilik protokolleri (örneğin, polimeraz zincir reaksiyonu [PCR], dizileme) de önerilmektedir ve teknikler burada sunulmaktadır.
Introduction
Endofitik mantarlar, tanım gereği, göze çarpmayan enfeksiyonlarda (yani konakçılarına zarar vermeden) bitki organlarının ve dokularının iç kısımlarında yaşayan mantarlardır1,2. Bu mantarlar, konukçu bitkilerle nötr veya faydalı bir şekilde etkileşime girebilir, patojenlere ve elverişsiz çevre koşullarına karşı direnç sağlayabilir ve bitki için faydalı bileşiklerin (örneğin, büyüme faktörleri ve diğer fitohormonlar) sentezine katkıda bulunabilir1,3. Mikorizal endofitler, bitki ile mikorizal ilişkiler kuran ve besin transferinde yer alan mantarlardır4. Orchidaceae’de, mikorizal endofitlerle etkileşim, türlerin büyük çoğunluğunda tohum çimlenmesi ve ailedeki tüm bitkilerde fide oluşumu için temeldir5. Bu bağlamlarda, mikoheterotrofik orkideler, tüm yaşam döngüleri boyunca bu mantarlar tarafından mineral besinlere ve karbon bileşikleri transferine bağlı olduklarından, mikorizal partnerlerine karşı tam bir bağımlılık durumunu temsil eder6. Bu nedenle, ilişkili mantarların izolasyonu ve tanımlanması, mikoheterotrofik yaşam stratejilerini araştırırken temel bir temeldir. Ayrıca, mikoheterotrofik bitkilerde mantar endofitlerinin rolleri ve hatta bu mantarların gerçek çeşitliliği hakkında çok az şey bilinmektedir 7,8.
Endofitik mantarların araştırılması, geleneksel olarak kültürden bağımsız veya bağımlı olarak tanımlanan farklı tekniklerle gerçekleştirilebilir, örneğin: (a) doğrudan gözlem, (b) mantar izolasyonu ve morfolojik ve/veya moleküler tanımlama ve (c) bitki dokularının toplam DNA ekstraksiyonu ve moleküler tanımlama9. Doğrudan gözlemde (a), endofitik mantarlar, bitki hücrelerinin ve dokularının iç kısmındayken ışık veya elektron mikroskobu9 ile araştırılabilir, çünkü farklı mikroskopi protokolleri Pena-Passos ve ark.10 tarafından detaylandırılmıştır. İzolasyon yöntemleri (b) ile mantar endofitleri kolonilerine, hiflerine ve üreme veya direnç yapısı morfolojisine göre karakterize edilebilir. Ayrıca, izolasyon teknikleri ile , DNA ekstraksiyonu, moleküler tanımlama dizilerinin (barkodlar veya parmak izleri) amplifikasyonu ve dizileme yoluyla izolatların moleküler tanımlamasını yapmak mümkündür11. İkinci teknik (c), bitki dokularının iç kısmındayken (metabarkodlama) DNA ekstraksiyonu başına endofitik mantarların moleküler olarak tanımlanmasını ve ardından kütüphane hazırlığı ve dizilenmesinisağlar 12.
Ayrıca, mantar izolatları, ototrofik veya mikoheterotrofik orkidelerden elde edilen tohumlar kullanılarak simbiyotik çimlenme denemelerinde uygulanabilir. Böyle bir uygulamanın bir örneği, Sisti ve ark.13 tarafından yürütülen ve mikorizal olmayan endofitik mantarlar içeren bazı izolatları ile birlikte mikoheterotrofik bir orkide olan Pogoniopsis schenckii’de çimlenmeyi ve protokorm gelişiminin ilk aşamalarını tanımlayan araştırmadır. Uygulanan simbiyotik çimlenme protokolü detaylandırılmıştır ve Pena-Passos ve ark.10 tarafından bir videoda sunulmuştur. Mantarların farklı bitki organlarıyla birlikte izole edilmesi, bitki-mantar etkileşimlerinin doğası ile ilgili çeşitli araştırma odaklarına izin verir (örneğin, ilişkinin ekolojik veya fizyolojik yönlerini anlamak ve ayrıca mantarlardan bitkiye besin transferine ilişkin araştırmaları anlamak)9.
Bölüm 1’de sunulan metodolojiler, yeraltı organ örneklerinin toplanmasına dayanmaktadır, çünkü bu organlar toplamada en fazla zorluğu ortaya çıkarmaktadır ve mikorizal endofitler onları kolonize ettiği için büyük ilgi görmektedir. Bununla birlikte, dahil edilen her iki protokol de (adım 1.1 ve 1.2) diğer mikoheterotrofik bitki organlarına (örneğin, rizomlar, çiçek sapları ve meyveler) uygulanabilir. Adım 1.1’de açıklanan toplama metodolojisi, morfolojik karakterizasyon (bölüm 4 ve 5) için endofitik mantarların (bölüm 2) izole edilmesi ve/veya izolat tanımlaması için toplam DNA ekstraksiyonu (bölüm 6) için belirlenmiştir. Öte yandan, adım 1.2’de açıklanan toplama metodolojisi, yalnızca metabarkodlama teknikleri için bitki dokularının toplam DNA ekstraksiyonuna atanır (bölüm 7). Bölüm 3’te, filamentli mantarların depolanması ve korunması için, ikisi kısa süreli depolama (3-6 ay) ve diğer ikisi uzun süreli depolama (>1 yıl) için yeterli olmak üzere dört yöntem sunulmaktadır. Morfolojik karakterizasyon (bölüm 4 ve 5), onu güçlendirmek ve mantar makro ve mikromorfolojisi hakkında önemli bilgiler sağlamak için moleküler tanımlama ile ilişkilendirilebilir. Şekil 1 , bundan sonra açıklanan kolektif metodolojileri özetlemektedir.
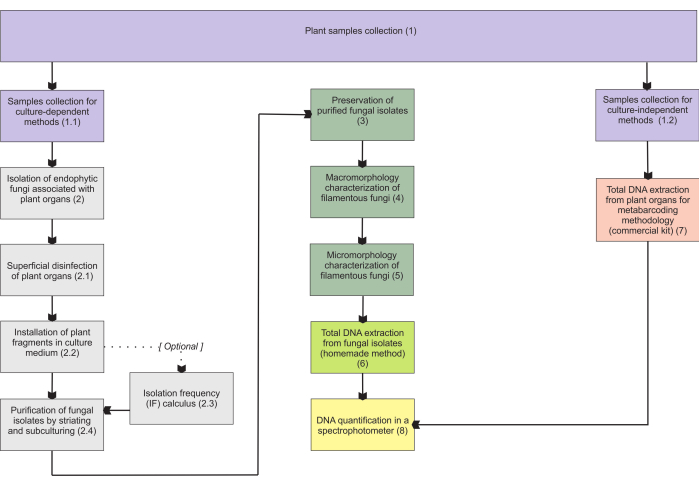
Şekil 1: Sunulan yöntemlerin şematik özeti. Bitki toplama ve mantar izolasyonu, muhafazası ve kültüre bağlı ve bağımsız metodolojilerle moleküler tanımlama. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Bitki örneklerinin yüzeysel olarak dezenfekte edilmesi, sunulan protokoldeki en kritik aşamalardan biridir. PDA bulaşıklarında son yıkamadan damla damla ile kirlenme olmaması çok arzu edilir. Endofitik bakterilerin bitki dokularında da yaygın olduğu göz önüne alındığında, bakteriler genellikle havadaki sporlu mantarlardan daha fazla olmak üzere, izolasyon kaplarında kirletici olarak sıklıkla gözlenir 3,11. Bu nedenle, organ parçalarını …
Disclosures
The authors have nothing to disclose.
Acknowledgements
FAPESP (2015/26479-6) ve CNPq (447453/2014-9) tarafından sağlanan fonlara teşekkür ederiz. JLSM, üretkenlik hibeleri için CNPq’ya teşekkür eder (303664/2020-7). MPP, Capes’e (yüksek lisans bursu, süreç 88887.600591/2021-00) ve CNPq’ye teşekkür eder.
Materials
| Adhesive tape | (from any company, for adhesive tape mount in micromorphological analyses) | ||
| Ampicillin | Sigma-Aldrich | A5354 | (for installation of plant fragments; other antibiotics may be used – check step 2.2.1) |
| Autoclave | (from any company, for materials sterilization in many steps) | ||
| Bacteriological agar | Sigma-Aldrich | A1296 | (for many steps) |
| C1, C2, C3, C4, C5, and C6 solutions | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Centrifuge | Merck/Eppendorf | 5810 G | (for total DNA extraction from fungal isolates) |
| Centrifuge tubes | Merck | CLS430828 | (for samples collection) |
| Chloroform | Sigma-Aldrich | C2432 | (for total DNA extraction from fungal isolates) |
| Congo red | Supelco | 75768 | (for hyphae staining) |
| Cryotubes | Merck | BR114831 | (for many steps) |
| Ethanol | Supelco | 100983 | It will be necessary to carry out the appropriate dilutions (for many steps) |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 3609 | (for total DNA extraction from fungal isolates) |
| Filter paper | Merck | WHA10010155 | (for many steps) |
| Glass test tubes | Merck | CLS7082516 | (for cryopreservation in unhulled rice grains) |
| Glass wool | Supelco | 20411 | (for cryopreservation in unhulled rice grains) |
| Glucose | Sigma-Aldrich | G8270 | Or dextrose (for cryopreservation in vermiculite) |
| Glycerol | Sigma-Aldrich | G5516 | Or glycerin (for cryopreservation in vermiculite, for preparing LPCB) |
| Isopropanol | Sigma-Aldrich | 563935 | (for total DNA extraction from fungal isolates) |
| Lactic acid | Sigma-Aldrich | 252476 | (for preparing LPCB – hyphae staining) |
| Lactophenol blue solution (LPCB) | Sigma-Aldrich | 61335 | (for hyphae staining) |
| Laminar flow hood | (class I, from any company, for many steps) | ||
| Light microscope | (from any company, for hyphae observation) | ||
| MB Spin Columns | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Methyl blue (cotton blue) | Sigma-Aldrich | M5528 | (for preparing LPCB – hyphae staining) |
| Microcentrifuge tube (1.5 mL) | Merck | HS4323 | (for total DNA extraction from fungal isolates) |
| Microcentrifuge tube (2 mL) | Merck | BR780546 | (for many steps) |
| Mineral oil | (for preservation of fungal isolates) | ||
| Paper bags | Average size 150 mm x 200 mm (for samples collection) | ||
| Petri dish (Glass, 120 mm x 20 mm) | Merck/Pyrex | SLW1480/10D | (autoclavable, for fungi slide culture, prefer higher ones) |
| Petri dish (Glass, 50 mm x 17 mm) | Merck/Aldrich | Z740618 | (for purification of fungal isolates); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Petri dish (Glass, 80 mm x 15 mm) | Merck/Brand | BR455732 | (for installation of plant fragments); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Phenol | Sigma-Aldrich | P1037 | (for total DNA extraction from fungal isolates, for preparing LPCB) |
| Porcelain mortar | Sigma-Aldrich | Z247464 | (for total DNA extraction from fungal isolates) |
| Porcelain pestle | Sigma-Aldrich | Z247502 | (for total DNA extraction from fungal isolates) |
| Potato dextrose agar (PDA) | Millipore | P2182 | (for many steps) |
| PowerBead tubes | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Rapid mounting medium (Entellan) | Sigma-Aldrich | 1.0796 | (for fungi slide culture) |
| Silica gel | Supelco | 717185 | (for cryopreservation in unhulled rice grains) |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | (for total DNA extraction from fungal isolates) |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | Lauryl sulfate sodium salt (for total DNA extraction from fungal isolates) |
| Sodium hypochlorite (w/ 2% active chlorine) | (commercial product, for superficial desinfestation) | ||
| Soil DNA extraction kit (DNeasy PowerSoil kit) | Qiagen | 12888-50 | (for total DNA extraction from plant organs) |
| Spectrophotometer – Nanodrop 2000/2000c | ThermoFisher Scientific | ND2000CLAPTOP | (for total DNA extraction from plant organs) |
| Stereomicroscope | (=dissecting microscope, from any company, for macromorphological analyses) | ||
| Tetracycline | Sigma-Aldrich | T7660 | (for installation of plant fragments) |
| Thermoblock | Merck/Eppendorf | EP5362000035 | (or from other companies) |
| Tissue homogenizer and cell lyzer | SPEX SamplePrep | 2010 Geno/Grinder – Automated Tissue Homogenizer and Cell Lyzer (for total DNA extraction from plant organs) | |
| Toluidine blue O | Sigma-Aldrich/Harleco | 364-M | (for hyphae staining) |
| Trehalose | Sigma-Aldrich | T9531 | (for cryopreservation in vermiculite) |
| Tris Base Solution (Tris) | Sigma-Aldrich | T1699 | (for total DNA extraction from fungal isolates) |
| Unhulled rice grains | (for cryopreservation) | ||
| U-shaped glass rod | (or an adaptation – check step 5.4.1, for fungi slide culture) | ||
| Vermiculite | Fine granulometry (for cryopreservation in vermiculite) | ||
| Vortexer | Sigma-Aldrich/BenchMixer | BMSBV1000 | (for total DNA extraction from fungal isolates) |
| Yeast extract | Sigma-Aldrich | Y1625 | (for cryopreservation in vermiculite) |
References
- de Azevedo, J. L. Endophytic microorganisms. Ecologia Microbiana. , 117-137 (1998).
- Stone, J. K., Bacon, C. W., White, J. F. An overview of endophytic microbes: endophytism defined. Microbial Endophytes. , 17-44 (2000).
- Schulz, B., Boyle, C. What are Endophytes. Microbial Root Endophytes. , 1-13 (2006).
- Smith, S. E., Read, D. J. . Mycorrhizal Symbiosis. , (2008).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Ma, X., Kang, J., Nontachaiyapoom, S., Wen, T., Hyde, K. D. Non-mycorrhizal endophytic fungi from orchids. Current Science. 109 (1), 72-87 (2015).
- Favre-Godal, Q., Gourguillon, L., Lordel-Madeleine, S., Gindro, K., Choisy, P. Orchids and their mycorrhizal fungi: an insufficiently explored relationship. Mycorrhiza. 30 (1), 5-22 (2020).
- Sun, X., Guo, L. -. D. Endophytic fungal diversity: review of traditional and molecular techniques. Mycology. 3 (1), 65-76 (2012).
- Pena-Passos, M., Sisti, L. S., Mayer, J. L. S. Microscopy techniques for interpreting fungal colonization in mycoheterotrophic plants tissues and symbiotic germination of seeds. Journal of Visualized Experiments. (183), e63777 (2022).
- Araújo, W. L., et al. . Endophytic microorganisms: Theoretical and Practical Aspects of Isolation and Characterization. 1st ed. 1, 257 (2014).
- de Souza, R. S. C., et al. Unlocking the bacterial and fungal communities assemblages of sugarcane microbiome. Scientific Reports. 6, 28774 (2016).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Araújo, W. L., et al. Variability and interactions between endophytic bacteria and fungi isolated from leaf tissues of citrus rootstocks. Canadian Journal of Microbiology. 47 (3), 229-236 (2001).
- Castellani, A. Further researches on the long viability and growth of many pathogenic fungi and some bacteria in sterile distilled water. Mycopathologia. 20 (1-2), 1-6 (1963).
- Currah, R. S., Zelmer, C. D., Hambleton, S., Richardson, K. A. Fungi from orchid mycorrhizas. Orchid Biology: Reviews and Perspectives, VII. , 117-170 (1997).
- Freitas, E. F. S., et al. Diversity of mycorrhizal Tulasnella associated with epiphytic and rupicolous orchids from the Brazilian Atlantic Forest, including four new species. Scientific Reports. 10 (1), 7069 (2020).
- Sato, M., Inaba, S., Noguchi, M., Nakagiri, A. Vermiculite as a culture substrate greatly improves the viability of frozen cultures of ectomycorrhizal basidiomycetes. Fungal Biology. 124 (8), 742-751 (2020).
- Pereira, O. L., Kasuya, M. C. M., Borges, A. C., Araújo, E. F. D. Morphological and molecular characterization of mycorrhizal fungi isolated from neotropical orchids in Brazil. Canadian Journal of Botany. 83 (1), 54-65 (2005).
- Riddell, R. W. Permanent stained mycological preparations obtained by slide culture. Mycologia. 42 (2), 265-270 (1950).
- Walsh, T. J., Hayden, R. T., Larone, D. H. . Larone’s Medically Important Fungi: A Guide to Identification. , (2018).
- Microscopy: Chemical Reagents. British Mycological Society Available from: https://www.britmycolsoc.org.uk/field_mycology/microscopy/reagents (2022)
- Senanayake, I. C., et al. Morphological approaches in studying fungi: Collection, examination, isolation, sporulation and preservation. Mycosphere. 11 (1), 2678-2754 (2020).
- Slifkin, M., Cumbie, R. Congo red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Raeder, U., Broda, P. Rapid preparation of DNA from filamentous fungi. Letters in Applied Microbiology. 1 (1), 17-20 (1985).
- Martins, M. K., et al. Molecular characterization of endophytic microorganisms. Endophytic microorganisms: theoretical and practical aspects of isolation and characterization. 1st edition. , 189-211 (2014).
- Rayner, R. W. A Mycological Colour Chart. Commonwealth Mycological Institute. , (1970).
- Kornerup, A., Wanscher, J. H. . Methuen Handbook of Colour. Methuen handbook of colour. , (1967).
- Ridgway, R. . Color Standards and Color Nomenclature. , (1912).
- McGinnis, M. R. . Laboratory Handbook of Medical Mycology. , (2012).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sridharan, G., Shankar, A. A. Toluidine blue: A review of its chemistry and clinical utility. Journal of Oral and Maxillofacial Pathology. 16 (2), 251-255 (2012).
- Smith, D., Onions, A. H. S. A comparison of some preservation techniques for fungi. Transactions of the British Mycological Society. 81 (3), 535-540 (1983).
- Ryan, M. J., Smith, D., Jeffries, P. A decision-based key to determine the most appropriate protocol for the preservation of fungi. World Journal of Microbiology and Biotechnology. 16 (2), 183-186 (2000).
- Lalaymia, I., Cranenbrouck, S., Declerck, S. Maintenance and preservation of ectomycorrhizal and arbuscular mycorrhizal fungi. Mycorrhiza. 24 (5), 323-337 (2014).
- Zettler, L. W., Corey, L. L. Orchid mycorrhizal fungi: isolation and identification techniques. Orchid Propagation: From Laboratories to Greenhouses-Methods and Protocols. , 27-59 (2018).
- Yu, S., Wang, Y., Li, X., Yu, F., Li, W. The factors affecting the reproducibility of micro-volume DNA mass quantification in Nanodrop 2000 spectrophotometer. Optik. 145, 555-560 (2017).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Schoch, C. L., et al. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi. Proceedings of the National Academy of Sciences. 109 (16), 6241-6246 (2012).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols: A Guide to Methods and Applications. 18 (1), 315-322 (1990).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proceedings of the National Academy of Sciences. 74 (12), 5463-5467 (1977).
- Ranjard, L., et al. Characterization of bacterial and fungal soil communities by automated ribosomal intergenic spacer analysis fingerprints: biological and methodological variability. Applied and Environmental Microbiology. 67 (10), 4479-4487 (2001).
- Metzker, M. L. Sequencing technologies-the next generation. Nature Reviews Genetics. 11 (1), 31-46 (2010).

