التعبير عن سايتوكين خارجي في زينوغرافتس المشتقة من المريض عن طريق الحقن مع خط الخلايا ستتروكين ترانسدوسد انسجة
Summary
وصف هنا هو وسيلة لإنتاج السيتوكينات الخارجية في الطعم أجنبي المستمدة المريض (بدكس) الفئران عن طريق الحقن داخل الصفاق الأسبوعي للخلايا الخلوية ترانزدوسد خط الخلايا. هذا الأسلوب يوسع فائدة بدكس ويوفر خيار عابرة أو متواصلة تسليم السيتوكينات الخارجية في العديد من النماذج بدكس.
Abstract
يتم إنتاج طعم أجنبي المستمدة المريض (بدكس) الفئران عن طريق زرع الخلايا البشرية إلى الفئران المناعية ناقصة. هذه النماذج هي أداة هامة لدراسة آليات الدم و الخبيث الطبيعي و هي المعيار الذهبي لتحديد العلاج الكيميائي الفعال لكثير من الأورام الخبيثة. نماذج بدكس ممكنة لأن العديد من السيتوكينات الماوس تعمل أيضا على الخلايا البشرية. ومع ذلك، هذا ليس هو الحال بالنسبة لجميع السيتوكينات، بما في ذلك العديد التي تعتبر حاسمة لدراسة تكون الدم الطبيعي والخبيث في الخلايا البشرية. التقنيات التي مهندس الفئران لإنتاج السيتوكينات البشرية (المعدلة وراثيا وتدق في نماذج) تتطلب نفقات كبيرة قبل فائدة من هذا النموذج وقد ثبت. تقنيات أخرى هي كثيفة العمالة (حقن السيتوكين المؤتلف أو العدوى) وفي بعض الحالات تتطلب مستويات عالية من الخبرة التقنية (حقن هيدروديناميكي من الحمض النووي). ويصف هذا التقرير طريقة بسيطة لتوليد الفئران بدكس التي لها سيان الإنسان الخارجيةتوكين (تسلب، الليمفاوية اللحمية الغدة الصعترية) عن طريق الحقن داخل الصفاق الأسبوعي من سدى التي تم ترانزدوسد إلى أوفيركسريس هذا السيتوكين. استخدام هذا الأسلوب يوفر في الجسم الحي مصدر إنتاج السيتوكينات المستمر الذي يحقق مستويات فسيولوجية تعميم السيتوكين الإنسان في الماوس. مستويات البلازما من السيتوكينات البشرية يمكن أن تختلف على أساس عدد من الخلايا اللحمية حقن، ويمكن البدء في إنتاج السيتوكينات في أي نقطة في التجربة. وتشمل هذه الطريقة أيضا سيتوكين سلبية الفئران السيطرة التي تنتج بالمثل، ولكن من خلال الحقن داخل الصفاق من سدى ترانزدوسد مع ناقلات التحكم. لقد أثبتنا سابقا أن خلايا اللوكيميا التي تحصد من تسلب معربا عن بدكس، بالمقارنة مع بدكس السيطرة، يحمل نمط التعبير الجيني أشبه عينة المريض الأصلي. معا تنتج السيتوكين والفئران بدكس السيتوكين السلبية التي تنتجها هذه الطريقة توفير نظام نموذج التي استخدمناها بنجاح لدراسةدور تسلب في تكون الدم الطبيعي والخبيث.
Introduction
زينوغرافتس المشتقة من المريض (بدكس) هي قوية في نموذج الجسم الحي لدراسة إنتاج الخلايا المكونة للدم والخبيثة في بيئة الثدييات "الأم". في معظم الأحيان، يتم إنتاج بدكس عن طريق حقن أو زرع الخلايا البشرية في الفئران المناعية نقص المناعة. إنتاج بدكس باستخدام الخلايا الجذعية البشرية المكونة للدم يسمح في الدراسات المجراة من الدم البشري العادي وتطوير الخلايا المناعية. بدكس تنتج من سرطان الدم أو الخلايا السرطانية الأخرى تجعل من الممكن لدراسة الآليات الجينية وتحديد العلاجات الفعالة في سياق مجموعة من المناظر الطبيعية والطفرات الوراثية الموجودة في السكان. 1 ونتيجة لذلك، بدكس هي المعيار الذهب الحالي للبحوث الطبية الحيوية متعدية لتحديد العلاجات الفعالة وأداة هامة لفهم آليات تطور السرطان. نماذج بدكس هي أداة أساسية للمساعدة في البحث في الأمراض الفوارق الصحية بسبب محددة الآفات الجينية، أو أي مرض حيث التغيرات في المشهد الجيني للمريض يمكن أن تسهم إلى حد كبير في تكوين الأورام ونتائج العلاج.
ماوس الإنسان بدكس نماذج ممكنة لأن العديد من السيتوكينات الماوس تقليد بما فيه الكفاية نظائرها الإنسان في تفعيل مستقبلات السيتوكين من الخلايا البشرية بينما هم داخل الماوس. على سبيل المثال، انترلوكين 7 (إيل-7) يوفر إشارة حاسمة لتطوير الخلايا البشرية B. 2 في هذه الحالة، الماوس إيل-7 لديه التماثل كافية مع الإنسان إيل-7 أن السيتوكين الماوس يحفز مسارات الإشارات في السلائف الخلية B الإنسان. 2 ، 3 ، 4 ومع ذلك، هذا ليس هو الحال بالنسبة اللمفاوية اللحمية الغدة الصعترية (تسلب)، 5 ، 6 والتي من بين السيتوكينات الأخرى (إيل-3، المحببة بلعم مستعمرة عامل تحفيز (غم-كسف)، عامل الخلايا الجذعية (سف) ،ريف "> 7 مهم لإنتاج الخلايا المكونة للدم الطبيعية والخبيثة، وعندما تظهر الفئران والسيتوكينات البشرية منخفضة التماثل السيتوكينات الماوس لا تنشيط مستقبلات كل منها على الخلايا البشرية.لتغلب على هذه العقبة، وقد تم استخدام عدد من الاستراتيجيات لتهريب السيتوكينات البشرية في الفئران بدكس، وتشمل حقن السيتوكينات البشرية المؤتلف، والحقن الهيدروديناميكي من الحمض النووي، والتعبير لنتيفيرال، التعبير المعدلة وراثيا واستبدال الجنين نوكين 7 يصف هذا التقرير طريقة للهندسة بدكس لإنتاج السيتوكين البشري عن طريق بوساطة اللحمية تسليم السيتوكينات ( الشكل 1 ).
في الطريقة الموضحة هنا، صممت الفئران بدكس للتعبير عن السيتوكين البشري، تسلب، أو بمثابة الضوابط السلبية سيتوكين. يتم تحقيق تسلب معربا عن بدكس عن طريق الحقن داخل الصفاق أسبوعيا من الخلايا اللحمية التي تم ترانزدوسد للتعبير عن مستويات عالية من تسلب الإنسان.يتم هندسة السيتوكين سلبية بدكس "السيطرة" الفئران بالمثل؛ على الرغم من ترانسدوسد سدى التحكم مع ناقلات التحكم. هذا الأسلوب يحقق المستويات الفسيولوجية الطبيعية من تسلب الإنسان في الفئران بدكس حقن مع تسلب + سدى. لا لوحظ تسلب قابل للكشف في الفئران بدكس تلقي سدى خلوى سلبية. اخترنا خط الخلايا انسجة الإنسان هس-27A لدراستنا لأنه ينمو بقوة في الثقافة ويظهر مستوى منخفض جدا من إنتاج السيتوكينات التي لا تدعم انتشار الخلايا الاصلية معزولة في كوكولتوريس. 8 لتعبير الإنسان تسلب، تم ترانزدوسد سدى مع الجيل المتقدم ناقلات لنتيفيرال الذاتي تعطيل مشتقة من العمود الفقري وصفها سابقا، 9 ويشمل عنصر كبت / كتس وعنصر وودشوك التهاب الكبد بعد النسخي التنظيمي (وري) لزيادة التعبير التحوير. تم بناء جين تسلب البشري في هذا المتجه تحت سيطرة عامل استطالة -1(إف-1) ألفا المروج لتحقيق قوية، التأسيسية، والتعبير على المدى الطويل.
هندسة هذا الإنسان سيتوكين تعزيز نموذج بدكس يتكون من 4 خطوات رئيسية. أولا، يتم توسيع سدى ترانزدوسد في المختبر وتقييمها من قبل مقايسة المناعي المرتبط الانزيم (إليسا) لإنتاج مستقر، مستوى عال سيتوكين. ثانيا، يتم التحقق من نشاط سيتوكين الإنسان التي تنتجها الخلايا انسجة ترانسدوسد (وعدم وجود نشاط السيتوكين من سدى السيطرة) باستخدام التدفق الخلوي الفوسفو. خطوط الخلايا المعروفة بأنها تستجيب للسيتوكين من الفائدة (في هذه الحالة، تسلب) وتحضن مع طاف الخلايا اللحمية ومعايرة لالفسفرة الناجم عن السيتوكين. ثالثا، يتم حقن الفئران مع سدى الإنسان ترانسدوسد ثم يتم تقييم البلازما الماوس من قبل إليسا لمستويات سيتوكين الإنسان على أساس أسبوعي. رابعا، يتم زرع الخلايا المكونة للدم البشرية ويتم تقييم الآثار الوظيفية في الجسم الحي من السيتوكين البشري على هدف معروف ( <em> مثال. السكان الخلية).
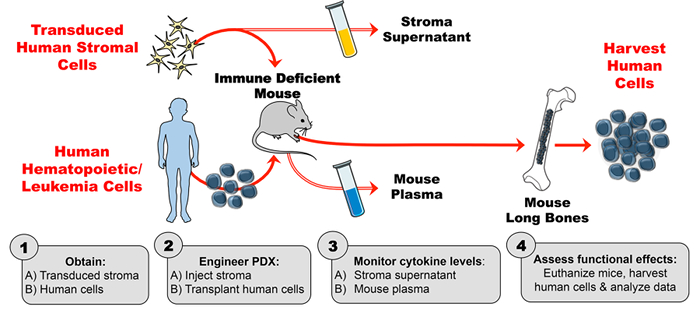
الشكل 1: نموذج بدكس هندسيا لإنتاج سايتوكين الإنسان الخارجية في الفئران. ( 1A ) تجربة التصميم والحصول على خلايا انسجة الإنسان ترانسدوسد ( 1B ) الحصول على خلايا الإنسان (الخلايا الجذعية المكونة للدم، وخلايا اللوكيميا، وما إلى ذلك ) لتوليد بدكس (المستمدة المريض طعم أجنبي) الفئران. ( 2A ) حقن سدى المهندسة و ( 2B ) زرع الخلايا البشرية في الفئران نقص المناعة وفقا الجدول الزمني التجريبي. ( 3A-B ) رصد تركيزات السيتوكينات في طاف سدى والبلازما الماوس من قبل إليسا. ( 4 ) حصاد الخلايا البشرية وتقييم الآثار الوظيفية في الجسم الحي من السيتوكين الإنسان الحاضر في بدكس. الرجاء الضغط هنالعرض نسخة أكبر من هذا الرقم.
تسليم السيتوكينات البشرية عن طريق الخلايا اللحمية تقدم كل من مزايا وعيوب بالمقارنة مع طرق أخرى لتقديم / إنتاج السيتوكينات البشرية في الفئران بدكس. 7 بالمقارنة مع حقن السيتوكين الإنسان المؤتلف، والتسليم بوساطة سدى عادة ما تكون أقل تكلفة (تكلفة زراعة الخلايا اللحمية هو أقل من تكلفة السيتوكين المؤتلف) وأقل كثافة اليد العاملة (حقنة واحدة في الأسبوع مقابل حقن متعددة في الأسبوع). كما يتم تخفيف مسألة قصيرة العمر الخلوي السيتوكين منذ سدى تنتج باستمرار السيتوكين خارجي. تسليم السيتوكين عن طريق الحقن الهيدروديناميكي من الحمض النووي قد تكون أقل تكلفة من التسليم عن طريق سدى. ومع ذلك، فإنه هو عابرة على نحو مماثل، وقد تتطلب مهارة فنية أكثر من الحقن البريتوني أسبوعي بسيط المطلوبة للتسليم بوساطة سدى. لنتيفيرال التعبير الجيني في الماوس قد توفر أقل ترانسينت طريقة تسليم السيتوكينات؛ ومع ذلك، في أيدينا لم تتحقق مستويات تسلب الفسيولوجية. بالإضافة إلى ذلك، هذا الأسلوب هو كثيفة العمالة، مما يتطلب إنتاج مستمر من ناقلات لنتيفيرال. المعدلة وراثيا أو تدق في الفئران عرض مستقر التعبير على المدى الطويل من السيتوكينات ويمكن هندستها للتعبير معين الأنسجة، والتي يمكن أن تكون ميزة. من ناحية أخرى، فإن التعبير المعدلة وراثيا للجين السيتوكين البشري على الخلفية الماوس نقص المناعة المطلوبة لفئران بدكس، يستلزم استثمارا هائلا من الموارد قبل أن يتم إنشاء قيمة النموذج. وعلاوة على ذلك، نماذج المعدلة وراثيا لا تسمح عموما لخيار تغيير توقيت بدء سيتوكين أو مستوى في إنتاج سيتوكين الجسم الحي . ويمكن تحقيق هذه مع تسليم بوساطة سدى ببساطة عن طريق تغيير نقطة زمنية لبدء حقن الخلايا اللحمية أو جرعة من خلايا انسجة حقن.
الخلايا اللحمية بوساطة سيتوكين تسليم ميثأود مفصلة هنا استخدمت لتطوير بدكس لتقييم دور تسلب في الإنسان العادي B التنمية الخلايا 4 و 6 وخطورة عالية B- خلية سرطان الدم الليمفاوي الحاد. 6 هذا الأسلوب يوفر وسيلة بديلة السيتوكين التسليم لاستخدامها في توليد نماذج مماثلة مع السيتوكينات البشرية الأخرى من تسلب. هذا النموذج يمكن أيضا أن تكون مفيدة لتوليد البيانات الأولية التي يمكن أن تساعد في تحديد ما إذا كانت قيمة السيتوكين المعدلة وراثيا أو السيتوكين تدق في نموذج بدكس سيكون جديرة من الوقت والاستثمار المال.
Protocol
Representative Results
Discussion
تصف هذه المخطوطة طريقة بسيطة وسريعة وفعالة نسبيا من حيث التكلفة للهندسة بدكس للتعبير عن السيتوكين البشري الخارجي. وتستند الاستراتيجية الموصوفة هنا على الحقن داخل الصفاق الأسبوعي من خط الخلايا اللحمية ترانزدوسد للتعبير عن السيتوكين البشري، تسلب. قبل تنفيذ الطرق ال?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by NIH R21CA162259, NIH R01CA209829, NIH P20 MD006988, NIH 2R25 GM060507, a Hyundai Hope on Wheels Scholar Hope Grant, the Department of Pathology and Human Anatomy, the Department of Basic Sciences, and the Center for Health Disparities and Molecular Medicine at Loma Linda University School of Medicine and by a Grant to Promote Collaborative and Translational Research from Loma Linda University (KJP). The content is solely the responsibility of the authors and does not necessarily represent the official views of the NIH.
Materials
| Wet lab reagents | |||
| T-25 Nunc Cell Culture Treated EasYFlasks, 7 mL capacity, 25cm² culture area | Thermo Scientific / Fisher | 156367 | |
| T-75 Falcon Tissue Culture Treated Flask, 250 mL capacity, 75 cm² culture area & vented cap | Corning Inc. / Fisher | 353136 | |
| T-150 Falcon Tissue Culture Treated Flask, 600 mL capacity, 150 cm² culture area & vented cap | Corning Inc. / Fisher | 355001 | |
| 10 mL serological pipettes | Falcon | 357551 | |
| 15 mL polypropylene conical tubes | Fisher | 05-539-12 | |
| 5 mL round-bottom polystyrene tubes | Falcon | 352054 | |
| 50 mL polypropylene conical tubes | Falcon | 352098 | |
| 2.0 mL cryogenic vials, externally threaded | Corning Inc. / Fisher | 4230659 | |
| 1 mL pipette tips | Fisher | 2707509 | |
| 200 μL pipette tips | Denville Scientific | P3020-CPS | |
| 10 μL pipette tips | Denville Scientific | P-1096-CP | |
| Sterile Disposable Filter Units with SFCA Membrane, Nalgene Rapid-Flow | Fisher | 09-740-28D | |
| 2N H2SO4 | BioLegend | 423001 | |
| Dulbecco’s phosphate-buffered saline (PBS) without calicium and magnesium, 1× | Corning cellgro/ Mediatech | 21-031-CV | |
| Human TSLP ELISA Max Deluxe Set | BioLegend | 434204 | |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies | 7060 | |
| Trypan Blue | Corning | 25-900-Cl | |
| "Trypsin" 1x 0.25% Trypsin 2.21 mM EDTA in HBSS | ThermoFisher | 25-053 | |
| TWEEN 20 BioXtra | Sigma-Aldrich | P-7949 | |
| “R10” cell culture medium, % of total volume (makes 565 mL) | – | – | Lab Recipe |
| RPMI, 88.5% (500 mL) | Mediatech | 10-040-CV | |
| FBS, 9.9% (56 mL) | Mediatech | 35-011-CV | |
| L-Glutamine, 0.99% (5.6 mL) | Mediatech | 25-005-Cl | |
| Penicillin-Streptomycin, 0.50% (2.8 mL) | Mediatech | 30-002-Cl | |
| 2-Mercaptoethanol, 0.10% (560 µL) | MP | 190242 | |
| “R20” cell culture medium, % of total volume (makes 195 mL) | – | – | Lab Recipe |
| RPMI, 76.84% (150 mL) | see above | see above | |
| FBS, 20.49% (40 mL) | see above | see above | |
| 2mM L-glutamine, 1.02% (2 mL) | see above | see above | |
| 1mM Na pyruvate, 1.02% (2 mL ) | see above | see above | |
| Penicillin-Streptomycin, 0.51% (1 mL) | see above | see above | |
| 2-Mercaptoethanol, 0.10% (0.1 M), 0.10% (200 µL) | see above | see above | |
| “Freezing medium”, % of total volume | – | – | Lab Recipe |
| “R10” medium, 45% | see "R10" recipe | – | |
| FBS, 20% | see above | 35-011-CV | |
| DMSO, 10% | Corning | 25-950-CQC | |
| D(-)(+)-Trehalose dihydrate, 5% | Fisher Scientific | BP2687-100 | |
| Name | Company | Catolog Number | Comments |
| Biologics | |||
| "HS-27" HS-27A human stroma line | ATCC | CRL-2496 | |
| "CALL-4" MHH-CALL-4 cell line, human B cell precursor leukemia | DSMZ | ACC 337 | |
| “NSG mice” NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, male or female, age 6 – 8 weeks | JAX Mice | # 005557 | |
| MUTZ-5 cell line, human B cell precursor leukemia | DSMZ | ACC 490 | |
| Recombinant Human TSLP protein | R&D Systems | 1398-TS-010 | |
| Name | Company | Catolog Number | Comments |
| Flow cytomery antibodies (clone)* | |||
| Anti-mouse CD45 FITC (30F11) | Miltenyi Biotec | 130-102-778 | |
| CD127 PE (MB15-18C9) (alternate name is IL-7Rα) | Miltenyi Biotec | 130-098-094 | |
| CD34 APC (8G12) | BD Biosciences | 340667 | |
| CD45 PE-Cy7 (HI30) | eBioscience | 25-0459 | |
| "FVD" Fixable viability dye eFluor 780 | eBioscience | 65-0865 | |
| Ig κ light chain FITC (G20-193) | BD Pharmingen | 555791 | |
| Ig λ light chain FITC (JDC-12) | BD Pharmingen | 561379 | |
| IgD PE (IA6-2) | BioLegend | 348203 | |
| IgM PE-Cy5 (G20-127) | BD Biosciences | 551079 | |
| pSTAT5 PE, mouse anti-STAT5 (pY694) | BD PhosphoFlow | 612567 | |
| Name | Company | Catolog Number | Comments |
| Other materials & equipment | |||
| Animal Implantable Nano Transponder with Canula | Trovan | ID-100B(1.25) | |
| EMLA lidocaine anesthetic cream (obtain by presciption through animal care facility) | perscription | perscription | |
| BD ½ cc LO-DOSE U-100 Insulin Syringe 28G½ | BD | #329461 | |
| BD Microtainer Tubes with K2EDTA | BD | #365974 | |
| Centrifuge | Beckman Coulter | Alegra X-15R | |
| FisherBrand Capillary Tubes (Heparinized) | Fisher Scientific | 22-260-950 | |
| Hemocytometer | Fisher | 02-671-6 | |
| MACSQuant Analyzer 10 | Miltenyi Biotec | 130-096-343 | |
| Mouse Pie Cage | Braintree Scientific, Inc. | MPC-1 | |
| Mouse Tail Illuminator Restrainer | Braintree Scientific, Inc. | MTI STD | |
| Pistol Grip Implanter | Trovan | IM-300(1.25) | |
| µQuant | Bio-Tek Instruments Inc. | MQX200 | |
| FlowJo flow cytometry analysis software | FlowJo, LLC | Version 10 | |
| *All antibodies are anti-human unless otherwise stated. |
References
- Francis, O. L., Milford, T. A., Beldiman, C., Payne, K. J. Fine-tuning patient-derived xenograft models for precision medicine approaches in leukemia. J Investig Med. 64 (3), 740-744 (2016).
- Parrish, Y. K., et al. IL-7 Dependence in human B lymphopoiesis increases during progression of ontogeny from cord blood to bone marrow. J Immunol. 182 (7), 4255-4266 (2009).
- Johnson, S. E., Shah, N., Panoskaltsis-Mortari, A., LeBien, T. W. Murine and human IL-7 activate STAT5 and induce proliferation of normal human pro-B cells. J Immunol. 175 (11), 7325-7331 (2005).
- Milford, T. A., et al. TSLP or IL-7 provide an IL-7Ralpha signal that is critical for human B lymphopoiesis. Eur J Immunol. 46 (9), 2155-2161 (2016).
- Reche, P. A., et al. Human thymic stromal lymphopoietin preferentially stimulates myeloid cells. J Immunol. 167 (1), 336-343 (2001).
- Francis, O. L., et al. A novel xenograft model to study the role of TSLP-induced CRLF2 signals in normal and malignant human B lymphopoiesis. Haematologica. 101 (4), 417-426 (2016).
- Willinger, T., Rongvaux, A., Strowig, T., Manz, M. G., Flavell, R. A. Improving human hemato-lymphoid-system mice by cytokine knock-in gene replacement. Trends Immunol. 32 (7), 321-327 (2011).
- Graf, L., Iwata, M., Torok-Storb, B. Gene expression profiling of the functionally distinct human bone marrow stromal cell lines HS-5 and HS-27a. Blood. 100 (4), 1509-1511 (2002).
- Follenzi, A., Ailles, L. E., Bakovic, S., Geuna, M., Naldini, L. Gene transfer by lentiviral vectors is limited by nuclear translocation and rescued by HIV-1 pol sequences. Nat Genet. 25 (2), 217-222 (2000).
- Li, M., Husic, N., Lin, Y., Snider, B. J. Production of lentiviral vectors for transducing cells from the central nervous system. J Vis Exp. (63), e4031 (2012).
- Cockrell, A. S., Kafri, T. Gene delivery by lentivirus vectors. Mol Biotechnol. 36 (3), 184-204 (2007).
- Ricardo, R., Phelan, K. Freezing, thawing, and packaging cells for transport. J Vis Exp. (17), (2008).
- Tasian, S. K., et al. Aberrant STAT5 and PI3K/mTOR pathway signaling occurs in human CRLF2-rearranged B-precursor acute lymphoblastic leukemia. Blood. 120 (4), 833-842 (2012).
- Kalaitzidis, D., Neel, B. G. Flow-cytometric phosphoprotein analysis reveals agonist and temporal differences in responses of murine hematopoietic stem/progenitor cells. PLoS One. 3 (11), (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. (67), (2012).
- Kovacsics, D., Raper, J. Transient expression of proteins by hydrodynamic gene delivery in mice. J Vis Exp. (87), (2014).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Pearson, T., Greiner, D. L., Shultz, L. D. Chapter 15, Creation of "humanized" mice to study human immunity. Curr Protoc Immunol. , (2008).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. J Vis Exp. (17), (2008).
- Scheeren, F. A., et al. Thymic stromal lymphopoietin induces early human B-cell proliferation and differentiation. Eur J Immunol. 40 (4), 955-965 (2010).
- Lee, E. B., et al. Increased serum thymic stromal lymphopoietin in children with atopic dermatitis. Pediatr Allergy Immunol. 21 (2 Pt 2), e457-e460 (2010).

