Expresión de citoquina exógena en los xenoinjertos derivados del paciente mediante inyección con una línea de células estromales transducidas por citoquinas
Summary
Se describe aquí un método para producir citoquina exógena en ratones de xenoinjerto derivados de pacientes (PDX) mediante inyección intraperitoneal semanal de una línea celular de estroma transducida por citoquinas. Este método amplía la utilidad de PDX y proporciona la opción para el suministro transitorio o sostenido de citoquinas exógenas en una multitud de modelos PDX.
Abstract
Los ratones de xenoinjerto derivados de pacientes (PDX) se producen trasplantando células humanas en ratones inmunodeficientes. Estos modelos son una herramienta importante para el estudio de los mecanismos de la hematopoyesis normal y maligna y son el estándar de oro para la identificación de quimioterapia eficaz para muchos tumores malignos. PDX modelos son posibles porque muchas de las citoquinas de ratón también actúan sobre las células humanas. Sin embargo, este no es el caso para todas las citocinas, incluyendo muchas que son críticas para el estudio de la hematopoyesis normal y maligna en las células humanas. Técnicas que ingenieros ratones para producir citoquinas humanas (transgénicos y knock-in modelos) requieren un gasto significativo antes de la utilidad del modelo se ha demostrado. Otras técnicas son intensivas en mano de obra (inyección de citocinas recombinantes o lentivirus) y en algunos casos requieren altos niveles de experiencia técnica (inyección hidrodinámica de ADN). Este informe describe un método simple para la generación de ratones PDX que tienen células humanas exógenasTokina (TSLP, linfopoyetina estromal tímica) mediante inyección intraperitoneal semanal de estroma que se han transducido para sobreexpresar esta citocina. El uso de este método proporciona una fuente in vivo de producción continua de citoquinas que alcanza los niveles fisiológicos de citoquina humana circulante en el ratón. Los niveles plasmáticos de citoquina humana se pueden variar basándose en el número de células estromales inyectadas, y la producción de citoquinas puede iniciarse en cualquier punto del experimento. Este método también incluye ratones de control negativos a citoquinas que se producen de manera similar, pero a través de inyección intraperitoneal de estroma transducido con un vector de control. Hemos demostrado previamente que las células de leucemia recolectadas de PDX que expresa TSLP, en comparación con el control de PDX, muestran un patrón de expresión génica más parecido a la muestra original del paciente. Conjuntamente, los ratones PDX productores de citoquinas y negativos a citoquinas producidos por este método proporcionan un sistema modelo que hemos utilizado con éxito para estudiar laPapel de TSLP en hematopoyesis normal y maligna.
Introduction
Los xenoinjertos derivados de los pacientes (PDX) son un poderoso modelo in vivo para estudiar la producción de células hematopoyéticas normales y malignas en un medio mamífero "nativo". La mayoría de las veces, PDX se producen inyectando o trasplantando células humanas en ratones inmunodeficientes. La producción de PDX usando células madre hematopoyéticas humanas normales permite estudios in vivo de la sangre humana normal y el desarrollo de células inmunes. El PDX producido a partir de leucemia u otras células cancerosas hace posible estudiar mecanismos oncogénicos e identificar terapias eficaces en el contexto de la gama de paisajes genéticos y mutaciones presentes en la población humana. 1 Por lo tanto, PDX son el patrón oro actual para la investigación biomédica traslacional para identificar terapias eficaces y una herramienta importante para comprender los mecanismos de progresión del cáncer. Los modelos PDX son una herramienta esencial para ayudar a la investigación de enfermedades de disparidades de salud Lesiones genéticas o cualquier enfermedad en la que las variaciones del paisaje genético de un paciente puedan contribuir sustancialmente a la oncogénesis y los resultados del tratamiento.
Ratón-humano PDX modelos son posibles porque muchas citoquinas de ratón adecuadamente imitar sus análogos humanos en la activación de los receptores de citoquinas de las células humanas mientras están dentro del ratón. Por ejemplo, la interleucina-7 (IL-7) proporciona una señal crítica para el desarrollo de células B humanas. 2 En este caso, IL-7 de ratón tiene homología suficiente con IL-7 humana que la citoquina de ratón estimula vías de señalización en precursores de células B humanas. Sin embargo, este no es el caso de la linfopoyetina estromal tímica (TSLP) 5 , 6 que entre otras citoquinas (IL-3, factor estimulante de colonias de granulocitos-macrófagos (GM-CSF), factor de células madre (SCF) ,Ref "> 7 es importante para la producción de células hematopoyéticas humanas normales y malignas Cuando las citoquinas humanas y de ratón muestran una baja homología, las citoquinas de ratón no activan sus respectivos receptores en células humanas Para superar este obstáculo se han utilizado varias estrategias Para diseñar la expresión de citoquinas humanas en ratones PDX.Estos incluyen la inyección de citoquinas humanas recombinantes, la inyección hidrodinámica de ADN, la expresión lentiviral, la expresión transgénica y la sustitución del gen knockin.7 Este informe describe un método para la ingeniería de PDX para producir citoquinas humanas a través de la medicación estromal Cytokine entrega ( Figura 1 ].
En el método demostrado aquí, los ratones PDX son modificados genéticamente para expresar la citoquina humana, TSLP, o para servir como controles de citoquinas negativas. Los PDX que expresan TSLP se consiguen mediante inyecciones intraperitoneales semanales de células estromales que se han transducido para expresar niveles elevados de TSLP humana.Los ratones "control" de PDX negativos para citoquinas están diseñados de forma similar; Aunque el estroma de control se transduce con un vector de control. Este método logra niveles fisiológicos normales de TSLP humano en ratones PDX inyectados con el estroma TSLP +. No se observa TSLP detectable en ratones PDX que reciben el estroma negativo de citoquina. Hemos seleccionado la línea de células estromales humanas HS-27A para nuestros estudios, ya que crece fuertemente en el cultivo y muestra muy bajo nivel de producción de citoquinas que no apoya la proliferación de células progenitoras aisladas en cocultures. 8 Para la expresión de TSLP humano, el estroma se transdujo con un vector lentiviral autoinactivante de generación avanzada derivado de un esqueleto previamente descrito 9 , e incluye el elemento cPPT / cts y el elemento regulador post-transcripcional de hepatitis de la marmota (WPRE) para aumentar la expresión del transgén. El gen TSLP humano se construyó en este vector bajo el control del factor de elongación-1(EF-1) para conseguir una expresión robusta, constitutiva y de largo plazo.
La ingeniería de este modelo PDX humano-citocina mejorada consta de 4 pasos principales. Primero, el estroma transducido se expande in vitro y se evalúa mediante el ensayo de inmunoabsorción enzimática (ELISA) para una producción de citoquinas estable y de alto nivel. En segundo lugar, se verifica la actividad de la citoquina humana producida por las células estromales transducidas (y la falta de actividad de citoquinas del estroma de control) usando citometría de flujo fosfórico. Las líneas celulares conocidas por ser sensibles a citoquinas de interés (en este caso, TSLP) se incuban con sobrenadante de células estromales y se ensayan para la fosforilación inducida por citoquinas. En tercer lugar, los ratones se inyectan con estroma humano transducido y luego el plasma de ratón se evalúa por ELISA para los niveles de citoquina humana sobre una base semanal. Cuarto, las células hematopoyéticas humanas se transplantan y los efectos funcionales in vivo de la citoquina humana se evalúan sobre un objetivo conocido ( <em> Por ejemplo. Población de células).
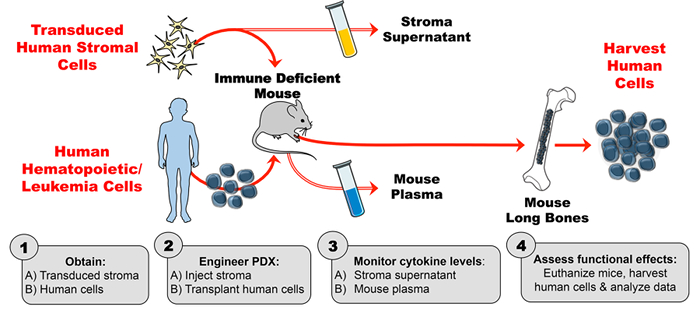
Figura 1: Modelo PDX diseñado para producir citoquina humana exógena en ratones. ( 1B ) Obtención de células humanas (células madre hematopoyéticas, células leucémicas, etc. ) para generar ratones PDX (xenoinjerto derivado del paciente). ( 2A ) Inyectar el estroma de ingeniería y ( 2B ) transplantar células humanas en ratones inmunodeficientes según el programa experimental. ( 3A-B ) Monitorear las concentraciones de citoquinas en el sobrenadante de estroma y el plasma de ratón mediante ELISA. ( 4 ) Cosecha de células humanas y evaluar los efectos funcionales in vivo de la citocina humana presente en el PDX. Haga clic aquíPara ver una versión más grande de esta figura.
La administración de citoquinas humanas a través de células estromales ofrece ventajas y desventajas cuando se compara con otros métodos de liberación / producción de citoquinas humanas en ratones PDX. Comparado con la inyección de citoquina humana recombinante, el parto mediado por estroma es generalmente menos costoso (el costo del cultivo de células estromales es menor que el costo de la citocina recombinante) y menos intensivo de mano de obra (una inyección por semana versus múltiples inyecciones por semana). La cuestión de la vida media de citoquinas corto también se mitiga ya que el estroma produce continuamente la citoquina exógena. La administración de citoquina mediante inyección hidrodinámica de ADN puede ser menos costosa que la administración a través del estroma. Sin embargo, es similarmente transitorio y puede requerir más habilidad técnica que la simple inyección intraperitoneal semanal requerida para la administración mediada por estroma. La expresión del gen lentiviral en el ratón puedeNsient método de entrega de citoquinas; Sin embargo, en nuestras manos no se lograron niveles fisiológicos de TSLP. Además, este método es de mano de obra intensiva, que requiere la producción continua de vector lentiviral. Ratones transgénicos o knock-in ofrecen expresión a largo plazo estable de citoquina y pueden ser diseñados para la expresión específica de tejido, lo que puede ser una ventaja. Por otra parte, la expresión transgénica del gen de citoquina humana en el fondo de ratón inmunodeficiente requerido para ratones PDX, requiere una inmensa inversión de recursos antes de que se haya establecido el valor del modelo. Además, los modelos transgénicos generalmente no permiten la opción de variar el tiempo de iniciación de citoquinas o el nivel de producción de citoquinas in vivo . Estos pueden lograrse con la administración mediada por estroma simplemente cambiando el punto de tiempo para la iniciación de la inyección de células estromales o la dosis de células estromales inyectadas.
El método de suministro de citocinas mediado por células estromalesOd detallado aquí se utilizó para desarrollar PDX para evaluar el papel de TSLP en el desarrollo de células B humanas normales 4 , 6 y de alto riesgo de células B leucemia linfoblástica aguda. 6 Este método proporciona un método alternativo de administración de citoquinas para su uso en la generación de modelos similares con citocinas humanas distintas de TSLP. Este modelo también puede ser útil para generar datos preliminares que pueden ayudar a determinar si el valor de una citoquina transgénica o citoquina knock-in PDX modelo sería digno de la inversión de tiempo y dinero sustancial.
Protocol
Representative Results
Discussion
Este manuscrito describe un método simple, rápido y relativamente rentable para la ingeniería de PDX para expresar la citoquina humana exógena. La estrategia descrita aquí se basa en inyecciones intraperitoneales semanales de una línea celular de estroma transducida para expresar la citocina humana, TSLP. Antes de realizar los métodos descritos aquí, se generó estroma manipulado para expresar altos niveles de la citoquina de interés (TSLP) y estroma control controlado de forma similar. En los protocolos presen…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by NIH R21CA162259, NIH R01CA209829, NIH P20 MD006988, NIH 2R25 GM060507, a Hyundai Hope on Wheels Scholar Hope Grant, the Department of Pathology and Human Anatomy, the Department of Basic Sciences, and the Center for Health Disparities and Molecular Medicine at Loma Linda University School of Medicine and by a Grant to Promote Collaborative and Translational Research from Loma Linda University (KJP). The content is solely the responsibility of the authors and does not necessarily represent the official views of the NIH.
Materials
| Wet lab reagents | |||
| T-25 Nunc Cell Culture Treated EasYFlasks, 7 mL capacity, 25cm² culture area | Thermo Scientific / Fisher | 156367 | |
| T-75 Falcon Tissue Culture Treated Flask, 250 mL capacity, 75 cm² culture area & vented cap | Corning Inc. / Fisher | 353136 | |
| T-150 Falcon Tissue Culture Treated Flask, 600 mL capacity, 150 cm² culture area & vented cap | Corning Inc. / Fisher | 355001 | |
| 10 mL serological pipettes | Falcon | 357551 | |
| 15 mL polypropylene conical tubes | Fisher | 05-539-12 | |
| 5 mL round-bottom polystyrene tubes | Falcon | 352054 | |
| 50 mL polypropylene conical tubes | Falcon | 352098 | |
| 2.0 mL cryogenic vials, externally threaded | Corning Inc. / Fisher | 4230659 | |
| 1 mL pipette tips | Fisher | 2707509 | |
| 200 μL pipette tips | Denville Scientific | P3020-CPS | |
| 10 μL pipette tips | Denville Scientific | P-1096-CP | |
| Sterile Disposable Filter Units with SFCA Membrane, Nalgene Rapid-Flow | Fisher | 09-740-28D | |
| 2N H2SO4 | BioLegend | 423001 | |
| Dulbecco’s phosphate-buffered saline (PBS) without calicium and magnesium, 1× | Corning cellgro/ Mediatech | 21-031-CV | |
| Human TSLP ELISA Max Deluxe Set | BioLegend | 434204 | |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies | 7060 | |
| Trypan Blue | Corning | 25-900-Cl | |
| "Trypsin" 1x 0.25% Trypsin 2.21 mM EDTA in HBSS | ThermoFisher | 25-053 | |
| TWEEN 20 BioXtra | Sigma-Aldrich | P-7949 | |
| “R10” cell culture medium, % of total volume (makes 565 mL) | – | – | Lab Recipe |
| RPMI, 88.5% (500 mL) | Mediatech | 10-040-CV | |
| FBS, 9.9% (56 mL) | Mediatech | 35-011-CV | |
| L-Glutamine, 0.99% (5.6 mL) | Mediatech | 25-005-Cl | |
| Penicillin-Streptomycin, 0.50% (2.8 mL) | Mediatech | 30-002-Cl | |
| 2-Mercaptoethanol, 0.10% (560 µL) | MP | 190242 | |
| “R20” cell culture medium, % of total volume (makes 195 mL) | – | – | Lab Recipe |
| RPMI, 76.84% (150 mL) | see above | see above | |
| FBS, 20.49% (40 mL) | see above | see above | |
| 2mM L-glutamine, 1.02% (2 mL) | see above | see above | |
| 1mM Na pyruvate, 1.02% (2 mL ) | see above | see above | |
| Penicillin-Streptomycin, 0.51% (1 mL) | see above | see above | |
| 2-Mercaptoethanol, 0.10% (0.1 M), 0.10% (200 µL) | see above | see above | |
| “Freezing medium”, % of total volume | – | – | Lab Recipe |
| “R10” medium, 45% | see "R10" recipe | – | |
| FBS, 20% | see above | 35-011-CV | |
| DMSO, 10% | Corning | 25-950-CQC | |
| D(-)(+)-Trehalose dihydrate, 5% | Fisher Scientific | BP2687-100 | |
| Name | Company | Catolog Number | Comments |
| Biologics | |||
| "HS-27" HS-27A human stroma line | ATCC | CRL-2496 | |
| "CALL-4" MHH-CALL-4 cell line, human B cell precursor leukemia | DSMZ | ACC 337 | |
| “NSG mice” NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, male or female, age 6 – 8 weeks | JAX Mice | # 005557 | |
| MUTZ-5 cell line, human B cell precursor leukemia | DSMZ | ACC 490 | |
| Recombinant Human TSLP protein | R&D Systems | 1398-TS-010 | |
| Name | Company | Catolog Number | Comments |
| Flow cytomery antibodies (clone)* | |||
| Anti-mouse CD45 FITC (30F11) | Miltenyi Biotec | 130-102-778 | |
| CD127 PE (MB15-18C9) (alternate name is IL-7Rα) | Miltenyi Biotec | 130-098-094 | |
| CD34 APC (8G12) | BD Biosciences | 340667 | |
| CD45 PE-Cy7 (HI30) | eBioscience | 25-0459 | |
| "FVD" Fixable viability dye eFluor 780 | eBioscience | 65-0865 | |
| Ig κ light chain FITC (G20-193) | BD Pharmingen | 555791 | |
| Ig λ light chain FITC (JDC-12) | BD Pharmingen | 561379 | |
| IgD PE (IA6-2) | BioLegend | 348203 | |
| IgM PE-Cy5 (G20-127) | BD Biosciences | 551079 | |
| pSTAT5 PE, mouse anti-STAT5 (pY694) | BD PhosphoFlow | 612567 | |
| Name | Company | Catolog Number | Comments |
| Other materials & equipment | |||
| Animal Implantable Nano Transponder with Canula | Trovan | ID-100B(1.25) | |
| EMLA lidocaine anesthetic cream (obtain by presciption through animal care facility) | perscription | perscription | |
| BD ½ cc LO-DOSE U-100 Insulin Syringe 28G½ | BD | #329461 | |
| BD Microtainer Tubes with K2EDTA | BD | #365974 | |
| Centrifuge | Beckman Coulter | Alegra X-15R | |
| FisherBrand Capillary Tubes (Heparinized) | Fisher Scientific | 22-260-950 | |
| Hemocytometer | Fisher | 02-671-6 | |
| MACSQuant Analyzer 10 | Miltenyi Biotec | 130-096-343 | |
| Mouse Pie Cage | Braintree Scientific, Inc. | MPC-1 | |
| Mouse Tail Illuminator Restrainer | Braintree Scientific, Inc. | MTI STD | |
| Pistol Grip Implanter | Trovan | IM-300(1.25) | |
| µQuant | Bio-Tek Instruments Inc. | MQX200 | |
| FlowJo flow cytometry analysis software | FlowJo, LLC | Version 10 | |
| *All antibodies are anti-human unless otherwise stated. |
References
- Francis, O. L., Milford, T. A., Beldiman, C., Payne, K. J. Fine-tuning patient-derived xenograft models for precision medicine approaches in leukemia. J Investig Med. 64 (3), 740-744 (2016).
- Parrish, Y. K., et al. IL-7 Dependence in human B lymphopoiesis increases during progression of ontogeny from cord blood to bone marrow. J Immunol. 182 (7), 4255-4266 (2009).
- Johnson, S. E., Shah, N., Panoskaltsis-Mortari, A., LeBien, T. W. Murine and human IL-7 activate STAT5 and induce proliferation of normal human pro-B cells. J Immunol. 175 (11), 7325-7331 (2005).
- Milford, T. A., et al. TSLP or IL-7 provide an IL-7Ralpha signal that is critical for human B lymphopoiesis. Eur J Immunol. 46 (9), 2155-2161 (2016).
- Reche, P. A., et al. Human thymic stromal lymphopoietin preferentially stimulates myeloid cells. J Immunol. 167 (1), 336-343 (2001).
- Francis, O. L., et al. A novel xenograft model to study the role of TSLP-induced CRLF2 signals in normal and malignant human B lymphopoiesis. Haematologica. 101 (4), 417-426 (2016).
- Willinger, T., Rongvaux, A., Strowig, T., Manz, M. G., Flavell, R. A. Improving human hemato-lymphoid-system mice by cytokine knock-in gene replacement. Trends Immunol. 32 (7), 321-327 (2011).
- Graf, L., Iwata, M., Torok-Storb, B. Gene expression profiling of the functionally distinct human bone marrow stromal cell lines HS-5 and HS-27a. Blood. 100 (4), 1509-1511 (2002).
- Follenzi, A., Ailles, L. E., Bakovic, S., Geuna, M., Naldini, L. Gene transfer by lentiviral vectors is limited by nuclear translocation and rescued by HIV-1 pol sequences. Nat Genet. 25 (2), 217-222 (2000).
- Li, M., Husic, N., Lin, Y., Snider, B. J. Production of lentiviral vectors for transducing cells from the central nervous system. J Vis Exp. (63), e4031 (2012).
- Cockrell, A. S., Kafri, T. Gene delivery by lentivirus vectors. Mol Biotechnol. 36 (3), 184-204 (2007).
- Ricardo, R., Phelan, K. Freezing, thawing, and packaging cells for transport. J Vis Exp. (17), (2008).
- Tasian, S. K., et al. Aberrant STAT5 and PI3K/mTOR pathway signaling occurs in human CRLF2-rearranged B-precursor acute lymphoblastic leukemia. Blood. 120 (4), 833-842 (2012).
- Kalaitzidis, D., Neel, B. G. Flow-cytometric phosphoprotein analysis reveals agonist and temporal differences in responses of murine hematopoietic stem/progenitor cells. PLoS One. 3 (11), (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. (67), (2012).
- Kovacsics, D., Raper, J. Transient expression of proteins by hydrodynamic gene delivery in mice. J Vis Exp. (87), (2014).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Pearson, T., Greiner, D. L., Shultz, L. D. Chapter 15, Creation of "humanized" mice to study human immunity. Curr Protoc Immunol. , (2008).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. J Vis Exp. (17), (2008).
- Scheeren, F. A., et al. Thymic stromal lymphopoietin induces early human B-cell proliferation and differentiation. Eur J Immunol. 40 (4), 955-965 (2010).
- Lee, E. B., et al. Increased serum thymic stromal lymphopoietin in children with atopic dermatitis. Pediatr Allergy Immunol. 21 (2 Pt 2), e457-e460 (2010).

