Espressione di citochine esogene in Xenografts derivati da pazienti mediante iniezione con una linea cellulare stromalica trasdotta a citocina
Summary
Di seguito è descritto un metodo per produrre citochine esogene nei topi xenograft (PDX) derivanti dal paziente mediante iniezione intraperitoneale settimanale di una linea cellulare stromale trasfusa da citochine. Questo metodo amplia l'utilità di PDX e fornisce l'opzione per la consegna transiente o sostenuta della citochine esogena in una moltitudine di modelli PDX.
Abstract
I topi xenograft (PDX) derivati dal paziente vengono prodotti trapiantando le cellule umane in topi immunitari deficienti. Questi modelli sono uno strumento importante per studiare i meccanismi di ematuria normale e maligna e sono il gold standard per identificare le chemioterapie efficaci per molte malattie maligne. I modelli PDX sono possibili perché molte delle citochine del mouse agiscono anche sulle cellule umane. Tuttavia, questo non è il caso di tutte le citochine, tra cui molti che sono critici per lo studio di ematuria normale e maligna nelle cellule umane. Le tecniche che ingegneranno i topi per produrre citochine umane (modelli transgenici e knock-in) richiedono una significativa spesa prima che sia stata dimostrata l'utilità del modello. Altre tecniche sono labor intensive (iniezione di citochine ricombinanti o lentivirus) e in alcuni casi richiedono elevati livelli di competenza tecnica (iniezione idrodinamica del DNA). Questo rapporto descrive un metodo semplice per la generazione di topi PDX che presentano una via umana esogenaTokine (TSLP, linfopoietina stromale stromico) mediante iniezione intraperitoneale settimanale di stroma che sono state trasdotte per sovraespressione di questa citochina. L'uso di questo metodo fornisce una sorgente in vivo di produzione continua di citochine che raggiunge livelli fisiologici della citochina umana circolante nel topo. I livelli plasmatici della citochina umana possono essere variati in base al numero di cellule stromali iniettate e la produzione di citochine può essere avviata in qualsiasi punto dell'esperimento. Questo metodo comprende anche i topi di controllo negativo di citochine che sono prodotti analogamente, ma attraverso l'iniezione intraperitoneale di stroma trasfusa con un vettore di controllo. Abbiamo dimostrato in precedenza che le cellule di leucemia raccolte da PDL che esprimono TSLP, rispetto al controllo PDX, presentano un modello di espressione genica più simile al campione originale del paziente. Insieme i topi PDX produttori e citochine-negativi prodotti da questo metodo forniscono un sistema di modello che abbiamo utilizzato con successo per studiareRuolo del TSLP in ematuria normale e maligna.
Introduction
I xenografts derivati da pazienti (PDX) sono un potente modello in vivo per studiare la produzione di cellule ematopoietiche normali e maligne in un ambiente mammifero nativo. Più spesso, PDX è prodotto produrre iniettando o trapiantando le cellule umane in topi immunitari deficienti. La produzione di PDX utilizzando normali cellule staminali ematopoietiche umane consente studi in vivo di sangue umano normale e sviluppo di cellule immunitarie. PDX prodotto da leucemia o da altre cellule tumorali consente di studiare meccanismi oncogeni e di identificare terapie efficaci nel contesto della gamma di paesaggi genetici e mutazioni presenti nella popolazione umana. 1 Di conseguenza, PDX è l'attuale standard oro per la ricerca biomedica di traduzioni per identificare terapie efficaci e un importante strumento per comprendere i meccanismi della progressione del cancro. I modelli PDX sono uno strumento essenziale per aiutare la ricerca sulle disparità di salute malattie dovute a specifiche Lesioni genetiche o qualsiasi malattia in cui le variazioni del paesaggio genetico di un paziente possano contribuire sostanzialmente all'operazione di oncogenesi e trattamento.
I modelli PDX del mouse-umano sono possibili perché molti citochine del mouse adeguatamente imitano i loro analoghi umani nell'attivare i recettori delle cellule umane mentre sono all'interno del mouse. Ad esempio, l'interleuchina-7 (IL-7) fornisce un segnale critico per lo sviluppo di cellule B umane. 2 In questo caso, il mouse IL-7 ha sufficiente omologia con l'umano IL-7 che la citocina del mouse stimola i percorsi di segnalazione nei precursori di cellule B umani. 2 , 3 , 4 Tuttavia, questo non è il caso del linfopoetina stromale tromico (TSLP), 5 , 6 che tra le altre citochine (IL-3, fattore stimolante colonia del granulocyte-macrofago (GM-CSF), fattore di cellule staminali (SCF) ,Ref "> 7 è importante per la produzione di cellule ematopoietiche umane normali e maligne Quando le citochine del mouse e dell'uomo mostrano una bassa omologia le citochine del mouse non attivano i rispettivi recettori sulle cellule umane Per superare questo ostacolo sono state utilizzate varie strategie Per progettare l'espressione di citochine umane nei topi PDX, tra cui l'iniezione di citochine umane ricombinanti, l'iniezione idrodinamica del DNA, l'espressione lentivirale, l'espressione transgenica e la sostituzione del gene knockin.7 Questo rapporto descrive un metodo per la progettazione di PDX per la produzione di citochina umana tramite stromal media Citochine ( Figura 1 ).
Nel metodo mostrato qui, i topi PDX sono progettati per esprimere la citocina umana, TSLP, o per servire come controlli negativi per la citochina. PDX che esprimono TSLP sono ottenute mediante iniezioni intraperitoneali settimanali di cellule stromali che sono state trasdotte per esprimere elevati livelli di TSLP umani.I topi di controllo "PDX" negativi per citochine sono costruiti similmente; Sebbene lo stroma di controllo venga trasduzione con un vettore di controllo. Questo metodo raggiunge i normali livelli fisiologici del TSLP umano in topi PDX iniettati con lo stroma TSLP +. Nessun TSLP rilevabile è osservato nei topi PDX che ricevono lo stroma citochina-negativo. Abbiamo scelto la linea cellulare HS-27A per i nostri studi, perché cresce robustamente in coltura e presenta un livello molto basso di produzione di citochine che non supporta la proliferazione di cellule progenitrici isolate nelle coculture. 8 Per l'espressione TSLP umana, lo stroma è stato trasdritto con un vettore lentivirale auto-inattivo di una generazione avanzata derivato da una spina dorsale precedentemente descritta 9 e comprende l'elemento cPPT / cts e l'elemento regolatore post-trascrizionale dell'epatite di legno (WPRE) per aumentare l'espressione di transgene. Il gene TSLP umano è stato costruito in questo vettore sotto il controllo del fattore di allungamento-1(EF-1) alfa promotore per ottenere un'espressione robusta, costitutiva e a lungo termine.
L'ingegnerizzazione di questo modello PDX migliorato per via umana-citochina è costituito da 4 fasi principali. Innanzitutto, lo stroma transdurato viene ampliato in vitro e valutato mediante un test immunosorbente enzimatico (ELISA) per una stabile produzione di citochine ad alto livello. In secondo luogo, l'attività della citochina umana prodotta dalle cellule stromali trasdurate (e la mancanza di attività di citochine da uno stroma di controllo) viene verificata usando citometria a fosfo-flusso. Le linee cellulari note per essere sensibili alla citochina di interesse (in questo caso, TSLP) vengono incubate con il surnatante di cellule stromali e sono state analizzate per la fosforilazione indotta da citocina. In terzo luogo, i topi vengono iniettati con lo stroma umano trasduttore e poi il plasma del topo viene valutato mediante ELISA per livelli di citochina umana su base settimanale. Quarta, le cellule ematopoietiche umane vengono trapiantate e gli effetti funzionali in vivo della citochina umana vengono valutati su un bersaglio noto ( <em> Ad esempio. Popolazione cellulare).
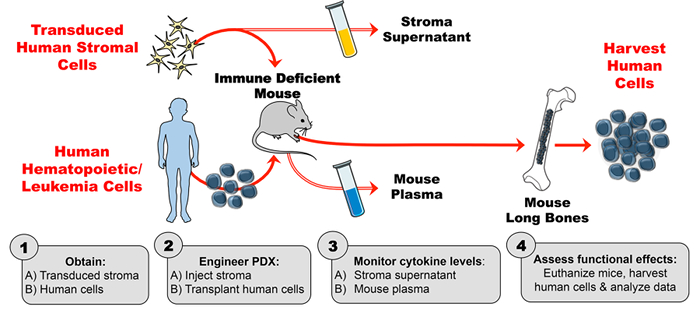
Figura 1: Modello PDX progettato per produrre citochina umana esogena nei topi. ( 1A ) Eseguire esperimenti di progettazione e ottenere cellule stromali umane trasdurate ( 1B ) Ottenere cellule umane (cellule staminali ematopoietiche, cellule di leucemia, ecc .) Per generare PDX (topi derivanti da xenograft). ( 2A ) Iniettare lo stroma progettato e ( 2B ) trapianto di cellule umane in topi immuni deficienti secondo il programma sperimentale. ( 3A-B ) Monitorare le concentrazioni di citochine nel supernatante dello stroma e nel plasma del topo mediante ELISA. ( 4 ) Raccogliere le cellule umane e valutare gli effetti funzionali in vivo della citochina umana presente nel PDX. Per favore clicca quiPer visualizzare una versione più grande di questa figura.
La consegna della citochina umana tramite cellule stromali offre vantaggi e svantaggi rispetto ad altri metodi di erogazione / produzione di citochine umane nei topi PDX. 7 Rispetto all'iniezione della citochina umana ricombinante, la somministrazione di stroma-mediata è generalmente meno costosa (il costo della coltura cellulare stromale è minore del costo della citochina ricombinante) e meno intensivo di lavoro (una iniezione a settimana rispetto a più iniezioni a settimana). Anche il problema della breve emivita di citochine è mitigato dal momento che lo stroma produce continuamente la citochina esogena. La somministrazione di citochina tramite iniezione idrodinamica del DNA può essere meno costosa della consegna tramite lo stroma. Tuttavia, è allo stesso modo transitorio e può richiedere più abilità tecnica rispetto alla semplice iniezione intraperitoneale settimanale richiesta per la somministrazione di stroma-mediata. L'espressione genica lentivirale nel topo può fornire una traccia minoreMetodo nsient di consegna della citochine; Tuttavia, nelle nostre mani non sono stati raggiunti livelli fisiologici di TSLP. Inoltre, questo metodo è intenso per il lavoro, che richiede la produzione continua di vettore lentivirale. I topi transgenici o knock-in offrono una stabile espressione a lungo termine della citochina e possono essere progettati per un'espressione specifica del tessuto, che può essere un vantaggio. D'altra parte, l'espressione transgenica del gene citocinico umano sullo sfondo del mouse immunitario deficiente richiesto per i topi PDX richiede un investimento immenso di risorse prima che il valore del modello sia stato stabilito. Inoltre, i modelli transgenici in genere non consentono l'opzione di variare la tempistica dell'iniziazione della citochina o del livello della produzione di citochine in vivo . Questi possono essere ottenuti con consegna mediata da stroma semplicemente cambiando il punto di tempo per l'inizio dell'iniezione di cellule stromali o la dose di cellule stromali iniettate.
Metodo di somministrazione della citocina mediata dalle cellule stromaliOd dettagliata qui è stata usata per sviluppare PDX per valutare il ruolo di TSLP nello sviluppo normale delle cellule B umane 4 e 6 e nella leucemia linfoblastica acuta a cellule B ad alto rischio. 6 Questo metodo fornisce un metodo alternativo di somministrazione della citocina per l'impiego nella generazione di modelli simili con citochine umane diverse da TSLP. Questo modello può anche essere utile per la generazione di dati preliminari che possano aiutare a determinare se il valore di un modello PDX di tipo cromosomico o citochinico per citochine sarebbe degno dell'investimento sostanziale del tempo e del denaro.
Protocol
Representative Results
Discussion
Questo manoscritto descrive un metodo semplice, veloce e relativamente conveniente per progettare PDX per esprimere la citochina umana esogena. La strategia qui descritta si basa su iniezioni intraperitoneali settimanali di una linea cellulare stromale trasfusa per esprimere la citocina umana, TSLP. Prima di eseguire i metodi qui descritti, sono stati generati stromi progettati per esprimere livelli elevati della citochina di interesse (TSLP) e dello stroma di controllo simile. Nei protocolli qui presentati, lo stroma v…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by NIH R21CA162259, NIH R01CA209829, NIH P20 MD006988, NIH 2R25 GM060507, a Hyundai Hope on Wheels Scholar Hope Grant, the Department of Pathology and Human Anatomy, the Department of Basic Sciences, and the Center for Health Disparities and Molecular Medicine at Loma Linda University School of Medicine and by a Grant to Promote Collaborative and Translational Research from Loma Linda University (KJP). The content is solely the responsibility of the authors and does not necessarily represent the official views of the NIH.
Materials
| Wet lab reagents | |||
| T-25 Nunc Cell Culture Treated EasYFlasks, 7 mL capacity, 25cm² culture area | Thermo Scientific / Fisher | 156367 | |
| T-75 Falcon Tissue Culture Treated Flask, 250 mL capacity, 75 cm² culture area & vented cap | Corning Inc. / Fisher | 353136 | |
| T-150 Falcon Tissue Culture Treated Flask, 600 mL capacity, 150 cm² culture area & vented cap | Corning Inc. / Fisher | 355001 | |
| 10 mL serological pipettes | Falcon | 357551 | |
| 15 mL polypropylene conical tubes | Fisher | 05-539-12 | |
| 5 mL round-bottom polystyrene tubes | Falcon | 352054 | |
| 50 mL polypropylene conical tubes | Falcon | 352098 | |
| 2.0 mL cryogenic vials, externally threaded | Corning Inc. / Fisher | 4230659 | |
| 1 mL pipette tips | Fisher | 2707509 | |
| 200 μL pipette tips | Denville Scientific | P3020-CPS | |
| 10 μL pipette tips | Denville Scientific | P-1096-CP | |
| Sterile Disposable Filter Units with SFCA Membrane, Nalgene Rapid-Flow | Fisher | 09-740-28D | |
| 2N H2SO4 | BioLegend | 423001 | |
| Dulbecco’s phosphate-buffered saline (PBS) without calicium and magnesium, 1× | Corning cellgro/ Mediatech | 21-031-CV | |
| Human TSLP ELISA Max Deluxe Set | BioLegend | 434204 | |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies | 7060 | |
| Trypan Blue | Corning | 25-900-Cl | |
| "Trypsin" 1x 0.25% Trypsin 2.21 mM EDTA in HBSS | ThermoFisher | 25-053 | |
| TWEEN 20 BioXtra | Sigma-Aldrich | P-7949 | |
| “R10” cell culture medium, % of total volume (makes 565 mL) | – | – | Lab Recipe |
| RPMI, 88.5% (500 mL) | Mediatech | 10-040-CV | |
| FBS, 9.9% (56 mL) | Mediatech | 35-011-CV | |
| L-Glutamine, 0.99% (5.6 mL) | Mediatech | 25-005-Cl | |
| Penicillin-Streptomycin, 0.50% (2.8 mL) | Mediatech | 30-002-Cl | |
| 2-Mercaptoethanol, 0.10% (560 µL) | MP | 190242 | |
| “R20” cell culture medium, % of total volume (makes 195 mL) | – | – | Lab Recipe |
| RPMI, 76.84% (150 mL) | see above | see above | |
| FBS, 20.49% (40 mL) | see above | see above | |
| 2mM L-glutamine, 1.02% (2 mL) | see above | see above | |
| 1mM Na pyruvate, 1.02% (2 mL ) | see above | see above | |
| Penicillin-Streptomycin, 0.51% (1 mL) | see above | see above | |
| 2-Mercaptoethanol, 0.10% (0.1 M), 0.10% (200 µL) | see above | see above | |
| “Freezing medium”, % of total volume | – | – | Lab Recipe |
| “R10” medium, 45% | see "R10" recipe | – | |
| FBS, 20% | see above | 35-011-CV | |
| DMSO, 10% | Corning | 25-950-CQC | |
| D(-)(+)-Trehalose dihydrate, 5% | Fisher Scientific | BP2687-100 | |
| Name | Company | Catolog Number | Comments |
| Biologics | |||
| "HS-27" HS-27A human stroma line | ATCC | CRL-2496 | |
| "CALL-4" MHH-CALL-4 cell line, human B cell precursor leukemia | DSMZ | ACC 337 | |
| “NSG mice” NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, male or female, age 6 – 8 weeks | JAX Mice | # 005557 | |
| MUTZ-5 cell line, human B cell precursor leukemia | DSMZ | ACC 490 | |
| Recombinant Human TSLP protein | R&D Systems | 1398-TS-010 | |
| Name | Company | Catolog Number | Comments |
| Flow cytomery antibodies (clone)* | |||
| Anti-mouse CD45 FITC (30F11) | Miltenyi Biotec | 130-102-778 | |
| CD127 PE (MB15-18C9) (alternate name is IL-7Rα) | Miltenyi Biotec | 130-098-094 | |
| CD34 APC (8G12) | BD Biosciences | 340667 | |
| CD45 PE-Cy7 (HI30) | eBioscience | 25-0459 | |
| "FVD" Fixable viability dye eFluor 780 | eBioscience | 65-0865 | |
| Ig κ light chain FITC (G20-193) | BD Pharmingen | 555791 | |
| Ig λ light chain FITC (JDC-12) | BD Pharmingen | 561379 | |
| IgD PE (IA6-2) | BioLegend | 348203 | |
| IgM PE-Cy5 (G20-127) | BD Biosciences | 551079 | |
| pSTAT5 PE, mouse anti-STAT5 (pY694) | BD PhosphoFlow | 612567 | |
| Name | Company | Catolog Number | Comments |
| Other materials & equipment | |||
| Animal Implantable Nano Transponder with Canula | Trovan | ID-100B(1.25) | |
| EMLA lidocaine anesthetic cream (obtain by presciption through animal care facility) | perscription | perscription | |
| BD ½ cc LO-DOSE U-100 Insulin Syringe 28G½ | BD | #329461 | |
| BD Microtainer Tubes with K2EDTA | BD | #365974 | |
| Centrifuge | Beckman Coulter | Alegra X-15R | |
| FisherBrand Capillary Tubes (Heparinized) | Fisher Scientific | 22-260-950 | |
| Hemocytometer | Fisher | 02-671-6 | |
| MACSQuant Analyzer 10 | Miltenyi Biotec | 130-096-343 | |
| Mouse Pie Cage | Braintree Scientific, Inc. | MPC-1 | |
| Mouse Tail Illuminator Restrainer | Braintree Scientific, Inc. | MTI STD | |
| Pistol Grip Implanter | Trovan | IM-300(1.25) | |
| µQuant | Bio-Tek Instruments Inc. | MQX200 | |
| FlowJo flow cytometry analysis software | FlowJo, LLC | Version 10 | |
| *All antibodies are anti-human unless otherwise stated. |
References
- Francis, O. L., Milford, T. A., Beldiman, C., Payne, K. J. Fine-tuning patient-derived xenograft models for precision medicine approaches in leukemia. J Investig Med. 64 (3), 740-744 (2016).
- Parrish, Y. K., et al. IL-7 Dependence in human B lymphopoiesis increases during progression of ontogeny from cord blood to bone marrow. J Immunol. 182 (7), 4255-4266 (2009).
- Johnson, S. E., Shah, N., Panoskaltsis-Mortari, A., LeBien, T. W. Murine and human IL-7 activate STAT5 and induce proliferation of normal human pro-B cells. J Immunol. 175 (11), 7325-7331 (2005).
- Milford, T. A., et al. TSLP or IL-7 provide an IL-7Ralpha signal that is critical for human B lymphopoiesis. Eur J Immunol. 46 (9), 2155-2161 (2016).
- Reche, P. A., et al. Human thymic stromal lymphopoietin preferentially stimulates myeloid cells. J Immunol. 167 (1), 336-343 (2001).
- Francis, O. L., et al. A novel xenograft model to study the role of TSLP-induced CRLF2 signals in normal and malignant human B lymphopoiesis. Haematologica. 101 (4), 417-426 (2016).
- Willinger, T., Rongvaux, A., Strowig, T., Manz, M. G., Flavell, R. A. Improving human hemato-lymphoid-system mice by cytokine knock-in gene replacement. Trends Immunol. 32 (7), 321-327 (2011).
- Graf, L., Iwata, M., Torok-Storb, B. Gene expression profiling of the functionally distinct human bone marrow stromal cell lines HS-5 and HS-27a. Blood. 100 (4), 1509-1511 (2002).
- Follenzi, A., Ailles, L. E., Bakovic, S., Geuna, M., Naldini, L. Gene transfer by lentiviral vectors is limited by nuclear translocation and rescued by HIV-1 pol sequences. Nat Genet. 25 (2), 217-222 (2000).
- Li, M., Husic, N., Lin, Y., Snider, B. J. Production of lentiviral vectors for transducing cells from the central nervous system. J Vis Exp. (63), e4031 (2012).
- Cockrell, A. S., Kafri, T. Gene delivery by lentivirus vectors. Mol Biotechnol. 36 (3), 184-204 (2007).
- Ricardo, R., Phelan, K. Freezing, thawing, and packaging cells for transport. J Vis Exp. (17), (2008).
- Tasian, S. K., et al. Aberrant STAT5 and PI3K/mTOR pathway signaling occurs in human CRLF2-rearranged B-precursor acute lymphoblastic leukemia. Blood. 120 (4), 833-842 (2012).
- Kalaitzidis, D., Neel, B. G. Flow-cytometric phosphoprotein analysis reveals agonist and temporal differences in responses of murine hematopoietic stem/progenitor cells. PLoS One. 3 (11), (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. (67), (2012).
- Kovacsics, D., Raper, J. Transient expression of proteins by hydrodynamic gene delivery in mice. J Vis Exp. (87), (2014).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Pearson, T., Greiner, D. L., Shultz, L. D. Chapter 15, Creation of "humanized" mice to study human immunity. Curr Protoc Immunol. , (2008).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. J Vis Exp. (17), (2008).
- Scheeren, F. A., et al. Thymic stromal lymphopoietin induces early human B-cell proliferation and differentiation. Eur J Immunol. 40 (4), 955-965 (2010).
- Lee, E. B., et al. Increased serum thymic stromal lymphopoietin in children with atopic dermatitis. Pediatr Allergy Immunol. 21 (2 Pt 2), e457-e460 (2010).

