Expression von exogenem Cytokin in Patient-abgeleiteten Xenotransplantaten über Injektion mit einer Cytokin-transduzierten Stromzelllinie
Summary
Hier beschrieben ist eine Methode zur Herstellung von exogenem Cytokin in Patienten-abgeleiteten Xenotransplantat (PDX) -Mäusen über eine wöchentliche intraperitoneale Injektion einer Cytokin-transduzierten Stromazellenlinie. Diese Methode erweitert den Nutzen von PDX und bietet die Möglichkeit für transiente oder nachhaltige exogene Cytokin-Zustellung in einer Vielzahl von PDX-Modellen.
Abstract
Patient-abgeleitete Xenotransplantat (PDX) -Mäuse werden durch Transplantation von menschlichen Zellen in immundefiziente Mäuse produziert. Diese Modelle sind ein wichtiges Instrument für das Studium der Mechanismen der normalen und malignen Hämatopoese und sind der Goldstandard für die Identifizierung effektiver Chemotherapien für viele Malignome. PDX-Modelle sind möglich, weil viele der Maus-Zytokine auch auf menschliche Zellen wirken. Allerdings ist dies nicht der Fall für alle Zytokine, darunter viele, die für das Studium der normalen und malignen Hämatopoese in menschlichen Zellen kritisch sind. Techniken, die Mäuse zur Herstellung von menschlichen Zytokinen (transgene und knock-in Modelle) erfordern, erfordern erhebliche Kosten, bevor die Nützlichkeit des Modells nachgewiesen wurde. Andere Techniken sind arbeitsintensiv (Injektion von rekombinantem Cytokin oder Lentivirus) und erfordern in manchen Fällen ein hohes Maß an technischem Fachwissen (hydrodynamische Injektion von DNA). Dieser Bericht beschreibt eine einfache Methode zur Erzeugung von PDX-Mäusen, die exogenes menschliches Cy habenTokine (TSLP, thymic stromal lymphopoietin) über wöchentliche intraperitoneale Injektion von Stroma, die transduziert wurden, um dieses Zytokin zu überexprimieren. Die Verwendung dieser Methode liefert eine in vivo Quelle der kontinuierlichen Zytokinproduktion, die physiologische Konzentrationen von zirkulierendem menschlichem Zytokin in der Maus erreicht. Die Plasmaspiegel des menschlichen Zytokins können auf der Grundlage der Anzahl der injizierten Stromazellen variiert werden, und die Zytokinproduktion kann an jedem Punkt des Experiments initiiert werden. Diese Methode umfasst auch Cytokin-negative Kontrollmäuse, die in ähnlicher Weise produziert werden, aber durch intraperitoneale Injektion von Stroma, die mit einem Kontrollvektor transduziert wird. Wir haben zuvor gezeigt, dass Leukämiezellen, die aus TSLP-exprimierendem PDX gewonnen wurden, im Vergleich zu Kontroll-PDX ein Genexpressionsmuster mehr wie die ursprüngliche Patientenprobe aufweisen. Gemeinsam bilden die durch diese Methode hergestellten Cytokin-produzierenden und zytokin-negativen PDX-Mäuse ein Modellsystem, das wir erfolgreich eingesetzt habenRolle der TSLP bei normaler und malignen Hämatopoese.
Introduction
Patient-abgeleitete Xenotransplantate (PDX) sind ein leistungsfähiges In-vivo- Modell für das Studium der Produktion von normalen und malignen hämatopoetischen Zellen in einer "nativen" Säugetierumgebung. Am häufigsten werden PDX durch Injektion oder Verpflanzung menschlicher Zellen in immundefiziente Mäuse produziert. Die Produktion von PDX mit normalen menschlichen hämatopoetischen Stammzellen ermöglicht in vivo Studien über normales menschliches Blut und Immunzellenentwicklung. PDX, hergestellt aus Leukämie oder anderen Krebszellen, ermöglicht es, onkogene Mechanismen zu untersuchen und wirksame Therapien im Kontext der genetischen Landschaften und Mutationen, die in der menschlichen Bevölkerung vorhanden sind, zu identifizieren. 1 Infolgedessen sind PDX der gegenwärtige Goldstandard für die Translationsbiomedizinforschung, um wirkungsvolle Therapien zu identifizieren und ein wichtiges Werkzeug für das Verständnis der Mechanismen des Krebsfortschritts zu sein. PDX-Modelle sind ein wichtiges Instrument zur Unterstützung der Erforschung von gesundheitlichen Disparitäten Krankheiten aufgrund spezifischer Genetische Läsionen oder jede Krankheit, bei der die Variationen der genetischen Landschaft eines Patienten wesentlich zum Onkogenese- und Behandlungsergebnis beitragen können.
Maus-menschliche PDX-Modelle sind möglich, weil viele Maus-Zytokine adäquat ihre menschlichen Analoga bei der Aktivierung der Zytokin-Rezeptoren von menschlichen Zellen imitieren, während sie in der Maus sind. Beispielsweise liefert Interleukin-7 (IL-7) ein kritisches Signal für die menschliche B-Zell-Entwicklung. 2 In diesem Fall hat Maus IL-7 eine ausreichende Homologie mit humanem IL-7, dass das Maus-Zytokin Signalwege in menschlichen B-Zell-Vorläufern stimuliert. 2 , 3 , 4 Allerdings ist dies bei Thymus-Stromaz-Lymphopoetin (TSLP), 5 , 6 nicht der Fall , der unter anderen Zytokinen (IL-3, Granulozyten-Makrophagen-Kolonie-stimulierenden Faktor (GM-CSF), Stammzellfaktor (SCF) ,Ref "> 7 ist wichtig für die Produktion von normalen und bösartigen menschlichen hämatopoetischen Zellen.Wenn Maus und menschliche Zytokine zeigen eine niedrige Homologie die Maus-Zytokine nicht aktivieren ihre jeweiligen Rezeptoren auf menschlichen Zellen.Um dieses Hindernis zu überwinden, wurden eine Reihe von Strategien verwendet Um die Expression von humanen Zytokinen in PDX-Mäusen zu entwickeln, darunter die Injektion von rekombinanten humanen Zytokinen, die hydrodynamische Injektion von DNA, die lentivirale Expression, die transgene Expression und den Knockin-Gen-Ersatz. 7 Dieser Bericht beschreibt eine Methode zur Herstellung von PDX zur Herstellung von menschlichem Cytokin über Stroma-vermittelte Zytokinabgabe ( Abbildung 1 ).
In der hier vorgestellten Methode werden PDX-Mäuse entwickelt, um das menschliche Zytokin, TSLP, zu exprimieren oder als Zytokin-Negativkontrollen zu dienen. TSLP-exprimierende PDX werden durch wöchentliche intraperitoneale Injektionen von Stromazellen erreicht, die transduziert wurden, um ein hohes Maß an menschlichem TSLP zu exprimieren.Cytokin-negative PDX-Kontroll-Mäuse sind ähnlich konstruiert; Obwohl Kontrollstroma mit einem Kontrollvektor transduziert werden. Diese Methode erreicht normale physiologische Werte von humanem TSLP in PDX-Mäusen, die mit dem TSLP + Stroma injiziert wurden. Bei PDX-Mäusen, die das Cytokin-negative Stroma erhalten, wird kein nachweisbares TSLP beobachtet. Wir haben die menschliche Stromzelllinie HS-27A für unsere Studien ausgewählt, weil sie in der Kultur robust wächst und eine sehr geringe Zytokinproduktion zeigt, die die Proliferation von isolierten Vorläuferzellen in Kokulturen nicht unterstützt. 8 Für die menschliche TSLP-Expression wurden Stroma mit einem fortgeschrittenen, selbstinaktivierenden lentiviralen Vektor transduziert, der aus einem zuvor beschriebenen Rückgrat 9 gewonnen wurde, und umfasst das cPPT / cts-Element und das Woodchuck-Hepatitis-posttranskriptionelle regulatorische Element (WPRE), um die Transgenexpression zu erhöhen. Das menschliche TSLP-Gen wurde unter der Kontrolle des Elongationsfaktors-1 in diesen Vektor konstruiert(EF-1) alpha-Promotor, um eine robuste, konstitutive und langfristige Expression zu erreichen.
Die Technik dieses menschlich-zytokinverstärkten PDX-Modells besteht aus 4 Hauptschritten. Zuerst werden transduziertes Stroma in vitro expandiert und durch enzymgebundenen Immunosorbens-Assay (ELISA) für eine stabile, hochgradige Zytokinproduktion bewertet. Zweitens wird die Aktivität der menschlichen Zytokine, die durch die transduzierten Stromazellen (und der Mangel an Zytokinaktivität aus Kontrollstroma) erzeugt wird, unter Verwendung von Phospho-Flow-Zytometrie verifiziert. Zelllinien, von denen bekannt ist, dass sie auf Cytokin von Interesse (in diesem Fall TSLP) reagieren, werden mit dem stromalen Zellüberstand inkubiert und auf Zytokin-induzierte Phosphorylierung untersucht. Drittens werden Mäuse mit transduziertem menschlichem Stroma injiziert und dann wird das Mausplasma durch den ELISA auf der Ebene des menschlichen Zytokins auf wöchentlicher Basis beurteilt. Viertens werden menschliche hämatopoetische Zellen transplantiert und die in vivo funktionellen Effekte des menschlichen Zytokins werden auf einem bekannten Ziel ( <em> Z.B. Zellpopulation).
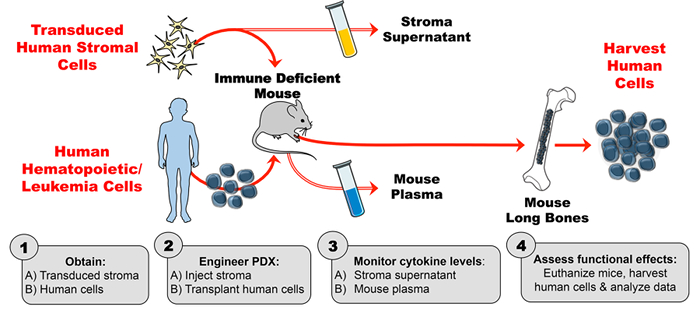
Abbildung 1: PDX-Modell entwickelt, um exogenes menschliches Cytokin in Mäusen zu produzieren. ( 1A ) Design-Experiment und erhalten transduzierte menschliche Stromazellen ( 1B ) Erhalten menschliche Zellen (hämatopoetische Stammzellen, Leukämie-Zellen, etc. ), um PDX (Patient-abgeleitete Xenotransplantat) Mäuse zu erzeugen. ( 2A ) Injizieren Sie konstruiertes Stroma und ( 2B ) transplantieren menschliche Zellen in immune defiziente Mäuse nach experimentellen Zeitplan. ( 3A-B ) Überwachen Sie die Zytokinkonzentrationen im Stroma-Überstand und das Maus-Plasma durch ELISA. ( 4 ) Ernten Sie menschliche Zellen und beurteilen Sie die in vivo funktionellen Effekte des im PDX vorhandenen menschlichen Zytokins. Klicken Sie bitte hierUm eine größere Version dieser Figur zu sehen.
Die Zufuhr von humanem Cytokin über Stromazellen bietet sowohl Vor- als auch Nachteile im Vergleich zu anderen Methoden der Bereitstellung / Herstellung von menschlichen Zytokinen in PDX-Mäusen. 7 Im Vergleich zur Injektion von rekombinantem humanem Cytokin ist die Stroma-vermittelte Verabreichung im Allgemeinen weniger teuer (die Kosten der Stromazinkultur sind weniger als die Kosten des rekombinanten Cytokins) und weniger arbeitsintensiv (eine Injektion pro Woche gegenüber mehreren Injektionen pro Woche). Die Frage der kurzen Zytokin-Halbwertszeit wird ebenfalls gemildert, da Stroma kontinuierlich das exogene Cytokin produziert. Die Verabreichung von Zytokin über die hydrodynamische Injektion von DNA kann weniger teuer sein als die Lieferung über Stroma. Allerdings ist es ähnlich vorübergehend und kann mehr technische Fähigkeiten erfordern als die einfache wöchentliche intraperitoneale Injektion, die für die Stroma-vermittelte Lieferung erforderlich ist. Die lentivirale Genexpression in der Maus kann wenigerNsient Methode der Zytokin-Lieferung; In unseren händen wurden jedoch physiologische TSLP-Werte nicht erreicht. Darüber hinaus ist diese Methode arbeitsintensiv und erfordert eine kontinuierliche Produktion von lentiviralen Vektor. Transgene oder knock-in Mäuse bieten eine stabile Langzeit-Expression von Zytokin und können für die gewebespezifische Expression entwickelt werden, was ein Vorteil sein kann. Auf der anderen Seite erfordert die transgene Expression des menschlichen Zytokin-Gens auf dem immune defizienten Maushintergrund, der für PDX-Mäuse erforderlich ist, eine immense Investition von Ressourcen, bevor der Wert des Modells hergestellt wurde. Darüber hinaus erlauben transgene Modelle im Allgemeinen nicht die Möglichkeit, den Zeitpunkt der Zytokininitiierung oder des Grades der in vivo- Zytokinproduktion zu variieren. Diese können mit der Stroma-vermittelten Verabreichung durch einfaches Ändern des Zeitpunkts für die Initiation der Stromazelleninjektion oder der Dosis der injizierten Stromazellen erreicht werden.
Die stromalzellvermittelte Cytokin-Abgabe methOd hier wurde verwendet, um PDX für die Bewertung der Rolle von TSLP in der normalen menschlichen B-Zell-Entwicklung 4 , 6 und hoher Risiko B-Zell-akuten lymphoblastischen Leukämie zu entwickeln. 6 Diese Methode stellt eine alternative Cytokin-Verabreichungsmethode zur Verwendung bei der Erzeugung von ähnlichen Modellen mit menschlichen Zytokinen außer TSLP zur Verfügung. Dieses Modell kann auch nützlich sein, um vorläufige Daten zu erzeugen, die helfen können, festzustellen, ob der Wert eines Zytokin-transgenen oder zytokinischen Klopf-in-PDX-Modells der erheblichen Zeit- und Geldinvestition würdig wäre.
Protocol
Representative Results
Discussion
Dieses Manuskript beschreibt eine einfache, schnelle und relativ kostengünstige Methode zur Herstellung von PDX, um exogenes menschliches Zytokin auszudrücken. Die hier beschriebene Strategie basiert auf wöchentlichen intraperitonealen Injektionen einer Stromazelle, die transduziert wurden, um das menschliche Cytokin, TSLP, zu exprimieren. Vor der Durchführung der hier beschriebenen Verfahren wurden Stroma entwickelt, um hohe Konzentrationen des Cytokins von Interesse (TSLP) und ähnlich entwickelten Kontrollstroma …
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by NIH R21CA162259, NIH R01CA209829, NIH P20 MD006988, NIH 2R25 GM060507, a Hyundai Hope on Wheels Scholar Hope Grant, the Department of Pathology and Human Anatomy, the Department of Basic Sciences, and the Center for Health Disparities and Molecular Medicine at Loma Linda University School of Medicine and by a Grant to Promote Collaborative and Translational Research from Loma Linda University (KJP). The content is solely the responsibility of the authors and does not necessarily represent the official views of the NIH.
Materials
| Wet lab reagents | |||
| T-25 Nunc Cell Culture Treated EasYFlasks, 7 mL capacity, 25cm² culture area | Thermo Scientific / Fisher | 156367 | |
| T-75 Falcon Tissue Culture Treated Flask, 250 mL capacity, 75 cm² culture area & vented cap | Corning Inc. / Fisher | 353136 | |
| T-150 Falcon Tissue Culture Treated Flask, 600 mL capacity, 150 cm² culture area & vented cap | Corning Inc. / Fisher | 355001 | |
| 10 mL serological pipettes | Falcon | 357551 | |
| 15 mL polypropylene conical tubes | Fisher | 05-539-12 | |
| 5 mL round-bottom polystyrene tubes | Falcon | 352054 | |
| 50 mL polypropylene conical tubes | Falcon | 352098 | |
| 2.0 mL cryogenic vials, externally threaded | Corning Inc. / Fisher | 4230659 | |
| 1 mL pipette tips | Fisher | 2707509 | |
| 200 μL pipette tips | Denville Scientific | P3020-CPS | |
| 10 μL pipette tips | Denville Scientific | P-1096-CP | |
| Sterile Disposable Filter Units with SFCA Membrane, Nalgene Rapid-Flow | Fisher | 09-740-28D | |
| 2N H2SO4 | BioLegend | 423001 | |
| Dulbecco’s phosphate-buffered saline (PBS) without calicium and magnesium, 1× | Corning cellgro/ Mediatech | 21-031-CV | |
| Human TSLP ELISA Max Deluxe Set | BioLegend | 434204 | |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies | 7060 | |
| Trypan Blue | Corning | 25-900-Cl | |
| "Trypsin" 1x 0.25% Trypsin 2.21 mM EDTA in HBSS | ThermoFisher | 25-053 | |
| TWEEN 20 BioXtra | Sigma-Aldrich | P-7949 | |
| “R10” cell culture medium, % of total volume (makes 565 mL) | – | – | Lab Recipe |
| RPMI, 88.5% (500 mL) | Mediatech | 10-040-CV | |
| FBS, 9.9% (56 mL) | Mediatech | 35-011-CV | |
| L-Glutamine, 0.99% (5.6 mL) | Mediatech | 25-005-Cl | |
| Penicillin-Streptomycin, 0.50% (2.8 mL) | Mediatech | 30-002-Cl | |
| 2-Mercaptoethanol, 0.10% (560 µL) | MP | 190242 | |
| “R20” cell culture medium, % of total volume (makes 195 mL) | – | – | Lab Recipe |
| RPMI, 76.84% (150 mL) | see above | see above | |
| FBS, 20.49% (40 mL) | see above | see above | |
| 2mM L-glutamine, 1.02% (2 mL) | see above | see above | |
| 1mM Na pyruvate, 1.02% (2 mL ) | see above | see above | |
| Penicillin-Streptomycin, 0.51% (1 mL) | see above | see above | |
| 2-Mercaptoethanol, 0.10% (0.1 M), 0.10% (200 µL) | see above | see above | |
| “Freezing medium”, % of total volume | – | – | Lab Recipe |
| “R10” medium, 45% | see "R10" recipe | – | |
| FBS, 20% | see above | 35-011-CV | |
| DMSO, 10% | Corning | 25-950-CQC | |
| D(-)(+)-Trehalose dihydrate, 5% | Fisher Scientific | BP2687-100 | |
| Name | Company | Catolog Number | Comments |
| Biologics | |||
| "HS-27" HS-27A human stroma line | ATCC | CRL-2496 | |
| "CALL-4" MHH-CALL-4 cell line, human B cell precursor leukemia | DSMZ | ACC 337 | |
| “NSG mice” NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, male or female, age 6 – 8 weeks | JAX Mice | # 005557 | |
| MUTZ-5 cell line, human B cell precursor leukemia | DSMZ | ACC 490 | |
| Recombinant Human TSLP protein | R&D Systems | 1398-TS-010 | |
| Name | Company | Catolog Number | Comments |
| Flow cytomery antibodies (clone)* | |||
| Anti-mouse CD45 FITC (30F11) | Miltenyi Biotec | 130-102-778 | |
| CD127 PE (MB15-18C9) (alternate name is IL-7Rα) | Miltenyi Biotec | 130-098-094 | |
| CD34 APC (8G12) | BD Biosciences | 340667 | |
| CD45 PE-Cy7 (HI30) | eBioscience | 25-0459 | |
| "FVD" Fixable viability dye eFluor 780 | eBioscience | 65-0865 | |
| Ig κ light chain FITC (G20-193) | BD Pharmingen | 555791 | |
| Ig λ light chain FITC (JDC-12) | BD Pharmingen | 561379 | |
| IgD PE (IA6-2) | BioLegend | 348203 | |
| IgM PE-Cy5 (G20-127) | BD Biosciences | 551079 | |
| pSTAT5 PE, mouse anti-STAT5 (pY694) | BD PhosphoFlow | 612567 | |
| Name | Company | Catolog Number | Comments |
| Other materials & equipment | |||
| Animal Implantable Nano Transponder with Canula | Trovan | ID-100B(1.25) | |
| EMLA lidocaine anesthetic cream (obtain by presciption through animal care facility) | perscription | perscription | |
| BD ½ cc LO-DOSE U-100 Insulin Syringe 28G½ | BD | #329461 | |
| BD Microtainer Tubes with K2EDTA | BD | #365974 | |
| Centrifuge | Beckman Coulter | Alegra X-15R | |
| FisherBrand Capillary Tubes (Heparinized) | Fisher Scientific | 22-260-950 | |
| Hemocytometer | Fisher | 02-671-6 | |
| MACSQuant Analyzer 10 | Miltenyi Biotec | 130-096-343 | |
| Mouse Pie Cage | Braintree Scientific, Inc. | MPC-1 | |
| Mouse Tail Illuminator Restrainer | Braintree Scientific, Inc. | MTI STD | |
| Pistol Grip Implanter | Trovan | IM-300(1.25) | |
| µQuant | Bio-Tek Instruments Inc. | MQX200 | |
| FlowJo flow cytometry analysis software | FlowJo, LLC | Version 10 | |
| *All antibodies are anti-human unless otherwise stated. |
References
- Francis, O. L., Milford, T. A., Beldiman, C., Payne, K. J. Fine-tuning patient-derived xenograft models for precision medicine approaches in leukemia. J Investig Med. 64 (3), 740-744 (2016).
- Parrish, Y. K., et al. IL-7 Dependence in human B lymphopoiesis increases during progression of ontogeny from cord blood to bone marrow. J Immunol. 182 (7), 4255-4266 (2009).
- Johnson, S. E., Shah, N., Panoskaltsis-Mortari, A., LeBien, T. W. Murine and human IL-7 activate STAT5 and induce proliferation of normal human pro-B cells. J Immunol. 175 (11), 7325-7331 (2005).
- Milford, T. A., et al. TSLP or IL-7 provide an IL-7Ralpha signal that is critical for human B lymphopoiesis. Eur J Immunol. 46 (9), 2155-2161 (2016).
- Reche, P. A., et al. Human thymic stromal lymphopoietin preferentially stimulates myeloid cells. J Immunol. 167 (1), 336-343 (2001).
- Francis, O. L., et al. A novel xenograft model to study the role of TSLP-induced CRLF2 signals in normal and malignant human B lymphopoiesis. Haematologica. 101 (4), 417-426 (2016).
- Willinger, T., Rongvaux, A., Strowig, T., Manz, M. G., Flavell, R. A. Improving human hemato-lymphoid-system mice by cytokine knock-in gene replacement. Trends Immunol. 32 (7), 321-327 (2011).
- Graf, L., Iwata, M., Torok-Storb, B. Gene expression profiling of the functionally distinct human bone marrow stromal cell lines HS-5 and HS-27a. Blood. 100 (4), 1509-1511 (2002).
- Follenzi, A., Ailles, L. E., Bakovic, S., Geuna, M., Naldini, L. Gene transfer by lentiviral vectors is limited by nuclear translocation and rescued by HIV-1 pol sequences. Nat Genet. 25 (2), 217-222 (2000).
- Li, M., Husic, N., Lin, Y., Snider, B. J. Production of lentiviral vectors for transducing cells from the central nervous system. J Vis Exp. (63), e4031 (2012).
- Cockrell, A. S., Kafri, T. Gene delivery by lentivirus vectors. Mol Biotechnol. 36 (3), 184-204 (2007).
- Ricardo, R., Phelan, K. Freezing, thawing, and packaging cells for transport. J Vis Exp. (17), (2008).
- Tasian, S. K., et al. Aberrant STAT5 and PI3K/mTOR pathway signaling occurs in human CRLF2-rearranged B-precursor acute lymphoblastic leukemia. Blood. 120 (4), 833-842 (2012).
- Kalaitzidis, D., Neel, B. G. Flow-cytometric phosphoprotein analysis reveals agonist and temporal differences in responses of murine hematopoietic stem/progenitor cells. PLoS One. 3 (11), (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. (67), (2012).
- Kovacsics, D., Raper, J. Transient expression of proteins by hydrodynamic gene delivery in mice. J Vis Exp. (87), (2014).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Pearson, T., Greiner, D. L., Shultz, L. D. Chapter 15, Creation of "humanized" mice to study human immunity. Curr Protoc Immunol. , (2008).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. J Vis Exp. (17), (2008).
- Scheeren, F. A., et al. Thymic stromal lymphopoietin induces early human B-cell proliferation and differentiation. Eur J Immunol. 40 (4), 955-965 (2010).
- Lee, E. B., et al. Increased serum thymic stromal lymphopoietin in children with atopic dermatitis. Pediatr Allergy Immunol. 21 (2 Pt 2), e457-e460 (2010).

