Hastadan türeyen Xenograftlarda Exogenous Cytokine'in Sitokinle Transmurgated Stromal Hücre Hattı İle Enjeksiyon Vasıtasıyla İfade Edilmesi
Summary
Burada, sitokin ile transdüksiyona sokulmuş bir stromal hücre hattının haftalık intraperitoneal enjeksiyonu yoluyla, hastadan türetilen ksenograft (PDX) farelerde eksojen sitokinin üretilmesi için bir yöntem tarif edilmektedir. Bu yöntem, PDX'in kullanımını genişletir ve bir çok PDX modelinde geçici veya sürekli dış kaynaklı sitokin verme seçeneği sunar.
Abstract
Hastadan türeyen ksenograft (PDX) fareler, insan hücrelerini immün yetersiz farelere naklederek üretilir. Bu modeller, normal ve malign hematopoez mekanizmalarını incelemek için önemli bir araçtır ve bir çok malignite için etkili kemoterapileri belirlemek için altın standarttır. PDX modelleri mümkündür, çünkü birçok fare sitokinleri aynı zamanda insan hücreleri üzerinde de etkindir. Bununla birlikte, insan hücrelerinde normal ve malign hematopoez incelemek için kritik olan birçoğu da dahil olmak üzere, tüm sitokinler için durum böyle değildir. İnsan sitokinleri (transjenik ve knock-in modelleri) üretmek üzere mühendislik farelerinin modelin kullanışlılığı gösterilmeden önce önemli harcamalar gerektiren teknikler. Diğer teknikler emek yoğun (rekombinant sitokin veya lentivirüs enjeksiyonu) ve bazı durumlarda yüksek düzeyde teknik uzmanlık gerektirir (DNA'nın hidrodinamik enjeksiyonu). Bu raporda, eksojen insan cy içeren PDX farelerinin üretilmesi için basit bir yöntem açıklanmaktadırTokine (TSLP, timik stromal lenfopoietin) , bu sitokini aşırı ifade etmek için transdude edilen haftalık intraperitoneal stroma enjeksiyonu yoluyla . Bu yöntemin kullanılması, fare içinde dolaşan insan sitokininin fizyolojik seviyelerine erişen in vivo bir sürekli sitokin kaynağı sağlar. İnsan sitokininin plazma seviyeleri, enjekte edilen stromal hücrelerin sayısına göre değişebilir ve sitokin üretimi, deneydeki herhangi bir noktada başlatılabilir. Bu yöntem, aynı şekilde üretilen sitokin-negatif kontrol farelerini de içerir, fakat bir kontrol vektörü ile transdüze edilen intraperitoneal stroma enjeksiyonu yoluyla. Kontrol PDX'si ile karşılaştırıldığında, TSLP'yi eksprese eden PDX'den hasat edilen lösemi hücrelerinin orijinal hasta örneğine benzeyen bir gen ekspresyonu sergilediğini daha önce göstermiştik. Bu yöntemle üretilen sitokin üreten ve sitokin negatif PDX fareleri, birlikte çalıştıklarımızı incelemek için başarılı bir şekilde kullandığımız bir model sistemi sağlar.TSLP'nin normal ve malign hematopoezdeki rolü.
Introduction
Hastadan türeyen ksenograftlar (PDX) 'yerli' bir memeli ortamında normal ve malign hematopoietik hücrelerin üretiminin incelenmesi için güçlü bir in vivo modeldir. Çoğu zaman, PDX bağışıklık yetersiz farelere insan hücrelerini enjekte ederek ya da naklederek üretilir. Normal insan hematopoietik kök hücrelerini kullanarak PDX üretilmesi, normal insan kanında ve immün hücre gelişiminde in vivo çalışmalara izin verir. Lösemi veya diğer kanser hücrelerinden üretilen PDX, insan popülasyonunda mevcut olan genetik peyzajlar ve mutasyonlar bağlamında, onkojenik mekanizmaların incelenmesini ve etkili terapileri tanımlamayı mümkün kılar. Sonuç olarak PDX, etkili terapileri tanımlamak için translasyonel biyomedikal araştırmalar için mevcut olan altın standart ve kanser ilerlemesinin mekanizmalarını anlamak için önemli bir araçtır. PDX modelleri, sağlık ayrımlarından arındırılmış hastalıkların araştırılmasına yardımcı olmak için özel bir araçtır. Genetik lezyonlar veya bir hastanın genetik görünümündeki varyasyonların onkogenezise ve tedavi sonucuna önemli ölçüde katkıda bulunduğu herhangi bir hastalık.
Fare-insan PDX modelleri mümkündür, çünkü birçok fare sitokinleri, fare içerisindeyken insan hücrelerinin sitokin reseptörlerini harekete geçirirken insan analoglarını yeterince taklit eder. Örneğin, interlökin-7 (IL-7) insan B hücresi gelişimi için kritik bir sinyal sağlar. 2 Bu durumda, fare IL-7, insan IL-7 ile yeterli homologluğa sahiptir ve fare sitokini, insan B hücresi öncüllerinde sinyal yollarını uyarır. Bununla birlikte, diğer sitokinlerin (IL-3, granülosit-makrofaj koloni uyarıcı faktör (GM-CSF), kök hücre faktörü (SCF) arasında timik stromal lenfopoietin (TSLP) 5 , 6 için geçerli değildir, ,Ref "> 7 normal ve habis insan hematopoietik hücrelerinin üretilmesi için önemlidir Fare ve insan sitokinleri düşük homologluk gösterdiğinde fare sitokinleri insan hücreleri üzerinde kendi reseptörlerini aktive etmez Bu engeli aşmak için birtakım stratejiler kullanılmıştır PDX farelerinde insan sitokinlerinin ekspresyonunu mühendislere yapıştırmak için rekombinant insan sitokinlerinin enjeksiyonu, DNA'nın hidrodinamik enjeksiyonu, lentiviral ekspresyon, transjenik ekspresyon ve knockin geni değiştirme 7 Bu rapor, PDX'nin stromal aracılı yollarla insan sitokini üretmesi için bir metodu açıklamaktadır Sitokin verimi ( Şekil 1 ).
Burada gösterilen yöntemde, PDX fareleri, insan sitokini, TSLP'yi veya sitokin negatif kontroller olarak görev yapacak şekilde tasarlanmıştır. TSLP'yi ifade eden PDX, yüksek düzeylerde insan TSLP'sini ifade etmek üzere transduced edilen stromal hücrelerin haftalık intraperitoneal enjeksiyonları ile elde edilir.Sitokin-negatif PDX "kontrol" fareleri benzer şekilde tasarlanmıştır; Ancak kontrol stroması bir kontrol vektörüyle dönüştürülür. Bu yöntem, TSLP + stroma enjekte edilen PDX farelerinde insan TSLP'sinin normal fizyolojik seviyelerine ulaşmaktadır. Sitokin negatif stroma alan PDX farelerinde saptanabilir TSLP gözlenmemiştir. Çalışmalarımız için insan stromal hücre hattı HS-27A'yı seçtik çünkü kültürde sağlam bir şekilde büyür ve kokültürlerde izole progenitör hücrelerin çoğalmasını desteklemeyen çok düşük sitokin üretimi gösterir. 8 İnsan TSLP ekspresyonu için, stroma, daha önce tarif edilen omurgadan türetilmiş ileri nesil kendinden inaktif bir lentiviral vektör ile transduced edildi ve transgen ekspresyonunu arttırmak için cPPT / cts elemanı ve post-transkripsiyonel düzenleyici unsuru (WPRE) ağaç talebi hepatitini içerdi. İnsan TSLP geni, bu vektöre, uzatma faktörü -1(EF-1) alfa hızlandırıcıyı sağlam, kurucu ve uzun vadeli ifadeye erişir.
Bu insan sitokini ile güçlendirilmiş PDX modelinin mühendisliği 4 ana aşamadan oluşur. Önce transduced stroma, in vitro genişletilir ve kararlı, yüksek seviyeli sitokin üretimi için enzim bağlantılı immunosorbent assay (ELISA) ile değerlendirilir. İkincisi, dönüştürülen stromal hücreler tarafından üretilen insan sitokininin (ve kontrol stromasından sitokin aktivitesinin eksikliği) etkinliği, fosfo-akış sitometrisi kullanılarak doğrulanır. İlgi konusu sitokine duyarlı olduğu bilinen hücre hatları (bu örnekte TSLP), stromal hücre süpernatanı ile inkübe edilir ve sitokine bağlı fosforilasyon için denenir. Üçüncü olarak, farelere dönüştürülen insan stroması enjekte edilir ve daha sonra fare plazması, haftalık bazda insan sitokin seviyeleri için ELISA ile değerlendirilir. Dördüncü olarak insan hematopoietik hücreleri nakledilir ve insan sitokininin in vivo fonksiyonel etkileri bilinen bir hedef üzerinde değerlendirilir ( <emÖr. Hücre popülasyonu).
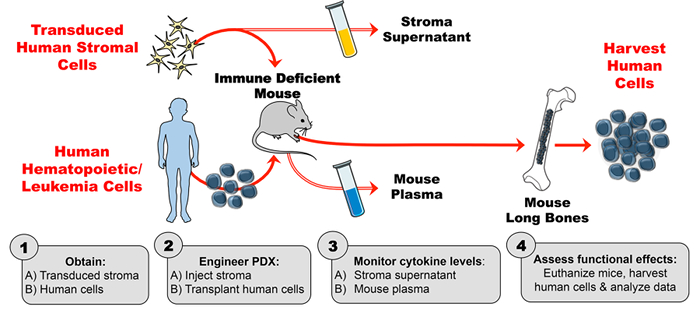
Şekil 1: Farelerde Eksojen İnsan Sitokini Üretmek üzere Üretilen PDX Modeli. ( 1A ) Tasarım deneyi ve transduced insan stromal hücreleri ( 1B ) elde PDX (hasta türevli ksenograft) fareler üretmek için insan hücreleri (hematopoietik kök hücreler, lösemi hücreleri, vb .) Edinin. ( 2A ) Deneysel çizelgeye göre immün yetersiz farelere insan hücrelerini mühendislik stromasını enjekte edin ve ( 2B ) nakledin. ( 3A-B ) ELISA ile stroma süpernatanı ve fare plazmasında sitokin konsantrasyonlarını izleyin. ( 4 ) İnsan hücrelerini toplayın ve PDX'de bulunan insan sitokininin in vivo fonksiyonel etkilerini değerlendirin. Lütfen buraya tıklayınızBu rakamın daha büyük bir versiyonunu görüntülemek için.
Stromal hücreler yoluyla insan sitokinin verilmesi, PDX farelerinde insan sitokinleri verme / üretme yöntemlerine kıyasla avantaj ve dezavantajlar sunar. 7 Rekombinant insan sitokinin enjeksiyonu ile karşılaştırıldığında, stroma aracılı doğum genellikle daha ucuzdur (stromal hücre kültürü maliyeti rekombinant sitokin maliyetinden daha düşüktür) ve emek yoğunluğu daha düşüktür (haftada bir kez enjeksiyona karşı haftada birden fazla enjeksiyon). Kısa sitokin yarı ömrü sorunu da hafifletilir çünkü stroma sürekli olarak eksojen sitokin üretir. DNA'nın hidrodinamik enjeksiyonu yoluyla sitokin verilmesi, stroma yoluyla verilmeden daha ucuz olabilir. Bununla birlikte, benzer şekilde geçicidir ve stroma bağlı teslimat için gerekli basit haftalık intraperitoneal enjeksiyona göre daha fazla teknik beceri gerektirebilir. Fare içerisinde Lentiviral gen ekspresyonu daha az travma sağlayabilirSitokin verme yöntemleri; Ancak, elimizde fizyolojik TSLP seviyelerine ulaşılamadı. Ayrıca, bu yöntem emek gerektirir ve sürekli lentiviral vektör üretilmesini gerektirir. Transgenik veya knock-in fareler, sitokinin stabil uzun süreli ekspresyonunu sunar ve bir avantaj sağlayabilecek doku spesifik ekspresyonu için tasarlanabilir. Öte yandan, PDX fareleri için gerekli olan immün yetersiz fare arka planı üzerindeki insan sitokin geninin transgenik ifadesi, modelin değeri belirlenmeden önce büyük bir kaynak yatırımı yapılmasını gerektirir. Dahası, transgenik modeller genellikle sitokin başlatma zamanlamasını veya in vivo sitokin üretim seviyesini değiştirme seçeneği sunmamaktadır. Bunlar, stromal hücre enjeksiyonunun başlatılması için zaman noktasını veya enjekte edilen stromal hücrelerin dozunu değiştirerek stroma bağlı teslimat ile başarılabilir.
Stromal-hücre aracılı sitokin verilme metoduBurada detaylı açıklanan normal insan B hücre gelişimi 4 , 6 ve yüksek riskli B hücreli akut lenfoblastik lösemi TSLP rolünü değerlendirmek için PDX geliştirmek için kullanılmıştır. Bu yöntem, TSLP dışındaki insan sitokinleri ile benzer modellerin üretilmesinde kullanılmak üzere alternatif bir sitokin verme yöntemi sağlar. Bu model, bir sitokin transjenik veya sitokine giren PDX modelinin değerinin önemli miktarda zaman ve para yatırımı yapmaya değip değmeyeceğini belirlemenize yardımcı olabilecek ön verileri üretmek için de yararlı olabilir.
Protocol
Representative Results
Discussion
Bu el yazması, eksojen insan sitokini sentezlemek için PDX'in mühendisliği için basit, hızlı ve nispeten düşük maliyetli bir yöntemi anlatmaktadır. Burada tarif edilen strateji, insan sitokini, TSLP'yi eksprese etmek için transduze edilen bir stromal hücre hattının haftalık intraperitoneal enjeksiyonuna dayanır. Burada açıklanan yöntemleri uygulamadan önce, yüksek sitokin düzeyini (TSLP) ifade etmek üzere tasarlanmış stroma ve benzer şekilde tasarlanmış kontrol stroması üretildi. …
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by NIH R21CA162259, NIH R01CA209829, NIH P20 MD006988, NIH 2R25 GM060507, a Hyundai Hope on Wheels Scholar Hope Grant, the Department of Pathology and Human Anatomy, the Department of Basic Sciences, and the Center for Health Disparities and Molecular Medicine at Loma Linda University School of Medicine and by a Grant to Promote Collaborative and Translational Research from Loma Linda University (KJP). The content is solely the responsibility of the authors and does not necessarily represent the official views of the NIH.
Materials
| Wet lab reagents | |||
| T-25 Nunc Cell Culture Treated EasYFlasks, 7 mL capacity, 25cm² culture area | Thermo Scientific / Fisher | 156367 | |
| T-75 Falcon Tissue Culture Treated Flask, 250 mL capacity, 75 cm² culture area & vented cap | Corning Inc. / Fisher | 353136 | |
| T-150 Falcon Tissue Culture Treated Flask, 600 mL capacity, 150 cm² culture area & vented cap | Corning Inc. / Fisher | 355001 | |
| 10 mL serological pipettes | Falcon | 357551 | |
| 15 mL polypropylene conical tubes | Fisher | 05-539-12 | |
| 5 mL round-bottom polystyrene tubes | Falcon | 352054 | |
| 50 mL polypropylene conical tubes | Falcon | 352098 | |
| 2.0 mL cryogenic vials, externally threaded | Corning Inc. / Fisher | 4230659 | |
| 1 mL pipette tips | Fisher | 2707509 | |
| 200 μL pipette tips | Denville Scientific | P3020-CPS | |
| 10 μL pipette tips | Denville Scientific | P-1096-CP | |
| Sterile Disposable Filter Units with SFCA Membrane, Nalgene Rapid-Flow | Fisher | 09-740-28D | |
| 2N H2SO4 | BioLegend | 423001 | |
| Dulbecco’s phosphate-buffered saline (PBS) without calicium and magnesium, 1× | Corning cellgro/ Mediatech | 21-031-CV | |
| Human TSLP ELISA Max Deluxe Set | BioLegend | 434204 | |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies | 7060 | |
| Trypan Blue | Corning | 25-900-Cl | |
| "Trypsin" 1x 0.25% Trypsin 2.21 mM EDTA in HBSS | ThermoFisher | 25-053 | |
| TWEEN 20 BioXtra | Sigma-Aldrich | P-7949 | |
| “R10” cell culture medium, % of total volume (makes 565 mL) | – | – | Lab Recipe |
| RPMI, 88.5% (500 mL) | Mediatech | 10-040-CV | |
| FBS, 9.9% (56 mL) | Mediatech | 35-011-CV | |
| L-Glutamine, 0.99% (5.6 mL) | Mediatech | 25-005-Cl | |
| Penicillin-Streptomycin, 0.50% (2.8 mL) | Mediatech | 30-002-Cl | |
| 2-Mercaptoethanol, 0.10% (560 µL) | MP | 190242 | |
| “R20” cell culture medium, % of total volume (makes 195 mL) | – | – | Lab Recipe |
| RPMI, 76.84% (150 mL) | see above | see above | |
| FBS, 20.49% (40 mL) | see above | see above | |
| 2mM L-glutamine, 1.02% (2 mL) | see above | see above | |
| 1mM Na pyruvate, 1.02% (2 mL ) | see above | see above | |
| Penicillin-Streptomycin, 0.51% (1 mL) | see above | see above | |
| 2-Mercaptoethanol, 0.10% (0.1 M), 0.10% (200 µL) | see above | see above | |
| “Freezing medium”, % of total volume | – | – | Lab Recipe |
| “R10” medium, 45% | see "R10" recipe | – | |
| FBS, 20% | see above | 35-011-CV | |
| DMSO, 10% | Corning | 25-950-CQC | |
| D(-)(+)-Trehalose dihydrate, 5% | Fisher Scientific | BP2687-100 | |
| Name | Company | Catolog Number | Comments |
| Biologics | |||
| "HS-27" HS-27A human stroma line | ATCC | CRL-2496 | |
| "CALL-4" MHH-CALL-4 cell line, human B cell precursor leukemia | DSMZ | ACC 337 | |
| “NSG mice” NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, male or female, age 6 – 8 weeks | JAX Mice | # 005557 | |
| MUTZ-5 cell line, human B cell precursor leukemia | DSMZ | ACC 490 | |
| Recombinant Human TSLP protein | R&D Systems | 1398-TS-010 | |
| Name | Company | Catolog Number | Comments |
| Flow cytomery antibodies (clone)* | |||
| Anti-mouse CD45 FITC (30F11) | Miltenyi Biotec | 130-102-778 | |
| CD127 PE (MB15-18C9) (alternate name is IL-7Rα) | Miltenyi Biotec | 130-098-094 | |
| CD34 APC (8G12) | BD Biosciences | 340667 | |
| CD45 PE-Cy7 (HI30) | eBioscience | 25-0459 | |
| "FVD" Fixable viability dye eFluor 780 | eBioscience | 65-0865 | |
| Ig κ light chain FITC (G20-193) | BD Pharmingen | 555791 | |
| Ig λ light chain FITC (JDC-12) | BD Pharmingen | 561379 | |
| IgD PE (IA6-2) | BioLegend | 348203 | |
| IgM PE-Cy5 (G20-127) | BD Biosciences | 551079 | |
| pSTAT5 PE, mouse anti-STAT5 (pY694) | BD PhosphoFlow | 612567 | |
| Name | Company | Catolog Number | Comments |
| Other materials & equipment | |||
| Animal Implantable Nano Transponder with Canula | Trovan | ID-100B(1.25) | |
| EMLA lidocaine anesthetic cream (obtain by presciption through animal care facility) | perscription | perscription | |
| BD ½ cc LO-DOSE U-100 Insulin Syringe 28G½ | BD | #329461 | |
| BD Microtainer Tubes with K2EDTA | BD | #365974 | |
| Centrifuge | Beckman Coulter | Alegra X-15R | |
| FisherBrand Capillary Tubes (Heparinized) | Fisher Scientific | 22-260-950 | |
| Hemocytometer | Fisher | 02-671-6 | |
| MACSQuant Analyzer 10 | Miltenyi Biotec | 130-096-343 | |
| Mouse Pie Cage | Braintree Scientific, Inc. | MPC-1 | |
| Mouse Tail Illuminator Restrainer | Braintree Scientific, Inc. | MTI STD | |
| Pistol Grip Implanter | Trovan | IM-300(1.25) | |
| µQuant | Bio-Tek Instruments Inc. | MQX200 | |
| FlowJo flow cytometry analysis software | FlowJo, LLC | Version 10 | |
| *All antibodies are anti-human unless otherwise stated. |
References
- Francis, O. L., Milford, T. A., Beldiman, C., Payne, K. J. Fine-tuning patient-derived xenograft models for precision medicine approaches in leukemia. J Investig Med. 64 (3), 740-744 (2016).
- Parrish, Y. K., et al. IL-7 Dependence in human B lymphopoiesis increases during progression of ontogeny from cord blood to bone marrow. J Immunol. 182 (7), 4255-4266 (2009).
- Johnson, S. E., Shah, N., Panoskaltsis-Mortari, A., LeBien, T. W. Murine and human IL-7 activate STAT5 and induce proliferation of normal human pro-B cells. J Immunol. 175 (11), 7325-7331 (2005).
- Milford, T. A., et al. TSLP or IL-7 provide an IL-7Ralpha signal that is critical for human B lymphopoiesis. Eur J Immunol. 46 (9), 2155-2161 (2016).
- Reche, P. A., et al. Human thymic stromal lymphopoietin preferentially stimulates myeloid cells. J Immunol. 167 (1), 336-343 (2001).
- Francis, O. L., et al. A novel xenograft model to study the role of TSLP-induced CRLF2 signals in normal and malignant human B lymphopoiesis. Haematologica. 101 (4), 417-426 (2016).
- Willinger, T., Rongvaux, A., Strowig, T., Manz, M. G., Flavell, R. A. Improving human hemato-lymphoid-system mice by cytokine knock-in gene replacement. Trends Immunol. 32 (7), 321-327 (2011).
- Graf, L., Iwata, M., Torok-Storb, B. Gene expression profiling of the functionally distinct human bone marrow stromal cell lines HS-5 and HS-27a. Blood. 100 (4), 1509-1511 (2002).
- Follenzi, A., Ailles, L. E., Bakovic, S., Geuna, M., Naldini, L. Gene transfer by lentiviral vectors is limited by nuclear translocation and rescued by HIV-1 pol sequences. Nat Genet. 25 (2), 217-222 (2000).
- Li, M., Husic, N., Lin, Y., Snider, B. J. Production of lentiviral vectors for transducing cells from the central nervous system. J Vis Exp. (63), e4031 (2012).
- Cockrell, A. S., Kafri, T. Gene delivery by lentivirus vectors. Mol Biotechnol. 36 (3), 184-204 (2007).
- Ricardo, R., Phelan, K. Freezing, thawing, and packaging cells for transport. J Vis Exp. (17), (2008).
- Tasian, S. K., et al. Aberrant STAT5 and PI3K/mTOR pathway signaling occurs in human CRLF2-rearranged B-precursor acute lymphoblastic leukemia. Blood. 120 (4), 833-842 (2012).
- Kalaitzidis, D., Neel, B. G. Flow-cytometric phosphoprotein analysis reveals agonist and temporal differences in responses of murine hematopoietic stem/progenitor cells. PLoS One. 3 (11), (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. (67), (2012).
- Kovacsics, D., Raper, J. Transient expression of proteins by hydrodynamic gene delivery in mice. J Vis Exp. (87), (2014).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Pearson, T., Greiner, D. L., Shultz, L. D. Chapter 15, Creation of "humanized" mice to study human immunity. Curr Protoc Immunol. , (2008).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. J Vis Exp. (17), (2008).
- Scheeren, F. A., et al. Thymic stromal lymphopoietin induces early human B-cell proliferation and differentiation. Eur J Immunol. 40 (4), 955-965 (2010).
- Lee, E. B., et al. Increased serum thymic stromal lymphopoietin in children with atopic dermatitis. Pediatr Allergy Immunol. 21 (2 Pt 2), e457-e460 (2010).

