サイトカイン形質導入ストローマ細胞株注入による患者由来異種移植片における外因性サイトカインの発現
Summary
ここで、サイトカイン形質導入間質細胞株の毎週腹腔内注射による患者由来異種移植(PDX)マウスにおける外因性サイトカインの産生方法を記載する。この方法は、PDXの有用性を広げ、多数のPDXモデルにおける一過性または持続性外因性サイトカイン送達の選択肢を提供する。
Abstract
患者由来の異種移植片(PDX)マウスは、ヒト細胞を免疫不全マウスに移植することによって産生される。これらのモデルは、正常および悪性の造血のメカニズムを研究するための重要なツールであり、多くの悪性腫瘍の有効な化学療法を特定するためのゴールドスタンダードです。多くのマウスサイトカインもまたヒト細胞に作用するので、PDXモデルが可能である。しかし、これは、ヒト細胞の正常および悪性造血を研究するために重要な多くを含む、すべてのサイトカインの場合ではない。ヒトサイトカイン(トランスジェニックモデルおよびノックインモデル)を産生するようにマウスを操作する技術は、モデルの有用性が証明されるまでにかなりの経費を必要とする。他の技術は、労働集約的(組換えサイトカインまたはレンチウイルスの注射)であり、場合によっては、高度な技術的専門知識(DNAの流体力学的注射)を必要とする。このレポートは、外因性のヒトcyを有するPDXマウスを生成するための簡単な方法を記載しているこのサイトカインを過剰発現するように形質導入された間質の週1回の腹腔内注射を介して 、トキソプラズマ(TSLP、胸腺間質リンパ球ポエチン)この方法の使用はマウスの循環ヒトサイトカインの生理学的レベルを達成する連続サイトカイン産生のインビボ供給源を提供する。ヒトサイトカインの血漿レベルは、注入された間質細胞の数に基づいて変化させることができ、サイトカイン産生を実験の任意の時点で開始することができる。この方法はまた、同様に産生されるが、対照ベクターで形質導入された間質の腹腔内注射によって、サイトカイン陰性対照マウスを含む。我々は以前に、対照PDXと比較してTSLPを発現するPDXから採取した白血病細胞が元の患者のサンプルよりも遺伝子発現パターンを示すことを実証した。一緒に、この方法によって生成されたサイトカイン産生およびサイトカイン陰性PDXマウスは、我々が正常に使用したモデル系を提供する正常および悪性造血におけるTSLPの役割。
Introduction
患者由来異種移植片(PDX)は、「ネイティブ」哺乳動物環境において正常および悪性の造血細胞の産生を研究するための強力なin vivoモデルである。ほとんどの場合、PDXはヒトの細胞を免疫不全マウスに注入または移植することによって産生される。正常なヒト造血幹細胞を用いたPDXの産生は、正常なヒト血液および免疫細胞発生のインビボ研究を可能にする 。白血病または他の癌細胞から産生されたPDXは、発癌機構を研究し、ヒト集団に存在する遺伝的景観および突然変異の範囲に関連して有効な治療法を同定することを可能にする。結果として、PDXは、効果的な治療法を特定するための翻訳生物医学研究の現在のゴールドスタンダードであり、癌進行のメカニズムを理解するための重要なツールです。 PDXモデルは、特定の要因による健康格差の病気の研究を支援するための不可欠なツールです遺伝的病変、または患者の遺伝的景観の変化が発癌および治療結果に実質的に寄与し得る任意の疾患を含む。
多くのマウスサイトカインはマウスの中にある間にヒト細胞のサイトカイン受容体を活性化する際にヒト類似体を適切に模倣するので、マウス – ヒトPDXモデルが可能である。例えば、インターロイキン-7(IL-7)は、ヒトB細胞発生のための重要なシグナルを提供する。 2この場合、マウスIL-7は、マウスサイトカインがヒトB細胞前駆体のシグナル伝達経路を刺激するという、ヒトIL-7と十分な相同性を有する。 IL-3、顆粒球マクロファージコロニー刺激因子(GM-CSF)、幹細胞因子(SCF)、顆粒球マクロファージコロニー刺激因子(GM-CSF)の中でも特に、 、マウスおよびヒトサイトカインが低い相同性を示す場合、マウスサイトカインは、ヒト細胞上のそれぞれの受容体を活性化しない。この障害を克服するために、いくつかの戦略が使用されているPDXマウスにおけるヒトサイトカインの発現をエンジニアリングするために、組換えヒトサイトカインの注射、DNAの流体力学的注入、レンチウイルスの発現、トランスジェニック発現およびノックイン遺伝子の置換が含まれる。サイトカイン送達( 図1 )。
本明細書に示す方法において、PDXマウスは、ヒトサイトカイン、TSLPを発現するように、またはサイトカイン陰性対照として機能するように操作される。 TSLPを発現するPDXは、高レベルのヒトTSLPを発現するように形質導入された間質細胞の毎週腹腔内注射によって達成される。サイトカイン陰性PDX「対照」マウスも同様に操作される;対照間質は対照ベクターで形質導入される。この方法は、TSLP +間質を注射されたPDXマウスにおいてヒトTSLPの正常な生理学的レベルを達成する。サイトカイン陰性間質を受けるPDXマウスでは、検出可能なTSLPは観察されない。私たちは、ヒトの間質細胞株HS-27Aを培養で強く増殖し、共培養で単離した前駆細胞の増殖を支持しない非常に低いレベルのサイトカイン産生を示すので、本発明者らの研究に選択した。ヒトTSLP発現のために、間質には、先に説明した骨格9由来の先進的な自己不活性化レンチウイルスベクターを形質導入し、トランスジーン発現を増加させるためのcPPT / ctsエレメントおよびウッドチャック肝炎後転写調節エレメント(WPRE)を含む。ヒトTSLP遺伝子を伸長因子-1の制御下でこのベクターに構築した(EF-1)アルファプロモーターを使用して、強力な、構成的な、および長期の発現を達成する。
このヒト – サイトカイン増強PDXモデルの工学は、4つの主要なステップからなる。第1に、形質導入された間質をインビトロで拡大し 、安定した高レベルのサイトカイン産生のための酵素結合免疫吸着アッセイ(ELISA)によって評価する。第二に、形質導入された間質細胞によって産生されたヒトサイトカインの活性(および対照間質からのサイトカイン活性の欠如)は、リン – フローサイトメトリーを用いて検証される。目的のサイトカイン(この例では、TSLP)に応答することが知られている細胞株を間質細胞上清と共にインキュベートし、サイトカイン誘導リン酸化についてアッセイする。第3に、形質導入されたヒト間質をマウスに注射し、次いで、マウス血漿をELISAによってヒトサイトカインのレベルについて毎週評価する。第4に、ヒト造血細胞を移植し、ヒトサイトカインのインビボでの機能的効果を、既知の標的(例えば、 <em>例えば。細胞集団)。
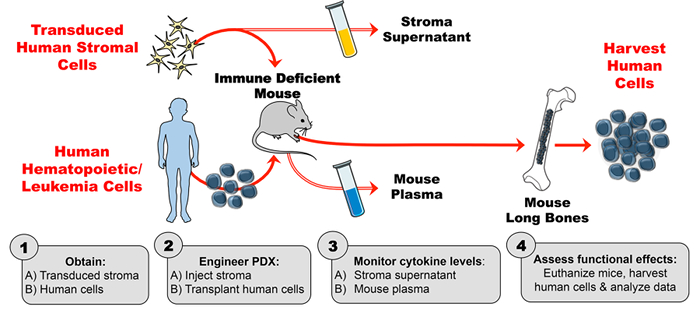
図1:マウスの外因性ヒトサイトカインを産生するように設計されたPDXモデル。 ( 1A )設計実験および形質導入ヒト間質細胞の取得( 1B )ヒト細胞(造血幹細胞、白血病細胞など )を入手してPDX(患者由来異種移植片)マウスを作製する。 ( 2A )操作された間質を注入し、( 2B )ヒト細胞を実験スケジュールに従って免疫不全マウスに移植する。 ( 3A-B )ストロマ上清およびマウス血漿中のサイトカイン濃度をELISAでモニターする。 ( 4 )ヒト細胞を採取し、PDX中に存在するヒトサイトカインのin vivo機能的効果を評価する。 ここをクリックしてくださいこの図のより大きなバージョンを表示します。
間質細胞を介するヒトサイトカインの送達は、PDXマウスにおいてヒトサイトカインを送達/産生する他の方法と比較した場合、長所と短所の両方を提供する。ストローマ媒介性送達は、組換えヒトサイトカインの注射と比較して、一般に安価であり(間質細胞培養のコストは組換えサイトカインのコストよりも低い)、労働集約性はより低い(1週間に1回の注射と週に複数回の注射)。間質は外因性サイトカインを絶え間なく産生するので、短いサイトカイン半減期の問題も緩和される。 DNAの流体力学的注入によるサイトカインの送達は、間質を介する送達よりも安価であり得る。しかし、それは同様に一過性であり、間質媒介性送達に必要とされる単純な週1回の腹腔内注射よりも多くの技術的能力を必要とすることがある。マウスにおけるレンチウイルス遺伝子発現は、サイトカイン送達の新しい方法;しかし、私たちの手で生理学的TSLPレベルは達成されなかった。さらに、この方法は労働集約的であり、レンチウイルスベクターの連続生産を必要とする。トランスジェニックまたはノックインマウスは、サイトカインの安定した長期発現を提供し、組織特異的発現のために操作することができ、これは利点となり得る。他方、PDXマウスに必要な免疫不全マウスのバックグラウンド上のヒトサイトカイン遺伝子のトランスジェニック発現は、モデルの価値が確立される前に、膨大なリソースの投資を必要とする。さらに、トランスジェニックモデルは、一般に、サイトカイン開始のタイミングまたはインビボサイトカイン産生のレベルを変化させる選択肢を許容しない。これらは、間質細胞注入の開始時期または注入された間質細胞の用量を単に変化させることによって、間質媒介性送達によって達成することができる。
間質細胞媒介サイトカイン送達法本明細書中に詳述されたものは、正常なヒトB細胞発生4,6および高リスクB細胞急性リンパ芽球性白血病におけるTSLPの役割を評価するためのPDXを開発するために使用された。この方法は、TSLP以外のヒトサイトカインで類似のモデルを作製する際に使用するための代替サイトカイン送達方法を提供する。このモデルはまた、サイトカイントランスジェニックまたはサイトカインノックインPDXモデルの価値が相当な時間と費用を投資する価値があるかどうかを判断するのに役立つ予備的データを生成するのに有用であり得る。
Protocol
Representative Results
Discussion
この原稿は、外因性ヒトサイトカインを発現するようにPDXを工学するための、単純で、迅速で、比較的費用対効果の高い方法を記載している。ここに記載されている戦略は、ヒトサイトカインであるTSLPを発現するように形質導入されたストローマ細胞株の毎週腹腔内注射に基づく。本明細書に記載の方法を実施する前に、高レベルの目的のサイトカイン(TSLP)を発現するように操作された?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by NIH R21CA162259, NIH R01CA209829, NIH P20 MD006988, NIH 2R25 GM060507, a Hyundai Hope on Wheels Scholar Hope Grant, the Department of Pathology and Human Anatomy, the Department of Basic Sciences, and the Center for Health Disparities and Molecular Medicine at Loma Linda University School of Medicine and by a Grant to Promote Collaborative and Translational Research from Loma Linda University (KJP). The content is solely the responsibility of the authors and does not necessarily represent the official views of the NIH.
Materials
| Wet lab reagents | |||
| T-25 Nunc Cell Culture Treated EasYFlasks, 7 mL capacity, 25cm² culture area | Thermo Scientific / Fisher | 156367 | |
| T-75 Falcon Tissue Culture Treated Flask, 250 mL capacity, 75 cm² culture area & vented cap | Corning Inc. / Fisher | 353136 | |
| T-150 Falcon Tissue Culture Treated Flask, 600 mL capacity, 150 cm² culture area & vented cap | Corning Inc. / Fisher | 355001 | |
| 10 mL serological pipettes | Falcon | 357551 | |
| 15 mL polypropylene conical tubes | Fisher | 05-539-12 | |
| 5 mL round-bottom polystyrene tubes | Falcon | 352054 | |
| 50 mL polypropylene conical tubes | Falcon | 352098 | |
| 2.0 mL cryogenic vials, externally threaded | Corning Inc. / Fisher | 4230659 | |
| 1 mL pipette tips | Fisher | 2707509 | |
| 200 μL pipette tips | Denville Scientific | P3020-CPS | |
| 10 μL pipette tips | Denville Scientific | P-1096-CP | |
| Sterile Disposable Filter Units with SFCA Membrane, Nalgene Rapid-Flow | Fisher | 09-740-28D | |
| 2N H2SO4 | BioLegend | 423001 | |
| Dulbecco’s phosphate-buffered saline (PBS) without calicium and magnesium, 1× | Corning cellgro/ Mediatech | 21-031-CV | |
| Human TSLP ELISA Max Deluxe Set | BioLegend | 434204 | |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies | 7060 | |
| Trypan Blue | Corning | 25-900-Cl | |
| "Trypsin" 1x 0.25% Trypsin 2.21 mM EDTA in HBSS | ThermoFisher | 25-053 | |
| TWEEN 20 BioXtra | Sigma-Aldrich | P-7949 | |
| “R10” cell culture medium, % of total volume (makes 565 mL) | – | – | Lab Recipe |
| RPMI, 88.5% (500 mL) | Mediatech | 10-040-CV | |
| FBS, 9.9% (56 mL) | Mediatech | 35-011-CV | |
| L-Glutamine, 0.99% (5.6 mL) | Mediatech | 25-005-Cl | |
| Penicillin-Streptomycin, 0.50% (2.8 mL) | Mediatech | 30-002-Cl | |
| 2-Mercaptoethanol, 0.10% (560 µL) | MP | 190242 | |
| “R20” cell culture medium, % of total volume (makes 195 mL) | – | – | Lab Recipe |
| RPMI, 76.84% (150 mL) | see above | see above | |
| FBS, 20.49% (40 mL) | see above | see above | |
| 2mM L-glutamine, 1.02% (2 mL) | see above | see above | |
| 1mM Na pyruvate, 1.02% (2 mL ) | see above | see above | |
| Penicillin-Streptomycin, 0.51% (1 mL) | see above | see above | |
| 2-Mercaptoethanol, 0.10% (0.1 M), 0.10% (200 µL) | see above | see above | |
| “Freezing medium”, % of total volume | – | – | Lab Recipe |
| “R10” medium, 45% | see "R10" recipe | – | |
| FBS, 20% | see above | 35-011-CV | |
| DMSO, 10% | Corning | 25-950-CQC | |
| D(-)(+)-Trehalose dihydrate, 5% | Fisher Scientific | BP2687-100 | |
| Name | Company | Catolog Number | Comments |
| Biologics | |||
| "HS-27" HS-27A human stroma line | ATCC | CRL-2496 | |
| "CALL-4" MHH-CALL-4 cell line, human B cell precursor leukemia | DSMZ | ACC 337 | |
| “NSG mice” NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, male or female, age 6 – 8 weeks | JAX Mice | # 005557 | |
| MUTZ-5 cell line, human B cell precursor leukemia | DSMZ | ACC 490 | |
| Recombinant Human TSLP protein | R&D Systems | 1398-TS-010 | |
| Name | Company | Catolog Number | Comments |
| Flow cytomery antibodies (clone)* | |||
| Anti-mouse CD45 FITC (30F11) | Miltenyi Biotec | 130-102-778 | |
| CD127 PE (MB15-18C9) (alternate name is IL-7Rα) | Miltenyi Biotec | 130-098-094 | |
| CD34 APC (8G12) | BD Biosciences | 340667 | |
| CD45 PE-Cy7 (HI30) | eBioscience | 25-0459 | |
| "FVD" Fixable viability dye eFluor 780 | eBioscience | 65-0865 | |
| Ig κ light chain FITC (G20-193) | BD Pharmingen | 555791 | |
| Ig λ light chain FITC (JDC-12) | BD Pharmingen | 561379 | |
| IgD PE (IA6-2) | BioLegend | 348203 | |
| IgM PE-Cy5 (G20-127) | BD Biosciences | 551079 | |
| pSTAT5 PE, mouse anti-STAT5 (pY694) | BD PhosphoFlow | 612567 | |
| Name | Company | Catolog Number | Comments |
| Other materials & equipment | |||
| Animal Implantable Nano Transponder with Canula | Trovan | ID-100B(1.25) | |
| EMLA lidocaine anesthetic cream (obtain by presciption through animal care facility) | perscription | perscription | |
| BD ½ cc LO-DOSE U-100 Insulin Syringe 28G½ | BD | #329461 | |
| BD Microtainer Tubes with K2EDTA | BD | #365974 | |
| Centrifuge | Beckman Coulter | Alegra X-15R | |
| FisherBrand Capillary Tubes (Heparinized) | Fisher Scientific | 22-260-950 | |
| Hemocytometer | Fisher | 02-671-6 | |
| MACSQuant Analyzer 10 | Miltenyi Biotec | 130-096-343 | |
| Mouse Pie Cage | Braintree Scientific, Inc. | MPC-1 | |
| Mouse Tail Illuminator Restrainer | Braintree Scientific, Inc. | MTI STD | |
| Pistol Grip Implanter | Trovan | IM-300(1.25) | |
| µQuant | Bio-Tek Instruments Inc. | MQX200 | |
| FlowJo flow cytometry analysis software | FlowJo, LLC | Version 10 | |
| *All antibodies are anti-human unless otherwise stated. |
References
- Francis, O. L., Milford, T. A., Beldiman, C., Payne, K. J. Fine-tuning patient-derived xenograft models for precision medicine approaches in leukemia. J Investig Med. 64 (3), 740-744 (2016).
- Parrish, Y. K., et al. IL-7 Dependence in human B lymphopoiesis increases during progression of ontogeny from cord blood to bone marrow. J Immunol. 182 (7), 4255-4266 (2009).
- Johnson, S. E., Shah, N., Panoskaltsis-Mortari, A., LeBien, T. W. Murine and human IL-7 activate STAT5 and induce proliferation of normal human pro-B cells. J Immunol. 175 (11), 7325-7331 (2005).
- Milford, T. A., et al. TSLP or IL-7 provide an IL-7Ralpha signal that is critical for human B lymphopoiesis. Eur J Immunol. 46 (9), 2155-2161 (2016).
- Reche, P. A., et al. Human thymic stromal lymphopoietin preferentially stimulates myeloid cells. J Immunol. 167 (1), 336-343 (2001).
- Francis, O. L., et al. A novel xenograft model to study the role of TSLP-induced CRLF2 signals in normal and malignant human B lymphopoiesis. Haematologica. 101 (4), 417-426 (2016).
- Willinger, T., Rongvaux, A., Strowig, T., Manz, M. G., Flavell, R. A. Improving human hemato-lymphoid-system mice by cytokine knock-in gene replacement. Trends Immunol. 32 (7), 321-327 (2011).
- Graf, L., Iwata, M., Torok-Storb, B. Gene expression profiling of the functionally distinct human bone marrow stromal cell lines HS-5 and HS-27a. Blood. 100 (4), 1509-1511 (2002).
- Follenzi, A., Ailles, L. E., Bakovic, S., Geuna, M., Naldini, L. Gene transfer by lentiviral vectors is limited by nuclear translocation and rescued by HIV-1 pol sequences. Nat Genet. 25 (2), 217-222 (2000).
- Li, M., Husic, N., Lin, Y., Snider, B. J. Production of lentiviral vectors for transducing cells from the central nervous system. J Vis Exp. (63), e4031 (2012).
- Cockrell, A. S., Kafri, T. Gene delivery by lentivirus vectors. Mol Biotechnol. 36 (3), 184-204 (2007).
- Ricardo, R., Phelan, K. Freezing, thawing, and packaging cells for transport. J Vis Exp. (17), (2008).
- Tasian, S. K., et al. Aberrant STAT5 and PI3K/mTOR pathway signaling occurs in human CRLF2-rearranged B-precursor acute lymphoblastic leukemia. Blood. 120 (4), 833-842 (2012).
- Kalaitzidis, D., Neel, B. G. Flow-cytometric phosphoprotein analysis reveals agonist and temporal differences in responses of murine hematopoietic stem/progenitor cells. PLoS One. 3 (11), (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. (67), (2012).
- Kovacsics, D., Raper, J. Transient expression of proteins by hydrodynamic gene delivery in mice. J Vis Exp. (87), (2014).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Pearson, T., Greiner, D. L., Shultz, L. D. Chapter 15, Creation of "humanized" mice to study human immunity. Curr Protoc Immunol. , (2008).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. J Vis Exp. (17), (2008).
- Scheeren, F. A., et al. Thymic stromal lymphopoietin induces early human B-cell proliferation and differentiation. Eur J Immunol. 40 (4), 955-965 (2010).
- Lee, E. B., et al. Increased serum thymic stromal lymphopoietin in children with atopic dermatitis. Pediatr Allergy Immunol. 21 (2 Pt 2), e457-e460 (2010).

