Экспрессия экзогенного цитокина в ксенотрансплантатах, полученных у пациентов, посредством инъекции с трансформированной цитокинами стромальной клеточной линией
Summary
Описанный здесь способ получения экзогенного цитокина у мышей ксенотрансплантата (PDX), полученных от пациента, посредством еженедельной внутрибрюшинной инъекции линии стромальных клеток, трансдуцированной цитокинами. Этот метод расширяет полезность PDX и предоставляет возможность для временной или постоянной доставки экзогенного цитокина во множестве моделей PDX.
Abstract
Мышей, полученных из ксенотрансплантата (PDX), получают путем пересадки человеческих клеток на иммунодефицитных мышей. Эти модели являются важным инструментом для изучения механизмов нормального и злокачественного кроветворения и являются золотым стандартом для выявления эффективных химиотерапий для многих злокачественных новообразований. Модели PDX возможны, потому что многие мышиные цитокины также действуют на клетки человека. Однако это не относится ко всем цитокинам, включая многие, которые имеют решающее значение для изучения нормального и злокачественного кроветворения в клетках человека. Методы, которые инженерные мыши для производства человеческих цитокинов (трансгенных и детонационных моделей) требуют значительных затрат до того, как была продемонстрирована полезность модели. Другие методы трудоемки (инъекции рекомбинантного цитокина или лентивируса), а в некоторых случаях требуют высокого уровня технической экспертизы (гидродинамическая инъекция ДНК). В этом отчете описывается простой способ создания PDX-мышей с экзогенным человеческим циТокин (TSLP, тимусный стромальный лимфопоэтин) посредством еженедельной внутрибрюшинной инъекции стромы, которая была трансдуцирована с избыточной экспрессией этого цитокина. Использование этого метода обеспечивает источник in vivo непрерывного продуцирования цитокинов, который достигает физиологических уровней циркулирующего человеческого цитокина в мыши. Уровни плазмы человеческого цитокина могут варьироваться в зависимости от количества вводимых стромальных клеток и в любой момент эксперимента может быть инициировано производство цитокинов. Этот способ также включает в себя контрольных мышей с цитокином, которые получают аналогичным образом, но посредством внутрибрюшинной инъекции стромы, трансдуцированной контрольным вектором. Ранее мы продемонстрировали, что клетки лейкемии, полученные из TSXP-экспрессирующего PDX, по сравнению с контролем PDX, демонстрируют генную модель экспрессии, более похожую на исходный образец пациента. Вместе цитокин-продуцирующие и цитокин-негативные мыши PDX, полученные этим методом, обеспечивают модельную систему, которую мы успешно использовали для изученияРоль TSLP в нормальном и злокачественном кроветворении.
Introduction
Полученные пациентом ксенотрансплантаты (PDX) являются мощной моделью in vivo для изучения продуцирования нормальных и злокачественных гематопоэтических клеток в «естественной» среде млекопитающих. Чаще всего, PDX продуцируются путем инъекции или трансплантации клеток человека в иммунных дефицитных мышей. Производство PDX с использованием обычных гемопоэтических стволовых клеток человека позволяет исследовать естественную кровь человека и иммунные клетки in vivo. PDX, продуцируемый лейкозом или другими раковыми клетками, позволяет изучать онкогенные механизмы и определять эффективные методы лечения в контексте диапазона генетических ландшафтов и мутаций, присутствующих в популяции человека. 1 Следовательно, PDX являются текущим золотым стандартом для трансляционных биомедицинских исследований для выявления эффективных методов лечения и важным инструментом для понимания механизмов прогрессирования рака. Модели PDX являются важным инструментом, помогающим исследовать болезни здоровья, обусловленные Генетические повреждения или любое заболевание, при котором вариации генетического ландшафта пациента могут существенно способствовать онкогенезу и исходу лечения.
Модели PDX для мыши и человека возможны, потому что многие мышиные цитокины адекватно имитируют их человеческие аналоги в активации рецепторов цитокинов человеческих клеток, когда они находятся внутри мыши. Например, интерлейкин-7 (IL-7) обеспечивает критический сигнал для развития В-клеток человека. 2 В этом случае мышиный IL-7 обладает достаточной гомологией с человеческим IL-7, что цитокин мыши стимулирует сигнальные пути в предшественниках B-клеток человека. Однако это не относится к тимусу стромального лимфопоэтина (TSLP), 5,6, который среди других цитокинов (IL-3, гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), фактор стволовых клеток (SCF) ,Ref>> 7 играет важную роль в образовании нормальных и злокачественных гемопоэтических клеток человека.Когда цитокины мыши и человека демонстрируют низкую гомологию, цитокины мыши не активируют их соответствующие рецепторы на клетках человека.Чтобы преодолеть это препятствие, был использован ряд стратегий Для разработки экспрессии цитокинов человека у мышей PDX, которые включают инъекцию рекомбинантных человеческих цитокинов, гидродинамическую инъекцию ДНК, лентивирусную экспрессию, трансгенную экспрессию и замещение гена knockin.7 В этом докладе описывается способ конструирования PDX для продуцирования человеческого цитокина через опосредованный стромальными клетками Цитокинов ( рис. 1 ).
В методе, продемонстрированном здесь, мышей PDX сконструировали для экспрессии человеческого цитокина, TSLP или для того, чтобы служить в качестве отрицательных контролей для цитокинов. TSXP-экспрессирующие PDX достигаются еженедельными внутрибрюшинными инъекциями стромальных клеток, которые были трансдуцированы для экспрессии высоких уровней TSLP человека.Аналогичным образом сконструированы мыши с «отрицательным» цитокином PDX «контроля»; Хотя контрольную строму трансдуцируют контрольным вектором. Этот метод обеспечивает нормальные физиологические уровни человеческого TSLP у мышей PDX, инъецированных стромой TSLP +. Не обнаружено TSLP у мышей PDX, получающих цитокин-негативную строму. Мы выбрали линию стромальных клеток человека HS-27A для наших исследований, потому что она устойчиво растет в культуре и демонстрирует очень низкий уровень продуцирования цитокинов, который не поддерживает пролиферацию изолированных клеток-предшественников в сокультурах. 8 Для экспрессии TSLP человека строма была трансдуцирована с самоинтавивирующим лентивирусным вектором передового поколения, полученным из ранее описанной основной цепи, 9 и включает элемент cPPT / cts и посттранскрипционный регуляторный элемент лечаного гепатита (WPRE) для увеличения экспрессии трансгена. Ген человека TSLP был сконструирован в этот вектор под контролем фактора элонгации-1(EF-1) альфа-промотор для достижения устойчивой, конститутивной и долговременной экспрессии.
Разработка этой модели человеческих цитокинов с улучшенной PDX состоит из 4 основных этапов. Во-первых, трансдуцированная строма расширяется in vitro и оценивается с помощью иммуноферментного анализа (ELISA) для стабильного высокого уровня продукции цитокинов. Во-вторых, активность человеческого цитокина, продуцируемого трансформированными стромальными клетками (и отсутствие активности цитокинов из контрольной стромы), проверяется с использованием фосфо-проточной цитометрии. Клеточные линии, которые, как известно, реагируют на цитокин, представляющий интерес (в данном случае, TSLP), инкубируют с супернатантом стромальных клеток и анализируют на индуцированное цитокинами фосфорилирование. В-третьих, мыши инъецируют трансдуцированную строму человека, и затем мышь плазма оценивается методом ELISA для уровней цитокинов человека еженедельно. В-четвертых, человеческие гемопоэтические клетки трансплантируют, и функциональные эффекты in vivo человеческого цитокина оценивают на известной мишени ( <em> Напр. Клеточной популяции).
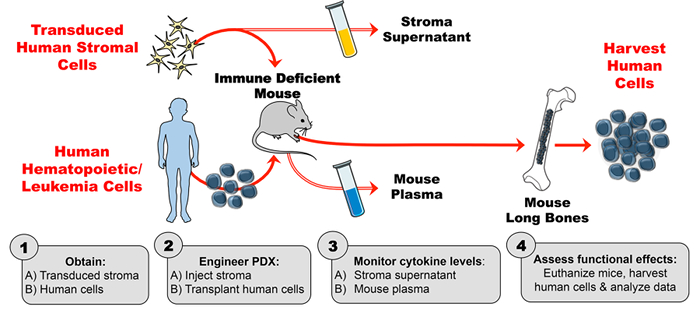
Рисунок 1: Модель PDX, разработанная для производства экзогенного человеческого цитокина у мышей. ( 1A ) Проектный эксперимент и получение трансдуцированных человеческих стромальных клеток ( 1B ). Получают человеческие клетки (гемопоэтические стволовые клетки, клетки лейкемии и т . Д.) Для получения PDX (полученных пациентом ксенотрансплантатов) мышей. ( 2A ) Инжектируют сконструированную строму и ( 2B ) трансплантируют человеческие клетки в иммунодефицитных мышей согласно экспериментальному графику. ( 3A-B ) Контролировать концентрации цитокинов в супернатанте стромы и мышиной плазме с помощью ELISA. ( 4 ) Убирать человеческие клетки и оценивать функциональные эффекты in vivo человеческого цитокина, присутствующего в PDX. Пожалуйста, нажмите здесьДля просмотра увеличенной версии этого рисунка.
Доставка человеческого цитокина через стромальные клетки имеет как преимущества, так и недостатки по сравнению с другими методами доставки / продуцирования человеческих цитокинов у мышей PDX. 7 По сравнению с инъекцией рекомбинантного человеческого цитокина опосредованная стромой доставка обычно менее дорогостоящая (стоимость культуры стромальных клеток меньше, чем стоимость рекомбинантного цитокина) и менее трудоемкая (одна инъекция в неделю по сравнению с несколькими инъекциями в неделю). Проблема короткого периода полужизни цитокинов также смягчается, поскольку строма постоянно создает экзогенный цитокин. Доставка цитокина посредством гидродинамического введения ДНК может быть менее дорогостоящей, чем доставка через строму. Тем не менее, он аналогичен временному и может потребовать более технических навыков, чем простая еженедельная внутрибрюшинная инъекция, необходимая для опосредованной стромой доставки. Экспрессия гена лентивирусов в мыши может обеспечить меньшуюМетод доставки цитокинов; Однако, в наших руках физиологические уровни TSLP не были достигнуты. Кроме того, этот метод является трудоемким, требующим непрерывного получения лентивирусного вектора. Мыши с трансгенным или выбитым концом обладают стабильной долговременной экспрессией цитокина и могут быть сконструированы для тканеспецифичной экспрессии, что может быть преимуществом. С другой стороны, трансгенная экспрессия гена цитокина человека на фоне иммунодефицитных мышей, требуемая для мышей PDX, требует огромных инвестиций в ресурсы до того, как будет установлена ценность модели. Кроме того, трансгенные модели обычно не позволяют варьировать время начала цитокинов или уровень продукции цитокинов in vivo . Это может быть достигнуто с помощью опосредованной стромой доставки, просто изменяя временной момент для начала инъекции стромальных клеток или дозу вводимых стромальных клеток.
Метод доставки цитокинов, опосредованный стромальными клеткамиOd, подробно описанная здесь, была использована для разработки PDX для оценки роли TSLP в развитии нормальной B-клетки человека 4,6 и острой лимфобластной лейкемии B-клеток высокого риска. 6 Этот метод обеспечивает альтернативный метод доставки цитокинов для использования при создании сходных моделей с человеческими цитокинами, отличными от TSLP. Эта модель также может быть полезна для создания предварительных данных, которые могут помочь определить, будет ли ценность модели PDX, трансгенной по цитокину или цитокину, достойной значительных временных и денежных инвестиций.
Protocol
Representative Results
Discussion
Эта рукопись описывает простой, быстрый и относительно недорогой способ разработки PDX для экспрессии человеческого цитокина. Стратегия, описанная здесь, основана на еженедельных внутрибрюшинных инъекциях линии стромальных клеток, трансдуцированных для экспрессии человеческого цит?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by NIH R21CA162259, NIH R01CA209829, NIH P20 MD006988, NIH 2R25 GM060507, a Hyundai Hope on Wheels Scholar Hope Grant, the Department of Pathology and Human Anatomy, the Department of Basic Sciences, and the Center for Health Disparities and Molecular Medicine at Loma Linda University School of Medicine and by a Grant to Promote Collaborative and Translational Research from Loma Linda University (KJP). The content is solely the responsibility of the authors and does not necessarily represent the official views of the NIH.
Materials
| Wet lab reagents | |||
| T-25 Nunc Cell Culture Treated EasYFlasks, 7 mL capacity, 25cm² culture area | Thermo Scientific / Fisher | 156367 | |
| T-75 Falcon Tissue Culture Treated Flask, 250 mL capacity, 75 cm² culture area & vented cap | Corning Inc. / Fisher | 353136 | |
| T-150 Falcon Tissue Culture Treated Flask, 600 mL capacity, 150 cm² culture area & vented cap | Corning Inc. / Fisher | 355001 | |
| 10 mL serological pipettes | Falcon | 357551 | |
| 15 mL polypropylene conical tubes | Fisher | 05-539-12 | |
| 5 mL round-bottom polystyrene tubes | Falcon | 352054 | |
| 50 mL polypropylene conical tubes | Falcon | 352098 | |
| 2.0 mL cryogenic vials, externally threaded | Corning Inc. / Fisher | 4230659 | |
| 1 mL pipette tips | Fisher | 2707509 | |
| 200 μL pipette tips | Denville Scientific | P3020-CPS | |
| 10 μL pipette tips | Denville Scientific | P-1096-CP | |
| Sterile Disposable Filter Units with SFCA Membrane, Nalgene Rapid-Flow | Fisher | 09-740-28D | |
| 2N H2SO4 | BioLegend | 423001 | |
| Dulbecco’s phosphate-buffered saline (PBS) without calicium and magnesium, 1× | Corning cellgro/ Mediatech | 21-031-CV | |
| Human TSLP ELISA Max Deluxe Set | BioLegend | 434204 | |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies | 7060 | |
| Trypan Blue | Corning | 25-900-Cl | |
| "Trypsin" 1x 0.25% Trypsin 2.21 mM EDTA in HBSS | ThermoFisher | 25-053 | |
| TWEEN 20 BioXtra | Sigma-Aldrich | P-7949 | |
| “R10” cell culture medium, % of total volume (makes 565 mL) | – | – | Lab Recipe |
| RPMI, 88.5% (500 mL) | Mediatech | 10-040-CV | |
| FBS, 9.9% (56 mL) | Mediatech | 35-011-CV | |
| L-Glutamine, 0.99% (5.6 mL) | Mediatech | 25-005-Cl | |
| Penicillin-Streptomycin, 0.50% (2.8 mL) | Mediatech | 30-002-Cl | |
| 2-Mercaptoethanol, 0.10% (560 µL) | MP | 190242 | |
| “R20” cell culture medium, % of total volume (makes 195 mL) | – | – | Lab Recipe |
| RPMI, 76.84% (150 mL) | see above | see above | |
| FBS, 20.49% (40 mL) | see above | see above | |
| 2mM L-glutamine, 1.02% (2 mL) | see above | see above | |
| 1mM Na pyruvate, 1.02% (2 mL ) | see above | see above | |
| Penicillin-Streptomycin, 0.51% (1 mL) | see above | see above | |
| 2-Mercaptoethanol, 0.10% (0.1 M), 0.10% (200 µL) | see above | see above | |
| “Freezing medium”, % of total volume | – | – | Lab Recipe |
| “R10” medium, 45% | see "R10" recipe | – | |
| FBS, 20% | see above | 35-011-CV | |
| DMSO, 10% | Corning | 25-950-CQC | |
| D(-)(+)-Trehalose dihydrate, 5% | Fisher Scientific | BP2687-100 | |
| Name | Company | Catolog Number | Comments |
| Biologics | |||
| "HS-27" HS-27A human stroma line | ATCC | CRL-2496 | |
| "CALL-4" MHH-CALL-4 cell line, human B cell precursor leukemia | DSMZ | ACC 337 | |
| “NSG mice” NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, male or female, age 6 – 8 weeks | JAX Mice | # 005557 | |
| MUTZ-5 cell line, human B cell precursor leukemia | DSMZ | ACC 490 | |
| Recombinant Human TSLP protein | R&D Systems | 1398-TS-010 | |
| Name | Company | Catolog Number | Comments |
| Flow cytomery antibodies (clone)* | |||
| Anti-mouse CD45 FITC (30F11) | Miltenyi Biotec | 130-102-778 | |
| CD127 PE (MB15-18C9) (alternate name is IL-7Rα) | Miltenyi Biotec | 130-098-094 | |
| CD34 APC (8G12) | BD Biosciences | 340667 | |
| CD45 PE-Cy7 (HI30) | eBioscience | 25-0459 | |
| "FVD" Fixable viability dye eFluor 780 | eBioscience | 65-0865 | |
| Ig κ light chain FITC (G20-193) | BD Pharmingen | 555791 | |
| Ig λ light chain FITC (JDC-12) | BD Pharmingen | 561379 | |
| IgD PE (IA6-2) | BioLegend | 348203 | |
| IgM PE-Cy5 (G20-127) | BD Biosciences | 551079 | |
| pSTAT5 PE, mouse anti-STAT5 (pY694) | BD PhosphoFlow | 612567 | |
| Name | Company | Catolog Number | Comments |
| Other materials & equipment | |||
| Animal Implantable Nano Transponder with Canula | Trovan | ID-100B(1.25) | |
| EMLA lidocaine anesthetic cream (obtain by presciption through animal care facility) | perscription | perscription | |
| BD ½ cc LO-DOSE U-100 Insulin Syringe 28G½ | BD | #329461 | |
| BD Microtainer Tubes with K2EDTA | BD | #365974 | |
| Centrifuge | Beckman Coulter | Alegra X-15R | |
| FisherBrand Capillary Tubes (Heparinized) | Fisher Scientific | 22-260-950 | |
| Hemocytometer | Fisher | 02-671-6 | |
| MACSQuant Analyzer 10 | Miltenyi Biotec | 130-096-343 | |
| Mouse Pie Cage | Braintree Scientific, Inc. | MPC-1 | |
| Mouse Tail Illuminator Restrainer | Braintree Scientific, Inc. | MTI STD | |
| Pistol Grip Implanter | Trovan | IM-300(1.25) | |
| µQuant | Bio-Tek Instruments Inc. | MQX200 | |
| FlowJo flow cytometry analysis software | FlowJo, LLC | Version 10 | |
| *All antibodies are anti-human unless otherwise stated. |
References
- Francis, O. L., Milford, T. A., Beldiman, C., Payne, K. J. Fine-tuning patient-derived xenograft models for precision medicine approaches in leukemia. J Investig Med. 64 (3), 740-744 (2016).
- Parrish, Y. K., et al. IL-7 Dependence in human B lymphopoiesis increases during progression of ontogeny from cord blood to bone marrow. J Immunol. 182 (7), 4255-4266 (2009).
- Johnson, S. E., Shah, N., Panoskaltsis-Mortari, A., LeBien, T. W. Murine and human IL-7 activate STAT5 and induce proliferation of normal human pro-B cells. J Immunol. 175 (11), 7325-7331 (2005).
- Milford, T. A., et al. TSLP or IL-7 provide an IL-7Ralpha signal that is critical for human B lymphopoiesis. Eur J Immunol. 46 (9), 2155-2161 (2016).
- Reche, P. A., et al. Human thymic stromal lymphopoietin preferentially stimulates myeloid cells. J Immunol. 167 (1), 336-343 (2001).
- Francis, O. L., et al. A novel xenograft model to study the role of TSLP-induced CRLF2 signals in normal and malignant human B lymphopoiesis. Haematologica. 101 (4), 417-426 (2016).
- Willinger, T., Rongvaux, A., Strowig, T., Manz, M. G., Flavell, R. A. Improving human hemato-lymphoid-system mice by cytokine knock-in gene replacement. Trends Immunol. 32 (7), 321-327 (2011).
- Graf, L., Iwata, M., Torok-Storb, B. Gene expression profiling of the functionally distinct human bone marrow stromal cell lines HS-5 and HS-27a. Blood. 100 (4), 1509-1511 (2002).
- Follenzi, A., Ailles, L. E., Bakovic, S., Geuna, M., Naldini, L. Gene transfer by lentiviral vectors is limited by nuclear translocation and rescued by HIV-1 pol sequences. Nat Genet. 25 (2), 217-222 (2000).
- Li, M., Husic, N., Lin, Y., Snider, B. J. Production of lentiviral vectors for transducing cells from the central nervous system. J Vis Exp. (63), e4031 (2012).
- Cockrell, A. S., Kafri, T. Gene delivery by lentivirus vectors. Mol Biotechnol. 36 (3), 184-204 (2007).
- Ricardo, R., Phelan, K. Freezing, thawing, and packaging cells for transport. J Vis Exp. (17), (2008).
- Tasian, S. K., et al. Aberrant STAT5 and PI3K/mTOR pathway signaling occurs in human CRLF2-rearranged B-precursor acute lymphoblastic leukemia. Blood. 120 (4), 833-842 (2012).
- Kalaitzidis, D., Neel, B. G. Flow-cytometric phosphoprotein analysis reveals agonist and temporal differences in responses of murine hematopoietic stem/progenitor cells. PLoS One. 3 (11), (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. (67), (2012).
- Kovacsics, D., Raper, J. Transient expression of proteins by hydrodynamic gene delivery in mice. J Vis Exp. (87), (2014).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Pearson, T., Greiner, D. L., Shultz, L. D. Chapter 15, Creation of "humanized" mice to study human immunity. Curr Protoc Immunol. , (2008).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. J Vis Exp. (17), (2008).
- Scheeren, F. A., et al. Thymic stromal lymphopoietin induces early human B-cell proliferation and differentiation. Eur J Immunol. 40 (4), 955-965 (2010).
- Lee, E. B., et al. Increased serum thymic stromal lymphopoietin in children with atopic dermatitis. Pediatr Allergy Immunol. 21 (2 Pt 2), e457-e460 (2010).

