Cytokine-induced stromal cell line 주입에 의한 환자 유래 이종 이식편에서의 외인성 사이토 카인의 발현
Summary
여기에 서술 된 것은 환자 – 유도 된 이종 이식 (PDX) 마우스에서 사이토 카인 – 형질 감염된 간질 세포주의 매주 복강 내 주사를 통해 외인성 사이토킨을 생산하는 방법이다. 이 방법은 PDX의 유용성을 넓히고 다양한 PDX 모델에서 일시적 또는 지속적인 외인성 사이토 카인 전달 옵션을 제공합니다.
Abstract
환자 유래 이종 이식 (PDX) 마우스는 사람 세포를 면역 결핍 마우스에 이식하여 생산됩니다. 이 모델은 정상 및 악성 조혈의 기전을 연구하는 데 중요한 도구이며 많은 악성 종양에 대한 효과적인 화학 요법을 식별하는 데있어 가장 중요한 표준입니다. PDX 모델은 많은 마우스 사이토 카인이 사람의 세포에도 작용하기 때문에 가능합니다. 그러나 이것은 인간 세포에서 정상 및 악성 조혈을 연구하는 데 중요한 여러 가지를 포함하여 모든 사이토 카인의 경우에는 해당되지 않습니다. 인간 사이토 카인 (형질 전환 및 knock-in 모델)을 생산하기 위해 마우스를 조작하는 기술은 모델의 유용성이 입증되기 전에 상당한 비용을 필요로합니다. 다른 기술은 노동 집약적이며 (재조합 시토 킨이나 렌티 바이러스의 주사), 어떤 경우에는 고도의 전문 기술 (DNA의 유체 역학적 주사)이 필요합니다. 이 보고서는 외인성 cy를 갖는 PDX 마우스를 생성하는 간단한 방법을 설명합니다tokine (TSLP, thymic stromal lymphopoietin) 을 매주 복강 내 주사하여 사이토 카인을 과발현시켰다. 이 방법의 사용은 마우스에서 순환하는 인간 사이토 카인의 생리 학적 수준을 달성하는 연속적인 사이토 카인 생산의 생체 내 공급원을 제공한다. 인간 사이토 카인의 혈장 수준은 주입 된 간질 세포의 수에 따라 다양 할 수 있으며, 사이토 카인 생산은 실험의 어느 시점에서 시작될 수있다. 이 방법은 또한 유사하게 생성되지만 대조군 벡터로 형질 도입 된 간질의 복강 내 주사를 통한 사이토 카인 – 음성 대조군 마우스를 포함한다. 우리는 TSLP를 발현하는 PDX로부터 수확 된 백혈병 세포가 대조군 PDX와 비교하여 원래 환자 샘플과 유사한 유전자 발현 패턴을 나타냄을 이전에 입증했다. 이 방법으로 생성 된 cytokine 생성 및 cytokine 음성 PDX 마우스를 함께 사용하면 우리가 성공적으로 연구 한 모델 시스템이 제공됩니다.정상 및 악성 조혈에서 TSLP의 역할.
Introduction
환자 유래 이종 이식편 (PDX)은 '원주민'포유류 환경에서 정상 및 악성 조혈 세포의 생산을 연구하기위한 강력한 생체 내 모델입니다. 대부분 PDX는 사람의 세포를 면역 결핍 마우스에 주사하거나 이식하여 생산됩니다. 정상적인 인간 조혈 줄기 세포를 이용한 PDX의 생성은 정상적인 사람의 혈액과 면역 세포의 생체 내 연구를 가능하게합니다. 백혈병이나 다른 암세포에서 생산 된 PDX는 종양 발생 기전을 연구하고 인간 개체군에 존재하는 유전 적 경관과 돌연변이의 범위에서 효과적인 치료법을 확인하는 것을 가능하게합니다. 결과적으로 PDX는 효과적인 치료 방법을 밝히기위한 병리학 생물 의학 연구의 현재 표준이자 암 진행 메커니즘을 이해하는 데 중요한 도구입니다. PDX 모델은 특정 질병으로 인한 건강 불균형 질환에 대한 연구를 지원하는 필수 도구입니다. 유전 병변, 또는 환자의 유전 적 변이가 종양 발생 및 치료 결과에 실질적으로 기여할 수있는 임의의 질환을 포함한다.
마우스 – 인간 PDX 모델은 많은 마우스 사이토 카인이 인간 세포의 사이토 카인 수용체를 쥐 내부에있는 동안 활성화 시키는데있어서 인간 유사체를 적절히 모방하기 때문에 가능하다. 예를 들어, 인터루킨 -7 (IL-7)은 인간 B 세포 발달에 중대한 신호를 제공합니다. 2 마우스 IL-7은 마우스 사이토 카인이 인간 B 세포 전구체에서 신호 전달 경로를 자극한다는 점에서 인간 IL-7과 충분한 상 동성을 갖는다. 그러나 다른 cytokine (IL-3, 과립구 – macrophage colony stimulating factor (GM-CSF), 줄기 세포 인자 (SCF)) 중에서 thymic stromal lymphopoietin (TSLP) ,정상 및 악성 인간 조혈 모세포의 생산에있어서 중요하다. 마우스 및 인간 사이토 카인이 낮은 상 동성을 나타내는 경우, 마우스 사이토 카인은 인간 세포상의 각각의 수용체를 활성화시키지 않는다. 이러한 장애를 극복하기 위해, 많은 전략이 사용되어왔다 PDX 생쥐에서 인간 사이토 카인의 발현을 조작하는 방법으로 재조합 인간 사이토 카인의 주입, DNA의 유체 역학적 주사, 렌티 바이러스 발현, 형질 전환 발현 및 knockin 유전자 교체가 포함된다 .7 이 보고서는 간질 매개 를 통해 인간 사이토 카인을 생산하는 PDX 사이토 카인 전달 ( 그림 1 ).
여기에 설명 된 방법에서 PDX 마우스는 인간 사이토 카인, TSLP를 발현 시키거나 사이토 카인 음성 대조군으로 기능하도록 조작됩니다. TSLP를 발현하는 PDX는 인간 TSLP의 높은 수준을 발현하도록 형질 도입 된 간질 세포를 매주 복강 내 주사함으로써 달성된다.사이토 카인 – 음성 PDX "대조군"마우스도 유사하게 조작된다; 대조 기질은 대조군 벡터로 형질 도입된다. 이 방법은 TSLP + 간질을 주사 한 PDX 마우스에서 인간 TSLP의 정상적인 생리 학적 수준을 달성합니다. 사이토 카인 – 음성 간질을받는 PDX 마우스에서 검출 가능한 TSLP는 관찰되지 않았다. 우리는 연구에서 인간 간질 세포주 HS-27A를 선택했다. 왜냐하면 배양에서 견고하게 성장하고, 공 배양에서 분리 된 전구 세포의 증식을 지원하지 않는 매우 낮은 수준의 사이토 카인 생산을 보여주기 때문이다. 인간 TSLP 발현을 위해 기질은 이전에 기술 된 백본에서 유래 된 선진적인자가 – 비활성화 벡터 lentiviral vector로 형질 도입되었으며 cPPT / cts 요소와 woodguck hepatitis post-transcriptional regulatory element (WPRE)를 포함하여 도입 유전자 발현을 증가시켰다. 인간 TSLP 유전자는 신장 인자 -1의 조절하에이 벡터에 구축되었다(EF-1) 알파 프로모터를 이용하여 견고하고 구성 적이며 장기적인 발현을 달성 할 수 있습니다.
이 human-cytokine enhanced PDX 모델의 공학은 4 가지 주요 단계로 구성됩니다. 첫째, 형질 전환 된 기질은 체외에서 증식되고 안정되고 높은 수준의 사이토 카인 생산을 위해 효소 결합 면역 흡착 분석법 (ELISA)에 의해 평가된다. 둘째, 형질 감염된 간질 세포에 의해 생성 된 인간 사이토 카인의 활성 (및 대조 간질로부터의 사이토킨 활성의 결핍)이 인 – 흐름 세포 계측법을 사용하여 검증된다. 관심있는 사이토 카인 (이 경우, TSLP)에 반응하는 것으로 알려진 세포주를 간질 세포 상등액과 함께 배양하고 사이토 카인 – 유도 된 인산화를 분석 하였다. 셋째, 마우스에게 형질 도입 된 인간 간질을 주사 한 다음 마우스 혈장을 주 1 회 기준으로 인간 사이토 카인의 수준을 ELISA로 평가한다. 넷째, 인간의 조혈 세포를 이식하고, 인간 사이토 카인의 생체 내 기능적 효과를 알려진 표적에서 평가한다 ( <em> 예. 세포 집단).
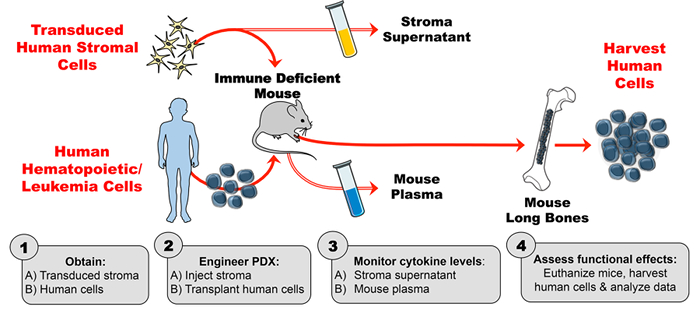
그림 1 : 마우스에서 외인성 인간 사이토 카인을 생산하도록 설계된 PDX 모델. ( 1A ) 디자인 실험 및 형질 도입 된 인간 간질 세포 획득 ( 1B ) 인간 세포 (조혈 줄기 세포, 백혈병 세포 등 )를 얻어 PDX (환자 유래 이종 이식) 마우스를 만듭니다. ( 2A ) 조작 된 간질을 주입하고 ( 2B ) 인간의 세포를 실험 계획에 따라 면역 결핍 마우스에 이식합니다. ( 3A – B ) 간질 상층 액 및 마우스 혈장의 사이토 카인 농도를 ELISA로 모니터링하십시오. ( 4 ) 인간 세포를 수확하고 PDX에 존재하는 인간 사이토 카인의 생체 내 기능적 효과를 평가한다. 여기를 클릭하십시오.이 그림의 더 큰 버전을 볼 수 있습니다.
간질 세포 를 통한 인간 사이토 카인의 전달은 PDX 마우스에서 인간 사이토 카인 을 전달 / 생산하는 다른 방법과 비교할 때 장점 및 단점을 제공한다. 재조합 인간 사이토 카인의 주입과 비교하여, 간질 매개 전달은 일반적으로 덜 비싸다 (간질 세포 배양 비용은 재조합 시토 킨 비용보다 적음). 노동 집약도 적다 (1 주일에 1 회 주사 대 주당 복수 주사). 간질이 지속적으로 외인성 사이토 카인을 생성하기 때문에 짧은 사이토 카인 반감기의 문제 또한 완화된다. DNA의 유체 역학적 주사를 통한 사이토 카인의 전달 은 간질 을 통한 전달보다 비용이 적게 든다. 그러나, 그것은 일시적이며 간질 매개 전달에 필요한 간단한 주간 복강 주사보다 기술적 인 기술이 필요할 수 있습니다. 마우스에서의 렌티 바이러스 유전자 발현은 더 적은 트랩을 제공 할 수있다사이토 카인 전달의 새로운 방법; 그러나 우리 손에 생리적 인 TSLP 수치는 달성되지 않았습니다. 또한이 방법은 노동 집약적이며 렌티 바이러스 벡터를 지속적으로 생산해야합니다. 트랜스 제닉 또는 노크 – 인 (knock-in) 마우스는 사이토 카인의 장기간 안정한 발현을 제공하며, 조직 특이 적 발현을 위해 조작 될 수있어 이점이 될 수있다. 반면에, PDX 마우스에 필요한 면역 결핍 마우스 배경에서의 인간 사이토 카인 유전자의 형질 전환 발현은 모델의 가치가 확립되기 전에 막대한 자원의 투자를 필요로한다. 또한, 형질 전환 모델은 일반적으로 사이토 카인 개시의시기 또는 생체 내 사이토 카인 생산의 수준을 변화시키는 옵션을 허용하지 않는다. 이들은 간질 세포 주입의 시작 시점 또는 주입 된 간질 세포의 투여 량을 단순히 변경함으로써 간질 매개 전달에 의해 달성 될 수있다.
간질 세포 매개 cytokine delivery meth여기에 자세하게 설명 된 것은 정상 인간 B 세포 발달 4 및 6 및 고위험 B 세포 급성 림프 구성 백혈병에서 TSLP의 역할을 평가하기위한 PDX를 개발하는 데 사용되었습니다. 이 방법은 TSLP 이외의 인간 사이토 카인으로 유사한 모델을 생성하는데 사용하기위한 대안적인 사이토 카인 전달 방법을 제공한다. 이 모델은 또한 시토 킨 트랜스 제닉 또는 사이토 카인 노크 – 인 PDX 모델의 가치가 상당한 시간과 돈 투자에 합당한지를 결정하는 데 도움이되는 예비 데이터를 생성하는데 유용 할 수있다.
Protocol
Representative Results
Discussion
이 원고는 PDX를 조작하여 외인성 인간 사이토 카인을 발현하는 간단하고 신속하며 상대적으로 비용 효율적인 방법을 설명합니다. 여기에 설명 된 전략은 인간 사이토 카인, TSLP를 표현하기 위해 형질 도입 된 간질 세포주의 주간 복강 주사에 기초합니다. 여기에 설명 된 방법을 수행하기 전에, 높은 수준의 관심있는 사이토킨 (TSLP)을 발현하도록 조작 된 간질 및 유사하게 조작 된 간질이 생성되었…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by NIH R21CA162259, NIH R01CA209829, NIH P20 MD006988, NIH 2R25 GM060507, a Hyundai Hope on Wheels Scholar Hope Grant, the Department of Pathology and Human Anatomy, the Department of Basic Sciences, and the Center for Health Disparities and Molecular Medicine at Loma Linda University School of Medicine and by a Grant to Promote Collaborative and Translational Research from Loma Linda University (KJP). The content is solely the responsibility of the authors and does not necessarily represent the official views of the NIH.
Materials
| Wet lab reagents | |||
| T-25 Nunc Cell Culture Treated EasYFlasks, 7 mL capacity, 25cm² culture area | Thermo Scientific / Fisher | 156367 | |
| T-75 Falcon Tissue Culture Treated Flask, 250 mL capacity, 75 cm² culture area & vented cap | Corning Inc. / Fisher | 353136 | |
| T-150 Falcon Tissue Culture Treated Flask, 600 mL capacity, 150 cm² culture area & vented cap | Corning Inc. / Fisher | 355001 | |
| 10 mL serological pipettes | Falcon | 357551 | |
| 15 mL polypropylene conical tubes | Fisher | 05-539-12 | |
| 5 mL round-bottom polystyrene tubes | Falcon | 352054 | |
| 50 mL polypropylene conical tubes | Falcon | 352098 | |
| 2.0 mL cryogenic vials, externally threaded | Corning Inc. / Fisher | 4230659 | |
| 1 mL pipette tips | Fisher | 2707509 | |
| 200 μL pipette tips | Denville Scientific | P3020-CPS | |
| 10 μL pipette tips | Denville Scientific | P-1096-CP | |
| Sterile Disposable Filter Units with SFCA Membrane, Nalgene Rapid-Flow | Fisher | 09-740-28D | |
| 2N H2SO4 | BioLegend | 423001 | |
| Dulbecco’s phosphate-buffered saline (PBS) without calicium and magnesium, 1× | Corning cellgro/ Mediatech | 21-031-CV | |
| Human TSLP ELISA Max Deluxe Set | BioLegend | 434204 | |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies | 7060 | |
| Trypan Blue | Corning | 25-900-Cl | |
| "Trypsin" 1x 0.25% Trypsin 2.21 mM EDTA in HBSS | ThermoFisher | 25-053 | |
| TWEEN 20 BioXtra | Sigma-Aldrich | P-7949 | |
| “R10” cell culture medium, % of total volume (makes 565 mL) | – | – | Lab Recipe |
| RPMI, 88.5% (500 mL) | Mediatech | 10-040-CV | |
| FBS, 9.9% (56 mL) | Mediatech | 35-011-CV | |
| L-Glutamine, 0.99% (5.6 mL) | Mediatech | 25-005-Cl | |
| Penicillin-Streptomycin, 0.50% (2.8 mL) | Mediatech | 30-002-Cl | |
| 2-Mercaptoethanol, 0.10% (560 µL) | MP | 190242 | |
| “R20” cell culture medium, % of total volume (makes 195 mL) | – | – | Lab Recipe |
| RPMI, 76.84% (150 mL) | see above | see above | |
| FBS, 20.49% (40 mL) | see above | see above | |
| 2mM L-glutamine, 1.02% (2 mL) | see above | see above | |
| 1mM Na pyruvate, 1.02% (2 mL ) | see above | see above | |
| Penicillin-Streptomycin, 0.51% (1 mL) | see above | see above | |
| 2-Mercaptoethanol, 0.10% (0.1 M), 0.10% (200 µL) | see above | see above | |
| “Freezing medium”, % of total volume | – | – | Lab Recipe |
| “R10” medium, 45% | see "R10" recipe | – | |
| FBS, 20% | see above | 35-011-CV | |
| DMSO, 10% | Corning | 25-950-CQC | |
| D(-)(+)-Trehalose dihydrate, 5% | Fisher Scientific | BP2687-100 | |
| Name | Company | Catolog Number | Comments |
| Biologics | |||
| "HS-27" HS-27A human stroma line | ATCC | CRL-2496 | |
| "CALL-4" MHH-CALL-4 cell line, human B cell precursor leukemia | DSMZ | ACC 337 | |
| “NSG mice” NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, male or female, age 6 – 8 weeks | JAX Mice | # 005557 | |
| MUTZ-5 cell line, human B cell precursor leukemia | DSMZ | ACC 490 | |
| Recombinant Human TSLP protein | R&D Systems | 1398-TS-010 | |
| Name | Company | Catolog Number | Comments |
| Flow cytomery antibodies (clone)* | |||
| Anti-mouse CD45 FITC (30F11) | Miltenyi Biotec | 130-102-778 | |
| CD127 PE (MB15-18C9) (alternate name is IL-7Rα) | Miltenyi Biotec | 130-098-094 | |
| CD34 APC (8G12) | BD Biosciences | 340667 | |
| CD45 PE-Cy7 (HI30) | eBioscience | 25-0459 | |
| "FVD" Fixable viability dye eFluor 780 | eBioscience | 65-0865 | |
| Ig κ light chain FITC (G20-193) | BD Pharmingen | 555791 | |
| Ig λ light chain FITC (JDC-12) | BD Pharmingen | 561379 | |
| IgD PE (IA6-2) | BioLegend | 348203 | |
| IgM PE-Cy5 (G20-127) | BD Biosciences | 551079 | |
| pSTAT5 PE, mouse anti-STAT5 (pY694) | BD PhosphoFlow | 612567 | |
| Name | Company | Catolog Number | Comments |
| Other materials & equipment | |||
| Animal Implantable Nano Transponder with Canula | Trovan | ID-100B(1.25) | |
| EMLA lidocaine anesthetic cream (obtain by presciption through animal care facility) | perscription | perscription | |
| BD ½ cc LO-DOSE U-100 Insulin Syringe 28G½ | BD | #329461 | |
| BD Microtainer Tubes with K2EDTA | BD | #365974 | |
| Centrifuge | Beckman Coulter | Alegra X-15R | |
| FisherBrand Capillary Tubes (Heparinized) | Fisher Scientific | 22-260-950 | |
| Hemocytometer | Fisher | 02-671-6 | |
| MACSQuant Analyzer 10 | Miltenyi Biotec | 130-096-343 | |
| Mouse Pie Cage | Braintree Scientific, Inc. | MPC-1 | |
| Mouse Tail Illuminator Restrainer | Braintree Scientific, Inc. | MTI STD | |
| Pistol Grip Implanter | Trovan | IM-300(1.25) | |
| µQuant | Bio-Tek Instruments Inc. | MQX200 | |
| FlowJo flow cytometry analysis software | FlowJo, LLC | Version 10 | |
| *All antibodies are anti-human unless otherwise stated. |
References
- Francis, O. L., Milford, T. A., Beldiman, C., Payne, K. J. Fine-tuning patient-derived xenograft models for precision medicine approaches in leukemia. J Investig Med. 64 (3), 740-744 (2016).
- Parrish, Y. K., et al. IL-7 Dependence in human B lymphopoiesis increases during progression of ontogeny from cord blood to bone marrow. J Immunol. 182 (7), 4255-4266 (2009).
- Johnson, S. E., Shah, N., Panoskaltsis-Mortari, A., LeBien, T. W. Murine and human IL-7 activate STAT5 and induce proliferation of normal human pro-B cells. J Immunol. 175 (11), 7325-7331 (2005).
- Milford, T. A., et al. TSLP or IL-7 provide an IL-7Ralpha signal that is critical for human B lymphopoiesis. Eur J Immunol. 46 (9), 2155-2161 (2016).
- Reche, P. A., et al. Human thymic stromal lymphopoietin preferentially stimulates myeloid cells. J Immunol. 167 (1), 336-343 (2001).
- Francis, O. L., et al. A novel xenograft model to study the role of TSLP-induced CRLF2 signals in normal and malignant human B lymphopoiesis. Haematologica. 101 (4), 417-426 (2016).
- Willinger, T., Rongvaux, A., Strowig, T., Manz, M. G., Flavell, R. A. Improving human hemato-lymphoid-system mice by cytokine knock-in gene replacement. Trends Immunol. 32 (7), 321-327 (2011).
- Graf, L., Iwata, M., Torok-Storb, B. Gene expression profiling of the functionally distinct human bone marrow stromal cell lines HS-5 and HS-27a. Blood. 100 (4), 1509-1511 (2002).
- Follenzi, A., Ailles, L. E., Bakovic, S., Geuna, M., Naldini, L. Gene transfer by lentiviral vectors is limited by nuclear translocation and rescued by HIV-1 pol sequences. Nat Genet. 25 (2), 217-222 (2000).
- Li, M., Husic, N., Lin, Y., Snider, B. J. Production of lentiviral vectors for transducing cells from the central nervous system. J Vis Exp. (63), e4031 (2012).
- Cockrell, A. S., Kafri, T. Gene delivery by lentivirus vectors. Mol Biotechnol. 36 (3), 184-204 (2007).
- Ricardo, R., Phelan, K. Freezing, thawing, and packaging cells for transport. J Vis Exp. (17), (2008).
- Tasian, S. K., et al. Aberrant STAT5 and PI3K/mTOR pathway signaling occurs in human CRLF2-rearranged B-precursor acute lymphoblastic leukemia. Blood. 120 (4), 833-842 (2012).
- Kalaitzidis, D., Neel, B. G. Flow-cytometric phosphoprotein analysis reveals agonist and temporal differences in responses of murine hematopoietic stem/progenitor cells. PLoS One. 3 (11), (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. (67), (2012).
- Kovacsics, D., Raper, J. Transient expression of proteins by hydrodynamic gene delivery in mice. J Vis Exp. (87), (2014).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Pearson, T., Greiner, D. L., Shultz, L. D. Chapter 15, Creation of "humanized" mice to study human immunity. Curr Protoc Immunol. , (2008).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. J Vis Exp. (17), (2008).
- Scheeren, F. A., et al. Thymic stromal lymphopoietin induces early human B-cell proliferation and differentiation. Eur J Immunol. 40 (4), 955-965 (2010).
- Lee, E. B., et al. Increased serum thymic stromal lymphopoietin in children with atopic dermatitis. Pediatr Allergy Immunol. 21 (2 Pt 2), e457-e460 (2010).

