Messung neuronaler Mechanismen, die der schlafabhängigen Gedächtniskonsolidierung während der Naps in der frühen Kindheit zugrunde liegen
Summary
Dieses Protokoll beschreibt Methoden zur Untersuchung neuronaler Mechanismen, die der schlafabhängigen Gedächtniskonsolidierung während der Nickerchen in der frühen Kindheit zugrunde liegen. Es umfasst Verfahren zur Untersuchung der Auswirkungen des Schlafes auf die Leistung des Verhaltensgedächtnisses sowie die Anwendung und Aufzeichnung sowohl der Polysomnographie als auch der Aktigraphie.
Abstract
Schlaf ist entscheidend für das tägliche Funktionieren. Eine wichtige Funktion des Schlafes ist die Konsolidierung von Erinnerungen, ein Prozess, der sie stärker und weniger anfällig für Interferenzen macht. Die neuronalen Mechanismen, die dem Nutzen des Schlafes für das Gedächtnis zugrunde liegen, können mit Derpolysomnographie (PSG) untersucht werden. PSG ist eine Kombination von physiologischen Aufzeichnungen, einschließlich Signale aus dem Gehirn (EEG), Augen (EOG), und Muskeln (EMG), die verwendet werden, um Schlafstadien zu klassifizieren. In diesem Protokoll beschreiben wir, wie PSG in Verbindung mit Verhaltensgedächtnisbewertungen, Aktigraphie und Elternbericht verwendet werden kann, um die schlafabhängige Speicherkonsolidierung zu untersuchen. Der Schwerpunkt dieses Protokolls liegt auf der frühen Kindheit, einer Phase von Bedeutung, da Kinder vom biphasischen Schlaf (bestehend aus einem Nickerchen und Nachtschlaf) zu monophasischem Schlaf (nur Übernachtung) übergehen. Die Auswirkungen des Schlafes auf die Gedächtnisleistung werden mit Hilfe einer visuospatialMemory-Bewertung über Schlaf- und Wachruhephasen gemessen. Eine Kombination aus Aktigraphie und Elternbericht wird verwendet, um Schlafrhythmen zu bewerten (d. h. Kinder als gewöhnliche oder nicht gewöhnliche Napper zu charakterisieren). Schließlich wird PSG verwendet, um Schlafstadien und Qualitäten dieser Stadien (wie Frequenzen und das Vorhandensein von Spindeln) während der Nickerchen zu charakterisieren. Der Vorteil der Verwendung von PSG ist, dass es das einzige Derzeit verfügbare Tool ist, um schlafqualität und Schlafarchitektur zu bewerten, was auf den relevanten Gehirnzustand verweist, der die Speicherkonsolidierung unterstützt. Die Haupteinschränkungen von PSG sind die Länge der Zeit, die es braucht, um die Aufnahmemontage vorzubereiten und dass Aufnahmen in der Regel über einen gekauften Schlaf übernommen werden. Diese Einschränkungen können überwunden werden, indem junge Teilnehmer in ablenkende Aufgaben während der Anwendung eingebunden werden und PSG mit Aktigraphie- und Selbst-/Elternberichtsmaßnahmen kombiniert wird, um Schlafzyklen zu charakterisieren. Zusammen ermöglicht diese einzigartige Kombination von Methoden Untersuchungen darüber, wie Nickerchen das Lernen bei Vorschulkindern unterstützen.
Introduction
Angesichts der Prävalenz des Schlafes in unserer täglichen Routine ist es wichtig, seine Funktion zu verstehen. Studien mit diesem Ziel erfordern eine genaue Messung des Schlafes. Polysomnographie (PSG) ist das Gold-Standard-Maß für Schlaf. PSG ermöglicht eine objektive, quantitative Messung des Schlafes mit hoher zeitlicher Auflösung und kann sowohl für Forschungszwecke als auch für klinische Zwecke nützlich sein. PSG ist eine Kombination aus physiologischen Aufnahmen. Eine PSG-Montage umfasst mindestens folgende Maßnahmen: Elektroenzephalographie (EEG), Elektrookulographie (EOG) und Elektromyographie (EMG). Diese Maßnahmen bewerten elektrische Potenziale aus dem Gehirn, den Augen und den Muskeln und ermöglichen eine Klassifizierung der Schlafstadien (siehe Abbildung 1). Andere Maßnahmen, wie Elektrokardiographie (EKG), Atmung und Pulsoximetrie können aufgenommen werden, um das Vorhandensein von gestörtem Schlaf zu identifizieren.
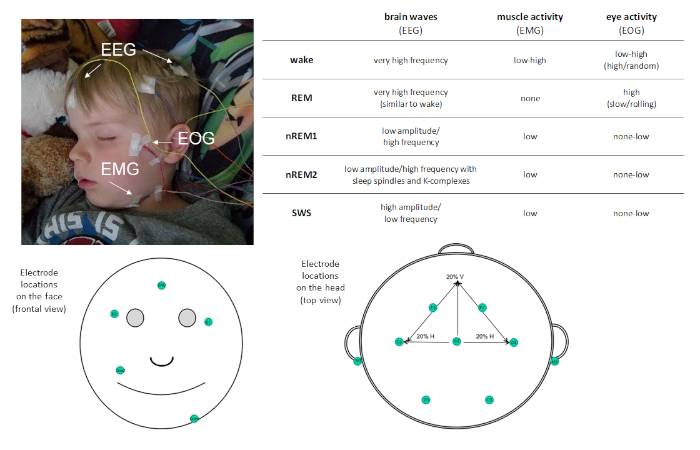
Abbildung 1: Beispielfürbeiner Platzierung und Beschreibung der über PSG aufgezeichneten Aktivität. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
PSG ermöglicht die Charakterisiert in vier unterschiedliche Schlafstadien: Nicht-schnelle Augenbewegung (nicht-REM) Stufe 1 (nREM1; 4-7 Hz), Nicht-REM-Stufe 2 (nREM2; 12-15 Hz) und Nicht-REM-Stufe 3 (besser bekannt als langsamer Wellenschlaf [SWS]; 0,5-4 Hz) und Schnellaugenbewegung (REM ) schlafen. nREM1 markiert den Schlafbeginn und wird anhand eines reduzierten Muskeltonus in der EMG-Umcodierung und gemischten Amplituden-EEG-Oszillationen relativ zum Alpha identifiziert, das im Ruhenden beobachtet wurde. Es folgen nREM2, das sich durch das Vorhandensein von Schlafspindeln (kurze Ausbrüche der Sigma-Frequenzaktivität; 11-16 Hz) und K-Komplexe (einzelne Langsamwellen, die sich von der umgebenden Aktivität abheben) im EEG unterscheiden kann. SWS zeichnet sich durch ausgeprägte langsamfrequente EEG-Oszillationen mit hoher Frequenz aus. REM-Schlaf ist gekennzeichnet durch schnelle low-amplitude oszillatole Gehirnaktivität sehr ähnlich wie während der Wache beobachtet. Was den REM-Schlaf jedoch vom Wake unterscheidet, ist, dass er sich auch durch phasische schnelle Augenbewegungen (daher der Moniker REM) und Muskelatonia auszeichnet. Im Laufe eines Schlafkampfes werden Schlafphasen zyklisch mit einer Geschwindigkeit von ca. 90 min/Zyklus erlebt.
Schlaf folgt auch dem zirkadianen Rhythmus, mit Schlafanfällen, die in 24-h-Zyklen stattfinden. Schlaf-Timing und Konsistenz können die Schlaffunktion beeinflussen und sind auch wichtig zu beurteilen. Obwohl PSG notwendig ist, um Schlafstadien zu charakterisieren, ist es zeitaufwändig anzuwenden und daher nicht ideal für die Beurteilung mehrerer Schlafanfälle (z. B. mehrere Nächte Schlaf, Nickerchen und Nachtschlaf). Dafür ist die Aktigraphie von Vorteil. Die Aktigraphie verwendet einen dreiachsigen Beschleunigungsmesser, typischerweise am Handgelenk, um den Schlaf basierend auf der Abwesenheit von Bewegung zu schätzen. Obwohl Die Aktigraphie nicht zur Charakterisierung von Schlafstadien verwendet werden kann, hat es sich bei der Erkennung von Schlafbeginn und -aufbruch (einschließlich Schlaffragmentierung oder Aufwachen nach Schlafbeginn) bei einer Reihe von Populationen, von Säuglingen1 bis zu älteren Erwachsenen, als zuverlässig erwiesen2 . Sowohl PSG als auch Aktigraphie sind bevorzugte Methoden gegenüber Selbst-/Elternberichtsmaßnahmen. Selbst-/Elternberichtsmaßnahmen sind einfach zu verwalten und relativ kostengünstig, unterliegen jedoch auch Voreingenommenheit und Nichteinhaltung. Schließlich ist es erwähnenswert, dass diese Methoden in Kombination verwendet werden können, um die Stärken der einzelnen zu nutzen. Beispielsweise kann PSG mit Aktigraphie und/oder Selbst-/Elternbericht kombiniert werden, um sowohl die Schlafqualität über Nacht als auch die Überprüfung von Schlafmengen oder Schlaf-Wach-Zyklen, insbesondere über lange Dauern (z. B. Wochen oder Monate), zu erhalten.
Eine Funktion des Schlafes, die besonderes Interesse geweckt hat, ist die schlafabhängige Gedächtniskonsolidierung, die Verarbeitung von Erinnerungen, die sie stärker und weniger anfällig fürInterferenzen3 macht. Obwohl die Gedächtniskonsolidierung während des Aufwachens bei Kindern4 und Erwachsenen5stattfinden kann, gibt es wesentliche Beweise dafür, dass die Konsolidierung während des Schlafes verbessert wird. Frühere Forschungen haben Verhaltensbeispiele für die schlafabhängige Gedächtniskonsolidierung geliefert, indem Veränderungen der Speicherleistung nach einem Intervall von Schlaf (z. B. 20.00 bis 8.00 Uhr) mit Veränderungen nach einem äquivalenten Intervall verglichen wurden, das wach verbracht wurde (z. B. 8 bis 20 Uhr). Bei Erwachsenen, Erinnerungen sind geschützt6 oder sogar verbessert7 nach einem Intervall des Schlafes, während Erinnerungen in der Regel über ein gleichwertiges Intervall der Wache zerfallen. Es wurden Kontrollen verwendet, die Leistungsänderungen von zirkadianen Einflüssen8,9,10trennen. Zum Beispiel werden ähnliche Vorteile des Schlafes beobachtet, wenn die Leistung über ein Mittagsschläfchen mit einer gleichwertigen Wachzeit am Mittag9verglichen wird.
Obwohl Schlaf einst gedacht wurde, um einen passiven Prozess zu reflektieren, einfach Schutz erinnerungen vor Verfall oder Interferenzen, moderne Theorien deuten darauf hin, Schlaf spielt eine aktivere Rolle und fördert tatsächlich das Gedächtnis durch Reaktivierungen11,12 ,13. Unterstützung dafür kommt von beobachteten Korrelationen zwischen Verhaltensmessungen der Gedächtniskonsolidierung über Schlaf (Änderung der Gedächtnisabruf nach dem Schlafenden im Vergleich zu vor dem Schlaf) und bestimmten Aspekten der Schlafphysiologie. Bei vielen deklarativen Speicheraufgaben ist die Speicherkonsolidierung mit Aspekten des Nicht-REM-Schlafs verbunden, insbesondere mit Messungen von SWS oder Schlafspindeln in nREM2 und SWS. Wenn die Rolle des Schlafes ein passiver Schutz vor Interferenzen wäre, wäre eine solche Korrelation nicht zu erwarten; eher eine Korrelation zwischen der Schlafzeit (unabhängig vom Schlafstadium) und der Leistung wäre zu erwarten, da mehr Zeit im Schlaf mehr Schutz vor Interferenzen bieten würde14.
Zusätzliche Unterstützung für die aktive Rolle von SWS bei der Speicherkonsolidierung zeigt sich in Studien zur gezielten Speicherreaktivierung. In diesen Studien wird ein Gedächtnis im Kontext eines Wahrnehmungshinweises erlernt, z. B. ein Geruch, und der Rückruf des Gedächtnisses ist nach dem Schlaf größer, wenn der Cue während des Schlafes wieder präsentiert wird, insbesondere SWS15. Obwohl der zugrunde liegende Mechanismus debattiert wird16,17, eine prominente Theorie, Systemkonsolidierungstheorie, behauptet, dass Erinnerungen im Hippocampus kodiert werden im Kortex durch Hippocampus-neokortikalen Dialog stabilisiert. Insbesondere kortikale langsame Wellen und Schlafspindeln, die in Verbindung mit Hippocampus-Wellen im Zusammenhang mit Derspeicherreaktivierung auftreten, unterstützen die Speicherübertragung3.
Die Rolle des Schlafes bei der Gedächtniskonsolidierung während der Entwicklung ist weniger klar. Die frühe Kindheit ist eine Zeit von besonderem Interesse, da Kinder beginnen, von einem biphasischen (bestehend aus einem Mittagsschlaf und einem Schlafanfall über Nacht) zu einem monophasischen Schlafmuster überzusteigen. Jüngste Forschungen deuten darauf hin, dass dieser Übergang die Reifung des Gehirns widerspiegeln kann18. Dieses Argument stimmt mit empirischen Daten überein, die Entwicklungsveränderungen im Nachtschlaf (d. h. Topographie der langsamen Wellenaktivität) zeigen, die der kortikalen Reifung19.
Obwohl es mehrere Verhaltensdemonstrationen der schlafabhängigen Konsolidierung über Nacht bei Kindern20,21 und Säuglingen22gibt, sind Die Forschung entolischen Grundlagen der Gedächtniskonsolidierung mit Mittagsschlaf gerade erst untersucht werden. In bahnbrechenden Arbeiten zur Untersuchung der Rolle von Mittagsschlaf bei Vorschulkindern wurden Nickerchen gezeigt, um Erinnerungen an kürzlich erlernte Informationen zu schützen, während das Gedächtnis reduziert wurde (um 12 %) wenn Kinder während des Nickerchenintervalls wach blieben23. Dieser “Schnappschuss” war am größten bei Kindern, die gewohnheitsmäßig (d. h. 5 oder mehr Mal pro Woche gemessen mit Aktigraphie) unabhängig von ihrem Alter. Durch die Aufzeichnung von PSG während des Nickerchens wurde festgestellt, dass die Änderung der Speicherleistung während der Nickerchen-Periode speziell mit der Schlafspindeldichte (die Anzahl der Schlafspindeln pro Minute nREM) in Verbindung gebracht wurde, was darauf hindeutet, dass die Qualität des Nickerchens (nicht die Quantität) ein entscheidender Faktor bei der Förderung der Speicheraufbewahrung (siehe Abschnitt “Repräsentative Ergebnisse”).
Diese Studie unterstreicht die Bedeutung von PSG bei der Erforschung der Beziehungen zwischen Schlaf und Gedächtnis während der Entwicklung. Es weist darauf hin, wie wichtig es ist, Schlafmakro- (Schlafstadien) und Mikrostrukturen (Qualitäten dieser Stufen wie Frequenzen und das Vorhandensein von Spindeln) Strukturen während der Nickerchen zur Speicherkonsolidierung zu charakterisieren. Es unterstreicht auch die Bedeutung der Bewertung von Schlafrhythmen (die Kinder als gewöhnliche oder nicht gewöhnliche Napper charakterisieren). Obwohl unsere Arbeit die Funktion von Nickerchen im visuospatialen Lernen (und in jüngerer Zeit emotionale24 und prozedurale25 Lernen) charakterisiert hat, bleiben viele Fragen. So wird es beispielsweise wichtig sein, andere deklarative Speicheraufgaben zu untersuchen, um die Verallgemeinerbarkeit dieser Ergebnisse zu bewerten und Aufgaben zu bewerten, die in Vorschulklassen verwendet werden, um bestimmte Parameter (z. B. Höhe des Nickerchens im Vergleich zum Lernen) für ökologisch gültige Aufgaben. Zusätzliche Arbeit ist auch erforderlich, um zu verstehen, wann die Aktivierung für die Speicherkonsolidierung ausreicht. Unser Ziel ist es daher, den Prozess der Schlafmessung und schlafabhängigen Gedächtniskonsolidierung bei Kindern zu entmystifizieren. Wir geben praktische Tipps für die Untersuchung des Nutzens eines Nachmittags-Naplaus auf deklaratives Gedächtnis bei typischerweise entwickelnden Vorschulkindern (ca. 3 bis 4 Jahre alt) mit einer computergestützten visuospatial Memory-Aufgabe sowie Methoden zur Beurteilung der Unzeitnahzeit mit Aktigraphie, Elternbericht und Nickerchenphysiologie mit PSG. Obwohl diese Methoden für Kinder im Vorschulalter entwickelt wurden, die mit unterschiedlicher Häufigkeit ein Nickerchen machen, konnten diese Methoden an jede Altersgruppe angepasst werden.
Protocol
Representative Results
Discussion
In diesem Artikel wird beschrieben, wie Sie die schlafabhängige Konsolidierung des deklarativen Gedächtnisses während der Nickerchen in der frühen Kindheit untersuchen. Zu den Methoden gehören die Verhaltensbeurteilung des Gedächtnisses über Nickerchen und Wachbedingungen, Aktigraphie und Elternbericht zur Beurteilung von Schlafzyklen und PSG zur Bewertung der Schlafarchitektur. Diese einzigartige Kombination ist entscheidend für die Beurteilung des Gedächtnisses, die Charakterisierung von Schlafzyklen und die U…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Autoren danken dem Neurocognitive Development Lab der University of Maryland, College Park und dem Somneuro Lab der University of Massachusetts, Amherst für die Unterstützung bei diesem Projekt. Die Finanzierung erfolgte durch NIH (HD094758) und NSF (BCS 1749280) für TR und RS. Repräsentative Ergebnisse wurden von NIH HL111695 finanziert.
Materials
| Actiwatch Spectrum Plus Starter Kit | Philips Respironics | 1109516 | Includes: Actiwatch Spectrum Plus Device, Actiware Software License, and manual |
| Actiware software | Philips Respironics | 1114828 | Alternatives may be available. |
| Brain Analyzer | Brain Products | BV-BP-170-1000 | Alternatives may be available. |
| Dell Latitude 5580 Laptop | Dell | X5580T [210-AKJR] | Laptop for running MatLab, Actiware, and RemLogic as well as storing/uploading data |
| EC2 cream | Grass | 12643 | Possible alternatives include Ten20 paste and Lic2 electride cream |
| Embla REMLogic software | Natus Medical Inc. | 21475 | Alternatives may be available. |
| Embletta MPR PG Sys – XR – US | Natus Medical Inc. | 12077 | Embletta system for PSG recordings |
| Embletta MPR ST + Proxy Kit | Natus Medical Inc. | 12696 | Attachment to Embletta to record PSG sensors |
| Nuprep cleaning solution | Natus Medical Inc. | 12643 | Possible alternatives may be available. |
| Sleep Supplies Starter Kit for Embletta MPR ST/ST + Proxy | Natus Medical Inc. | 12643 | Started kit for sleeping including guaze, EC2 cream, NuPrep cleaning solution, cotton swabs and more. |
References
- Sadeh, A., Acebo, C., Seifer, R., Aytur, S., Carskadon, M. A. Activity-based assessment of sleep-wake patterns during the 1st year of life. Infant Behavioral Development. 18 (3), 329-337 (1998).
- Sadeh, A., Urbach, D., Lavie, P. Actigraphically-based automatic bedtime sleep-wake scoring: Validity and clinical applications. Journal Ambulatory Monitoring. 2 (3), 209-216 (1989).
- Rasch, B., Born, J. About sleep’s role in memory. Physiological Reviews. 93, 681-766 (2013).
- Werchan, D. M., Gómez, R. L. Wakefulness (not sleep) promotes generalization of word learning in 2.5-year-old children. Child Development. 85 (2), 429-436 (2014).
- Wang, J. Y., Weber, F. D., Zinke, K., Inostroza, M., Born, J. More effective consolidation of episodic long-term memory in children than adults-unrelated to sleep. Child Development. 89 (5), 1720-1734 (2018).
- Sonni, A., Spencer, R. M. C. Sleep protects memories from interference in older adults. Neurobiology of Aging. 36 (7), 2272-2281 (2015).
- Marshall, L., Helgadóttir, H., Mölle, M., Born, J. Boosting slow oscillations during sleep potentiates memory. Nature. 444 (7119), 610-613 (2006).
- Baran, B., Wilson, J., Spencer, R. M. C. REM-dependent repair of competitive memory suppression. Experimental Brain Research. 203 (2), 471-477 (2010).
- Diekelmann, S., Born, J. The memory function of sleep. Nature Reviews Neuroscience. 11 (2), 114-126 (2010).
- Stickgold, R. Sleep dependent memory consolidation. Nature. 437 (27), 1272-1278 (2005).
- Dudai, Y., Karni, A., Born, J. The consolidation and transformation of memory. Neuron. 88 (1), 20-32 (2010).
- Feld, G. B., Born, J. Sculpting memory during sleep: concurrent consolidation and forgetting. Current Opinion in Neurobiology. 44, 20-27 (2017).
- Staresina, B. P., et al. Hierarchical nesting of slow oscillations, spindles and ripples in the human hippocampus during sleep. Nature Neuroscience. 18 (11), 1679-1686 (2015).
- Ellenbogen, J. M., Payne, J. D., Stickgold, R. The role of sleep in declarative memory consolidation: passive, permissive, active or none?. Current Opinion Neurobiology. 16 (6), 716-722 (2006).
- Oudiette, D., Paller, K. A. Upgrading the sleeping brain with targeted memory reactivation. Trends in Cognitive Sciences. 17 (3), 142-149 (2013).
- Yonelinas, A. P., Ranganath, C., Ekstrom, A. D., Wiltgen, B. J. A contextual binding theory of episodic memory: systems consolidation reconsidered. Nature Reviews Neuroscience. 20, 364-375 (2019).
- Antony, J. W., Schapiro, A. C. Active and effective replay: systems consolidation reconsidered again. Nature Reviews Neuroscience. , (2019).
- Lam, J., Mahone, E. M., Mason, T., Scharf, S. M. The effects of napping on cognitive function in preschoolers. Journal of Developmental & Behavioral Pediatrics. 32 (2), 90-97 (2011).
- Kurth, S., Ringli, M., Geiger, A., Lebourgeois, M., Jenni, O. G., Huber, R. High-density sleep electroencephalogram study. Journal of Neuroscience. 30 (40), 13211-13219 (2010).
- Backhaus, J., Hoeckesfeld, R., Born, J., Hohagen, F., Junghanns, K. Immediate as well as delayed post learning sleep but not wakefulness enhances declarative memory consolidation in children. Neurobiology of Learning and Memory. 89 (1), 76-80 (2008).
- Wilhelm, I., Diekelmann, S., Born, J. Sleep in children improves memory performance on declarative but not procedural tasks TT – Bei Kindern verbessert Schlaf die Gedächtnisleistung für deklarative aber nicht für prozedurale Aufgaben. Learning and Memory. 15 (5), 373-377 (2008).
- Seehagen, S., Konrad, C., Herbert, J. S., Schneider, S. Timely sleep facilitates declarative memory consolidation in infants. Proceedings of the National Academy of Sciences. 112 (5), 1625-1629 (2015).
- Kurdziel, L., Duclos, K., Spencer, R. M. C. Sleep spindles in midday naps enhance learning in preschool children. Proceedings of the National Academy of the Sciences of the United States of America. 110 (43), 17267-17272 (2013).
- Kurdziel, L. B. F., Kent, J., Spencer, R. M. C. Sleep-dependent enhancement of emotional memory in early childhood. Scientific Reports. 8 (12609), 1-10 (2018).
- Desrochers, P. C., Kurdziel, L. B. F., Spencer, R. M. C. Delayed benefit of naps on motor learning in preschool children. Experimental Brain Research. 234 (3), 763-772 (2016).
- Maldonado, C. C., Bentley, A. J., Mitchell, D. A pictorial sleepiness scale based on cartoon faces. Sleep. 27 (3), 541-548 (2004).
- Stern, R. A., Arruda, J. E., Hooper, C. R., Wolfner, G. D., Morey, C. E. Visual analogue mood scales to measure internal mood state in neurologically impaired patients: Description and initial validity evidence. Aphasiology. 11 (1), 59-71 (1997).
- Plihal, W., Born, J. Effects of early and late nocturnal sleep on indicators of procedural and declarative memory. Journal of Cognitive Neuroscience. 9 (4), 534-547 (1997).
- Donohue, K. C., Spencer, R. M. C. Continuous re-exposure to environmental sound cues during sleep does not improve memory for semantically unrelated word pairs. Journal of Cognitive Education and Psychology. 10 (2), 167-177 (2015).
- Wilson, J. K., Baran, B., Pace-Schott, E. F., Ivry, R. B., Spencer, R. M. C. Sleep modulates word-pair learning but not motor sequence learning in healthy older adults. Neurobiology of Aging. 33 (5), 991-1000 (2012).
- Wamsley, E. J., et al. Reduced sleep spindles and spindle coherence in schizophrenia: Mechanisms of impaired memory consolidation?. Biological Psychiatry. 71 (2), 154-161 (2012).
- Mölle, M., Bergmann, T. O., Marshall, L., Born, J. Fast and slow spindles during the sleep slow oscillation: Disparate coalescence and engagement in memory processing. Sleep. 34 (10), 1411-1421 (2011).
- Acebo, C., et al. Sleep/wake patterns derived from activity monitoring and maternal report for healthy 1- to 5-year-old children. Sleep. 28 (12), 1568-1577 (2005).
- Acebo, C., et al. Estimating sleep patterns with activity monitoring in children and adolescents: How many nights are necessary for reliable measures?. Sleep. 22 (1), 95-103 (1999).
- Geiger, A., et al. The sleep EEG as a marker of intellectual ability in school age children. Sleep. 34 (2), 181-189 (2011).
- Wagner, U., Gais, S., Born, J. Emotional memory formation is enhanced across sleep intervals with high amounts of rapid eye movement sleep. Learning and Memory. 8, 112-119 (2001).
- Gómez, R. L., Bootzin, R. R., Nadel, L. Naps promote abstraction in language-learning infants. Psychological Science. 17 (8), 670-674 (2006).
- Konrad, C., Herbert, J. S., Schneider, S., Seehagen, S. Gist extraction and sleep in 12-month-old infants. Neurobiology of Learning and Memory. 134, 216-220 (2016).

