Misurazione dei meccanismi neurali alla base del consolidamento della memoria dipendente dal sonno durante le sinisine nella prima infanzia
Summary
Questo protocollo descrive i metodi utilizzati per esaminare i meccanismi neurali alla base del consolidamento della memoria dipendente dal sonno durante i sonnellini nella prima infanzia. Include procedure per esaminare l’effetto del sonno sulle prestazioni della memoria comportamentale, nonché l’applicazione e la registrazione sia della polisonnografia che dell’attivigrafia.
Abstract
Il sonno è fondamentale per il funzionamento quotidiano. Una funzione importante del sonno è il consolidamento dei ricordi, un processo che li rende più forti e meno vulnerabili alle interferenze. I meccanismi neurali alla base del beneficio del sonno per la memoria possono essere studiati utilizzando la polisonnografia (PSG). PSG è una combinazione di registrazioni fisiologiche tra cui segnali dal cervello (EEG), occhi (EOG), e muscoli (EMG) che vengono utilizzati per classificare le fasi del sonno. In questo protocollo viene descritto come il PSG può essere utilizzato insieme a valutazioni di memoria comportamentale, attività e report padre per esaminare il consolidamento della memoria dipendente dal sonno. L’obiettivo di questo protocollo è sulla prima infanzia, un periodo di significato come i bambini passano dal sonno bifasico (costituito da un pisolino e sonno durante la notte) al sonno monofasico (solo sonno notturno). Gli effetti del sonno sulle prestazioni della memoria sono misurati utilizzando una valutazione della memoria visuospatiale tra i periodi di sonno e di riposo di veglia. Una combinazione di actigrafia e rapporto genitore viene utilizzata per valutare i ritmi del sonno (cioè, caratterizzando i bambini come napper abituali o non abituali). Infine, il PSG viene utilizzato per caratterizzare gli stadi del sonno e le qualità di tali stadi (come le frequenze e la presenza di mandrini) durante i sonnellini. Il vantaggio di utilizzare PSG è che è l’unico strumento attualmente disponibile per valutare la qualità del sonno e l’architettura del sonno, che punta allo stato del cervello rilevante che supporta il consolidamento della memoria. Le principali limitazioni del PSG sono il tempo necessario per preparare il montaggio di registrazione e che le registrazioni sono in genere prese in su un sonno acquistato. Queste limitazioni possono essere superate coinvolgendo i giovani partecipanti nel distrarre le attività durante l’applicazione e combinando il PSG con l’attività e le misure auto/genitore-segnalazione per caratterizzare i cicli del sonno. Insieme, questa combinazione unica di metodi consente indagini su come i sonnellini sostengono l’apprendimento nei bambini in età prescolare.
Introduction
Data la prevalenza del sonno nella nostra routine quotidiana, è importante capire la sua funzione. Gli studi con questo obiettivo richiedono una misurazione precisa del sonno. La polisonnografia (PSG) è la misura del sonno standard dell’oro. Il PSG consente una misurazione oggettiva e quantitativa del sonno ad alta risoluzione temporale e può essere utile sia per la ricerca che per scopi clinici. PSG è una combinazione di registrazioni fisiologiche. Come minimo, un montaggio PSG include le seguenti misure: elettroencefalografia (EEG), elettrooculografia (EOG) ed elettromiografia (EMG). Queste misure valutano i potenziali elettrici rispettivamente dal cervello, dagli occhi e dai muscoli e consentono la classificazione delle fasi del sonno (vedere la Figura 1). Altre misure, come l’elettrocardiografia (ECG), la respirazione e l’ossimetria a impulsi possono essere incluse per identificare la presenza di sonno disordinato.
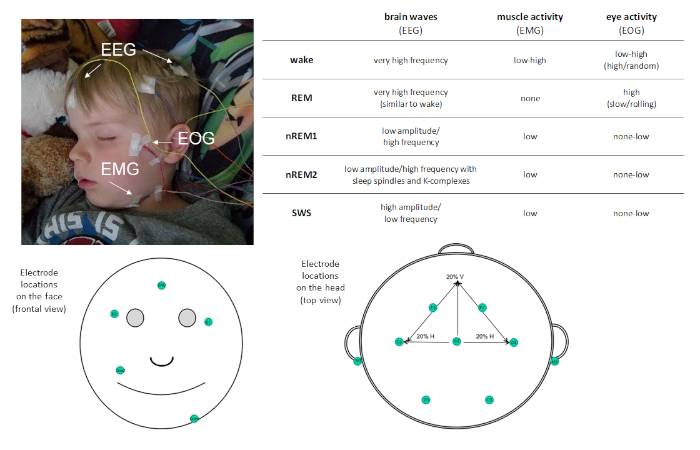
Figura 1: Posizionamento dell’elettrodo di esempio e descrizione dell’attività registrata tramite PSG. Fare clic qui per visualizzare una versione più grande di questa figura.
Il PSG permette di caratterizzare il sonno in quattro fasi distinte del sonno: movimento dell’occhio non rapido (non-REM) fase 1 (nREM1; 4-7 Hz), fase 2 non-REM (nREM2; 12-15 Hz), e fase 3 non-REM (più comunemente noto come sonno d’onda lenta [SWS]; 0,5-4 Hz) e movimento degli occhi rapidi (REM ) sonno. nREM1 segna l’insorgenza del sonno ed è identificato in base alla riduzione del tono muscolare nella ricodifica EMG e alle oscillazioni EEG di ampiezza mista rispetto all’alfa osservato nella scia a riposo. Questo è seguito da nREM2, che può essere distinto per la presenza di fusi del sonno (brevi raffiche di attività di frequenza sigma; 11-16 Hz) e K-complessi (singole onde lente che si distinguono dall’attività circostante) nell’EEG. SWS è caratterizzato da distinte oscillazioni EEG ad alta frequenza a bassa frequenza. Il sonno REM è caratterizzato da un’attività cerebrale oscillatossiva a bassa ampiezza veloce molto simile a quella osservata durante la scia. Tuttavia, ciò che distingue il sonno REM dalla scia è che è anche caratterizzato da movimenti phasici rapidi degli occhi (da qui il moniker REM) e atonia muscolare. Nel corso di un incontro di sonno, fasi di sonno sono sperimentati ciclicamente, ad un tasso di circa 90 min / ciclo.
Il sonno segue anche il ritmo circadiano, con gli out di sonno che si svolgono in cicli di 24 ore. La tempistica e la consistenza del sonno possono influenzare la funzione del sonno e sono anche importanti da valutare. Anche se il PSG è necessario per caratterizzare le fasi del sonno, l’applicazione richiede molto tempo e quindi non è ideale per valutare più interruzioni del sonno (ad esempio, più notti di sonno, sonnellini e sonno in notte). Per questo, l’attivigrafia è vantaggiosa. L’attività utilizza un accelerometro triassiale, tipicamente sul polso, per stimare il sonno in base all’assenza di movimento. Anche se l’attivigrafia non può essere utilizzata per caratterizzare le fasi del sonno, è stato dimostrato di essere affidabile nel rilevare l’insorgenza del sonno e l’insorgenza (compresa la frammentazione del sonno o la veglia dopo l’inizio del sonno) in una gamma di popolazioni, da1 ad adulti più anziani2 . Sia il PSG che l’attività sono metodi preferiti rispetto alle misure auto/genitore-relazione. Le misure di auto-relazione sono facili da amministrare e relativamente poco costose, tuttavia sono anche soggette a pregiudizi e inadempienza. Infine, vale la pena notare che questi metodi possono essere utilizzati in combinazione per capitalizzare i punti di forza di ciascuno. Ad esempio, il PSG può essere combinato con l’attività e/o il rapporto autonomo/padre per ottenere sia la qualità del sonno durante la notte che la verifica delle quantità di sonno o i cicli sonno-veglia, specialmente per lunghi durate (ad esempio, settimane o mesi).
Una funzione del sonno che ha raccolto particolare interesse è il consolidamento della memoria dipendente dal sonno, l’elaborazione di ricordi che li lascia più forti e meno vulnerabili alle interferenze3. Anche se il consolidamento della memoria può avvenire durante la scia nei bambini4 e adulti5, c’è una prova sostanziale che il consolidamento è migliorato durante il sonno. Ricerche precedenti hanno fornito esempi comportamentali di consolidamento della memoria dipendente dal sonno confrontando le modifiche nelle prestazioni della memoria dopo un intervallo di sonno (ad es. alle 8:00) alle modifiche in seguito a un intervallo equivalente trascorso a risveglio (ad es. alle 8:00). Negli adulti, ricordi sono protetti6 o addirittura migliorato7 dopo un intervallo di sonno, mentre i ricordi in genere decadono su un intervallo equivalente di veglia. Sono stati impiegati controlli che dissociano i cambiamenti di prestazioni dalle influenze circadiane8,9,10. Per esempio, benefici simili del sonno sono osservati quando si confrontano le prestazioni su un pisolino di mezzogiorno a un periodo di veglia di mezzogiorno equivalente9.
Anche se un tempo si pensava che il sonno riflettesse un processo passivo, semplicemente proteggendo i ricordi dal decadimento o dalle interferenze, le teorie moderne suggeriscono che il sonno gioca un ruolo più attivo e promuove effettivamente la memoria attraverso le riattivazioni11,12 ,13. Supporto per questo proviene da correlazioni osservate tra misure comportamentali di consolidamento della memoria sopra il sonno (cambiamento nel richiamo della memoria dopo il sonno rispetto a prima del sonno) e aspetti specifici della fisiologia del sonno. Per molte attività di memoria dichiarativa, il consolidamento della memoria è associato ad aspetti del sonno non REM, in particolare misure di SWS o assi del sonno trovati in nREM2 e SWS. Se il ruolo del sonno fosse la protezione passiva dalle interferenze, tale correlazione non ci si aspetterebbe; piuttosto una correlazione tra il tempo addormentato (indipendentemente dalla fase di sonno) e le prestazioni ci si aspetterebbe, come più tempo di sonno fornirebbe una maggiore protezionedall’interferenza 14.
Ulteriore supporto per il ruolo attivo di SWS nel consolidamento della memoria è evidente negli studi di riattivazione della memoria mirata. In questi studi, si apprende una memoria nel contesto di un segnale percettivo, ad esempio un odore, e richiamo della memoria è maggiore dopo il sonno se il segnale viene ripresentato durante il sonno, SWS in particolare15. Anche se il meccanismo sottostante è dibattuto16,17, una teoria prominente, teoria del consolidamento dei sistemi, sostiene che i ricordi codificati nell’ippocampo sono stabilizzati nella corteccia anche se il dialogo ippocampale-neocorticale. In particolare, le onde lente corticali e i fusi del sonno, che si verificano in combinazione con increspature ippocampali associate alla riattivazione della memoria, supportano il trasferimento di memoria3.
Il ruolo del sonno nel consolidamento della memoria durante lo sviluppo è meno chiaro. La prima infanzia è un periodo di particolare interesse quando i bambini iniziano a passare da un bifasico (costituito da un pisolino di mezzogiorno e un incontro di sonno notturno) a un modello di sonno monofasico. Recenti ricerche suggeriscono che questa transizione può riflettere la maturazione cerebrale18. Questo argomento è coerente con i dati empirici che mostrano cambiamenti di sviluppo nel sonno notturno (cioè, la topografia dell’attività a onde lente) rispecchia quello della maturazione corticale19.
Anche se ci sono diverse dimostrazioni comportamentali di consolidamento overnight sleep-dependent nei bambini20,21 e neonati22, ricerca sui fondamenti neurali del consolidamento della memoria con sonno di mezzogiorno sono appena cominciando ad essere indagato. Nel lavoro innovativo esaminando il ruolo dei sonnellini di mezzogiorno sulla memoria nei bambini in età prescolare, i sonnellini sono stati mostrati per proteggere i ricordi delle informazioni apprese di recente, mentre la memoria è stata ridotta (12%) quando i bambini sono rimasti svegli durante l’intervallo di pisolino23. Questo “beneficio”, era più grande nei bambini che dormivano abitualmente (cioè 5 o più volte alla settimana come misurato con l’attivigrafia) indipendentemente dalla loro età. Registrando il PSG durante il pisolino, il cambiamento delle prestazioni della memoria durante il periodo del pisolino è risultato specificamente associato alla densità del mandrino del sonno (il numero di assi del sonno al minuto di nREM), suggerendo che la qualità del pisolino (non la quantità) è stato un fattore critico promozione della conservazione della memoria (vedere la sezione dei risultati rappresentativi).
Questo studio mette in evidenza il significato del PSG nell’esplorare le relazioni tra sonno e memoria durante lo sviluppo. Sottolinea l’importanza di caratterizzare le strutture del sonno macro- (fasi del sonno) e micro- (qualità di tali stadi come le frequenze e la presenza di mandrini) strutture durante i sonnellini per il consolidamento della memoria. Sottolinea anche l’importanza di valutare i ritmi del sonno (caratterizzando i bambini come tonuper abituali o non abituali). Anche se il nostro lavoro ha caratterizzato la funzione dei sonnellini nell’apprendimento visuospatiale (e più recentemente emotivo24 e25 apprendimento procedurale), rimangono molte domande. Ad esempio, sarà importante esaminare altri compiti di memoria dichiarativa per valutare la generalizzabilità di questi risultati e valutare i compiti utilizzati nelle classi prescolare per comprendere parametri specifici (ad esempio, la quantità di beneficio del nap rispetto all’apprendimento) per compiti ecologicamente validi. Ulteriori lavori saranno inoltre necessari per capire quando wake è sufficiente per il consolidamento della memoria. Così, il nostro obiettivo è quello di demistificare il processo di misurazione del sonno e il consolidamento della memoria dipendente dal sonno nei bambini. Forniamo consigli pratici per esaminare il beneficio di un pisolino pomeridiano sulla memoria dichiarativa in tipicamente sviluppare bambini in età prescolare (circa 3-4 anni di età) utilizzando un compito computerizzato di memoria visuospatial e metodi per valutare l’abitualità del pisolino usando l’attivisia, il rapporto dei genitori e la fisiologia del pisolino usando il PSG. Anche se questi metodi sono stati sviluppati per i bambini in età prescolare che pisolino con frequenza variabile, questi metodi potrebbero essere adattati a qualsiasi fascia di età.
Protocol
Representative Results
Discussion
In questo articolo viene descritto come analizzare il consolidamento dipendente dal sonno della memoria dichiarativa durante i sonnellini nella prima infanzia. I metodi includono la valutazione comportamentale della memoria in base alle condizioni di sonaglio e di veglia, l’attivisia e il rapporto padre per valutare i cicli del sonno e il PSG per valutare l’architettura del sonno. Questa combinazione unica è fondamentale per la valutazione della memoria, caratterizzare i cicli del sonno, ed esaminare i meccanismi neural…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Gli autori desiderano ringraziare il Neurocognitive Development Lab dell’Università del Maryland, College Park e il Somneuro Lab presso l’Università del Massachusetts, Amherst per l’assistenza di questo progetto. I finanziamenti sono stati forniti da NIH (HD094758) e NSF (BCS 1749280) a TR e RS. I risultati rappresentativi sono stati finanziati da NIH HL111695.
Materials
| Actiwatch Spectrum Plus Starter Kit | Philips Respironics | 1109516 | Includes: Actiwatch Spectrum Plus Device, Actiware Software License, and manual |
| Actiware software | Philips Respironics | 1114828 | Alternatives may be available. |
| Brain Analyzer | Brain Products | BV-BP-170-1000 | Alternatives may be available. |
| Dell Latitude 5580 Laptop | Dell | X5580T [210-AKJR] | Laptop for running MatLab, Actiware, and RemLogic as well as storing/uploading data |
| EC2 cream | Grass | 12643 | Possible alternatives include Ten20 paste and Lic2 electride cream |
| Embla REMLogic software | Natus Medical Inc. | 21475 | Alternatives may be available. |
| Embletta MPR PG Sys – XR – US | Natus Medical Inc. | 12077 | Embletta system for PSG recordings |
| Embletta MPR ST + Proxy Kit | Natus Medical Inc. | 12696 | Attachment to Embletta to record PSG sensors |
| Nuprep cleaning solution | Natus Medical Inc. | 12643 | Possible alternatives may be available. |
| Sleep Supplies Starter Kit for Embletta MPR ST/ST + Proxy | Natus Medical Inc. | 12643 | Started kit for sleeping including guaze, EC2 cream, NuPrep cleaning solution, cotton swabs and more. |
References
- Sadeh, A., Acebo, C., Seifer, R., Aytur, S., Carskadon, M. A. Activity-based assessment of sleep-wake patterns during the 1st year of life. Infant Behavioral Development. 18 (3), 329-337 (1998).
- Sadeh, A., Urbach, D., Lavie, P. Actigraphically-based automatic bedtime sleep-wake scoring: Validity and clinical applications. Journal Ambulatory Monitoring. 2 (3), 209-216 (1989).
- Rasch, B., Born, J. About sleep’s role in memory. Physiological Reviews. 93, 681-766 (2013).
- Werchan, D. M., Gómez, R. L. Wakefulness (not sleep) promotes generalization of word learning in 2.5-year-old children. Child Development. 85 (2), 429-436 (2014).
- Wang, J. Y., Weber, F. D., Zinke, K., Inostroza, M., Born, J. More effective consolidation of episodic long-term memory in children than adults-unrelated to sleep. Child Development. 89 (5), 1720-1734 (2018).
- Sonni, A., Spencer, R. M. C. Sleep protects memories from interference in older adults. Neurobiology of Aging. 36 (7), 2272-2281 (2015).
- Marshall, L., Helgadóttir, H., Mölle, M., Born, J. Boosting slow oscillations during sleep potentiates memory. Nature. 444 (7119), 610-613 (2006).
- Baran, B., Wilson, J., Spencer, R. M. C. REM-dependent repair of competitive memory suppression. Experimental Brain Research. 203 (2), 471-477 (2010).
- Diekelmann, S., Born, J. The memory function of sleep. Nature Reviews Neuroscience. 11 (2), 114-126 (2010).
- Stickgold, R. Sleep dependent memory consolidation. Nature. 437 (27), 1272-1278 (2005).
- Dudai, Y., Karni, A., Born, J. The consolidation and transformation of memory. Neuron. 88 (1), 20-32 (2010).
- Feld, G. B., Born, J. Sculpting memory during sleep: concurrent consolidation and forgetting. Current Opinion in Neurobiology. 44, 20-27 (2017).
- Staresina, B. P., et al. Hierarchical nesting of slow oscillations, spindles and ripples in the human hippocampus during sleep. Nature Neuroscience. 18 (11), 1679-1686 (2015).
- Ellenbogen, J. M., Payne, J. D., Stickgold, R. The role of sleep in declarative memory consolidation: passive, permissive, active or none?. Current Opinion Neurobiology. 16 (6), 716-722 (2006).
- Oudiette, D., Paller, K. A. Upgrading the sleeping brain with targeted memory reactivation. Trends in Cognitive Sciences. 17 (3), 142-149 (2013).
- Yonelinas, A. P., Ranganath, C., Ekstrom, A. D., Wiltgen, B. J. A contextual binding theory of episodic memory: systems consolidation reconsidered. Nature Reviews Neuroscience. 20, 364-375 (2019).
- Antony, J. W., Schapiro, A. C. Active and effective replay: systems consolidation reconsidered again. Nature Reviews Neuroscience. , (2019).
- Lam, J., Mahone, E. M., Mason, T., Scharf, S. M. The effects of napping on cognitive function in preschoolers. Journal of Developmental & Behavioral Pediatrics. 32 (2), 90-97 (2011).
- Kurth, S., Ringli, M., Geiger, A., Lebourgeois, M., Jenni, O. G., Huber, R. High-density sleep electroencephalogram study. Journal of Neuroscience. 30 (40), 13211-13219 (2010).
- Backhaus, J., Hoeckesfeld, R., Born, J., Hohagen, F., Junghanns, K. Immediate as well as delayed post learning sleep but not wakefulness enhances declarative memory consolidation in children. Neurobiology of Learning and Memory. 89 (1), 76-80 (2008).
- Wilhelm, I., Diekelmann, S., Born, J. Sleep in children improves memory performance on declarative but not procedural tasks TT – Bei Kindern verbessert Schlaf die Gedächtnisleistung für deklarative aber nicht für prozedurale Aufgaben. Learning and Memory. 15 (5), 373-377 (2008).
- Seehagen, S., Konrad, C., Herbert, J. S., Schneider, S. Timely sleep facilitates declarative memory consolidation in infants. Proceedings of the National Academy of Sciences. 112 (5), 1625-1629 (2015).
- Kurdziel, L., Duclos, K., Spencer, R. M. C. Sleep spindles in midday naps enhance learning in preschool children. Proceedings of the National Academy of the Sciences of the United States of America. 110 (43), 17267-17272 (2013).
- Kurdziel, L. B. F., Kent, J., Spencer, R. M. C. Sleep-dependent enhancement of emotional memory in early childhood. Scientific Reports. 8 (12609), 1-10 (2018).
- Desrochers, P. C., Kurdziel, L. B. F., Spencer, R. M. C. Delayed benefit of naps on motor learning in preschool children. Experimental Brain Research. 234 (3), 763-772 (2016).
- Maldonado, C. C., Bentley, A. J., Mitchell, D. A pictorial sleepiness scale based on cartoon faces. Sleep. 27 (3), 541-548 (2004).
- Stern, R. A., Arruda, J. E., Hooper, C. R., Wolfner, G. D., Morey, C. E. Visual analogue mood scales to measure internal mood state in neurologically impaired patients: Description and initial validity evidence. Aphasiology. 11 (1), 59-71 (1997).
- Plihal, W., Born, J. Effects of early and late nocturnal sleep on indicators of procedural and declarative memory. Journal of Cognitive Neuroscience. 9 (4), 534-547 (1997).
- Donohue, K. C., Spencer, R. M. C. Continuous re-exposure to environmental sound cues during sleep does not improve memory for semantically unrelated word pairs. Journal of Cognitive Education and Psychology. 10 (2), 167-177 (2015).
- Wilson, J. K., Baran, B., Pace-Schott, E. F., Ivry, R. B., Spencer, R. M. C. Sleep modulates word-pair learning but not motor sequence learning in healthy older adults. Neurobiology of Aging. 33 (5), 991-1000 (2012).
- Wamsley, E. J., et al. Reduced sleep spindles and spindle coherence in schizophrenia: Mechanisms of impaired memory consolidation?. Biological Psychiatry. 71 (2), 154-161 (2012).
- Mölle, M., Bergmann, T. O., Marshall, L., Born, J. Fast and slow spindles during the sleep slow oscillation: Disparate coalescence and engagement in memory processing. Sleep. 34 (10), 1411-1421 (2011).
- Acebo, C., et al. Sleep/wake patterns derived from activity monitoring and maternal report for healthy 1- to 5-year-old children. Sleep. 28 (12), 1568-1577 (2005).
- Acebo, C., et al. Estimating sleep patterns with activity monitoring in children and adolescents: How many nights are necessary for reliable measures?. Sleep. 22 (1), 95-103 (1999).
- Geiger, A., et al. The sleep EEG as a marker of intellectual ability in school age children. Sleep. 34 (2), 181-189 (2011).
- Wagner, U., Gais, S., Born, J. Emotional memory formation is enhanced across sleep intervals with high amounts of rapid eye movement sleep. Learning and Memory. 8, 112-119 (2001).
- Gómez, R. L., Bootzin, R. R., Nadel, L. Naps promote abstraction in language-learning infants. Psychological Science. 17 (8), 670-674 (2006).
- Konrad, C., Herbert, J. S., Schneider, S., Seehagen, S. Gist extraction and sleep in 12-month-old infants. Neurobiology of Learning and Memory. 134, 216-220 (2016).

