Medición de los mecanismos neuronales subyacentes a la consolidación de la memoria dependiente del sueño durante las siestas en la primera infancia
Summary
Este protocolo describe los métodos utilizados para examinar los mecanismos neuronales subyacentes a la consolidación de la memoria dependiente del sueño durante las siestas en la primera infancia. Incluye procedimientos para examinar el efecto del sueño en el rendimiento de la memoria conductual, así como la aplicación y el registro de la polisonografía y la actigrafía.
Abstract
El sueño es fundamental para el funcionamiento diario. Una función importante del sueño es la consolidación de los recuerdos, un proceso que los hace más fuertes y menos vulnerables a la interferencia. Los mecanismos neuronales subyacentes al beneficio del sueño para la memoria se pueden investigar mediante polisomnografía (PSG). PSG es una combinación de grabaciones fisiológicas incluyendo señales del cerebro (EEG), ojos (EOG), y músculos (EMG) que se utilizan para clasificar las etapas del sueño. En este protocolo, se describe cómo se puede utilizar PSG junto con evaluaciones de memoria conductual, actigrafía e informe primario para examinar la consolidación de memoria dependiente del sueño. El enfoque de este protocolo se centra en la primera infancia, un período de importancia a medida que los niños pasan del sueño bifásico (que consiste en una siesta y sueño nocturno) al sueño monofásico (solo para dormir durante la noche). Los efectos del sueño en el rendimiento de la memoria se miden utilizando una evaluación de la memoria visuospatial a través de períodos de sueño y descanso despierto. Una combinación de actigrafía e informe de los padres se utiliza para evaluar los ritmos del sueño (es decir, caracterizar a los niños como nappers habituales o no habituales). Por último, el PSG se utiliza para caracterizar las etapas del sueño y las cualidades de esas etapas (como las frecuencias y la presencia de husillos) durante las siestas. La ventaja de usar PSG es que es la única herramienta disponible actualmente para evaluar la calidad del sueño y la arquitectura del sueño, apuntando al estado cerebral relevante que apoya la consolidación de la memoria. Las principales limitaciones del PSG son el tiempo que se tarda en preparar el montaje de grabación y que las grabaciones se toman típicamente sobre un sueño comprado. Estas limitaciones se pueden superar involucrando a los jóvenes participantes en tareas que distraen durante la aplicación y combinando PSG con actigrafía y medidas de auto-informe para caracterizar los ciclos de sueño. Juntos, esta combinación única de métodos permite investigaciones sobre cómo las siestas apoyan el aprendizaje en niños en edad preescolar.
Introduction
Dada la prevalencia del sueño en nuestra rutina diaria, es importante entender su función. Los estudios con este objetivo requieren una medición precisa del sueño. La polisomnografía (PSG) es la medida de sueño estándar de oro. PsG permite la medición objetiva y cuantitativa del sueño con alta resolución temporal y puede ser útil tanto para fines de investigación como clínicos. PSG es una combinación de grabaciones fisiológicas. Como mínimo, un montaje de PSG incluye las siguientes medidas: electroencefalografía (EEG), electrooculografía (EOG) y electromiografía (EMG). Estas medidas evalúan los potenciales eléctricos del cerebro, los ojos y los músculos respectivamente, y permiten la clasificación de las etapas del sueño (ver Figura 1). Se pueden incluir otras medidas, como la electrocardiografía (ECG), la respiración y la oximetría de pulso para identificar la presencia de sueño desordenado.
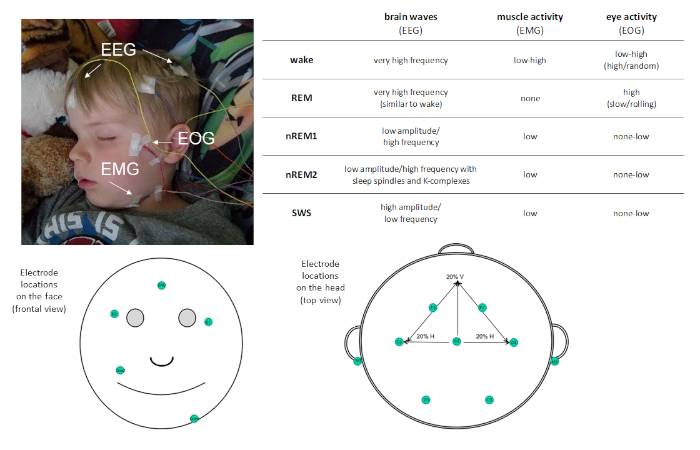
Figura 1: Ejemplo de colocación de electrodos y descripción de la actividad registrada a través de PSG. Haga clic aquí para ver una versión más grande de esta figura.
PsG permite que el sueño se caractertica en cuatro etapas distintas del sueño: movimiento ocular no rápido (no REM) etapa 1 (nREM1; 4-7 Hz), etapa no REM 2 (nREM2; 12-15 Hz), y etapa no REM 3 (más comúnmente conocido como sueño de onda lenta [SWS]; 0.5-4 Hz), y movimiento de ojos rápidos (REM ) dormir. nREM1 marca el inicio del sueño, y se identifica basado en el tono muscular reducido en la recodificación EMG y oscilaciones EEG de amplitud mixta en relación con el alfa observado en la estela en reposo. Esto es seguido por nREM2, que se puede distinguir por la presencia de husillos de sueño (ráfagas cortas de actividad de frecuencia sigma; 11-16 Hz) y complejos K (ondas lentas únicas que se destacan de la actividad circundante) en el EEG. SWS se caracteriza por oscilaciones EEG de alta amplitud de frecuencia lenta distintas. El sueño REM se caracteriza por una rápida actividad cerebral oscilatoria de baja amplitud muy similar a la observada durante la estela. Sin embargo, lo que distingue el sueño REM de la vigilia es que también se caracteriza por movimientos oculares rápidos fásicos (de ahí el apodo REM) y la atonía muscular. En el transcurso de una pelea de sueño, las etapas del sueño se experimentan cíclicamente, a una velocidad de aproximadamente 90 min/ciclo.
El sueño también sigue el ritmo circadiano, con peleas de sueño que tienen lugar en ciclos de 24-h. El tiempo de sueño y la consistencia pueden influir en la función del sueño y también son importantes para evaluar. Aunque el PSG es necesario para caracterizar las etapas del sueño, es lento aplicar y por lo tanto no es ideal para evaluar múltiples peleas de sueño (por ejemplo, varias noches de sueño, siestas y sueño durante la noche). Para ello, la actigrafía es beneficiosa. La actigrafía utiliza un acelerómetro triaxial, típicamente en la muñeca, para estimar el sueño basado en la ausencia de movimiento. Aunque la actigrafía no se puede utilizar para caracterizar las etapas del sueño, se ha demostrado que es fiable para detectar el inicio del sueño y la aparición de la estela (incluyendo la fragmentación del sueño o la estela después del inicio del sueño) en una serie de poblaciones de bebésde 1 a adultos mayores2 . Tanto el PSG como la actigrafía son métodos preferidos sobre las medidas de autoinforme.principal. Las medidas de autoinforme son fáciles de administrar y relativamente baratas, sin embargo, también están sujetas a sesgos e incumplimientos. Por último, vale la pena señalar que estos métodos se pueden utilizar en combinación para capitalizar las fortalezas de cada uno. Por ejemplo, el PSG se puede combinar con actigrafía y/o auto/padre-informe para obtener tanto la calidad del sueño durante la noche como la verificación de cantidades de sueño o ciclos de sueño-vigilia, especialmente durante largas duraciones (por ejemplo, semanas o meses).
Una función del sueño que ha despertado un interés particular es la consolidación de la memoria dependiente del sueño, el procesamiento de recuerdos que los deja más fuertes y menos vulnerables a la interferencia3. Aunque la consolidación de la memoria puede tener lugar durante la estela en niños4 y adultos5,hay evidencia sustancial de que la consolidación se mejora durante el sueño. Investigaciones anteriores han proporcionado ejemplos de comportamiento de consolidación de la memoria dependiente del sueño comparando los cambios en el rendimiento de la memoria después de un intervalo de sueño (por ejemplo, 8 pm-8 am) a los cambios después de un intervalo equivalente gastado despierto (por ejemplo, 8 am-8 pm). En los adultos, los recuerdos se protegen6 o incluso se mejoran7 después de un intervalo de sueño, mientras que los recuerdos suelen decaer en un intervalo equivalente de vigilia. Se han empleado controles que disocian los cambios de rendimiento de las influencias circadianas8,9,10. Por ejemplo, se observan beneficios similares del sueño al comparar el rendimiento durante una siesta de mediodía con un período de vigilia a mitad del día equivalente9.
Aunque una vez se pensó que el sueño reflejaba un proceso pasivo, simplemente protegiendo los recuerdos de la decadencia o interferencia, las teorías modernas sugieren que el sueño juega un papel más activo y realmente promueve la memoria a través de reactivaciones11,12 ,13. El apoyo a esto proviene de las correlaciones observadas entre las medidas conductuales de consolidación de la memoria sobre el sueño (cambio en la memoria después del sueño en comparación con antes del sueño) y aspectos específicos de la fisiología del sueño. Para muchas tareas de memoria declarativa, la consolidación de memoria está asociada con aspectos del sueño no REM, específicamente las medidas de SWS o husillos de suspensión que se encuentran en nREM2 y SWS. Si el papel del sueño fuera la protección pasiva contra la interferencia, no se esperaría tal correlación; más bien una correlación entre el tiempo dormido (independientemente de la etapa de sueño) y el rendimiento se esperaría, ya que más tiempo dormido proporcionaría más protección contra la interferencia14.
El soporte adicional para el papel activo de SWS en la consolidación de memoria es evidente en estudios de reactivación de memoria dirigida. En estos estudios, se aprende una memoria en el contexto de una señal perceptiva, por ejemplo un olor, y la memoria es mayor después del sueño si la cue se vuelve a presentar durante el sueño, SWS en particular15. Aunque el mecanismo subyacente se debate16,17, una teoría prominente, teoría de consolidación de sistemas, sostiene que los recuerdos codificados en el hipocampo se estabilizan en la corteza a través del diálogo hipocampal-neocortical. Específicamente, las ondas lentas corticales y los husillos del sueño, que se producen en combinación con ondas hipocampales asociadas con la reactivación de la memoria, apoyan la transferencia de memoria3.
El papel del sueño en la consolidación de la memoria durante el desarrollo es menos claro. La primera infancia es un período de especial interés a medida que los niños comienzan a pasar de una siesta bifásica (que consiste en una siesta del medio día y una pelea de sueño durante la noche) a un patrón de sueño monofásico. Investigaciones recientes sugieren que esta transición puede reflejar la maduración cerebral18. Este argumento es coherente con los datos empíricos que muestran los cambios en el desarrollo en el sueño nocturno (es decir, la topografía de la actividad de onda lenta) refleja el de la maduración cortical19.
Aunque hay varias demostraciones conductuales de consolidación nocturna dependiente del sueño en niños20,21 y bebés22,la investigación sobre los fundamentos neuronales de la consolidación de la memoria con el sueño del mediodía son empezando a ser investigado. En el trabajo innovador que examina el papel de las siestas de mediodía en la memoria en los niños en edad preescolar, se demostró que las siestas protegen los recuerdos de la información aprendida recientemente, mientras que la memoria se redujo (en un 12 %) cuando los niños permanecieron despiertos durante el intervalo de siesta23. Este “beneficio de la siesta” fue mayor en los niños que siestaban habitualmente (es decir, 5 o más veces por semana según se midió con actigrafía) independientemente de su edad. Al registrar el PSG durante la siesta, se encontró que el cambio en el rendimiento de la memoria a lo largo del período de la siesta se asociaba específicamente con la densidad del husillo del sueño (el número de husillos del sueño por minuto de nREM), lo que sugiere que la calidad de la siesta (no la cantidad) fue un factor crítico promover la retención de memoria (ver la sección de resultados representativos).
Este estudio destaca la importancia del PSG en la exploración de las relaciones entre el sueño y la memoria durante el desarrollo. Señala la importancia de caracterizar las estructuras de macro-(etapas del sueño) y micro- (cualidades de esas etapas como frecuencias y la presencia de husillos) durante las siestas para la consolidación de la memoria. También destaca la importancia de evaluar los ritmos del sueño (caracterizar a los niños como nappers habituales o no habituales). Aunque nuestro trabajo ha caracterizado la función de las siestas en el aprendizaje visuoespacial (y más recientemente el aprendizaje emocional24 y el aprendizaje procesal25), quedan muchas preguntas. Por ejemplo, será importante examinar otras tareas declarativas de memoria para evaluar la generalización de estos hallazgos y evaluar las tareas utilizadas en las aulas preescolares para comprender parámetros específicos (por ejemplo, la cantidad de beneficio de la siesta en relación con el aprendizaje) tareas ecológicamente válidas. También será necesario un trabajo adicional para comprender cuándo wake es suficiente para la consolidación de la memoria. Por lo tanto, nuestro objetivo es desmitificar el proceso de medición del sueño y la consolidación de la memoria dependiente del sueño en los niños. Proporcionamos consejos prácticos para examinar el beneficio de una siesta por la tarde en la memoria declarativa en los preescolares típicamente en desarrollo (aproximadamente de 3 a 4 años de edad) utilizando una tarea computarizada de memoria visuospatial, así como métodos para evaluar la habitualidad de la siesta usando la actigrafía, el informe de los padres y la fisiología de la siesta usando PSG. Aunque estos métodos fueron desarrollados para niños en edad preescolar que duermen la siesta con frecuencia variable, estos métodos podrían adaptarse a cualquier grupo de edad.
Protocol
Representative Results
Discussion
En este artículo se describe cómo investigar la consolidación dependiente del sueño de la memoria declarativa durante las siestas en la primera infancia. Los métodos incluyen la evaluación del comportamiento de la memoria a través de la siesta y las condiciones despiertas, la actigrafía y el informe de los padres para evaluar los ciclos de sueño, y el PSG para evaluar la arquitectura del sueño. Esta combinación única es fundamental para evaluar la memoria, caracterizar los ciclos de sueño y examinar los meca…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Los autores quieren agradecer al Laboratorio de Desarrollo Neurocognitivo de la Universidad de Maryland, College Park y el Laboratorio Somneuro de la Universidad de Massachusetts, Amherst, por su ayuda con este proyecto. La financiación fue proporcionada por NIH (HD094758) y NSF (BCS 1749280) a TR y RS. Los resultados representativos fueron financiados por NIH HL111695.
Materials
| Actiwatch Spectrum Plus Starter Kit | Philips Respironics | 1109516 | Includes: Actiwatch Spectrum Plus Device, Actiware Software License, and manual |
| Actiware software | Philips Respironics | 1114828 | Alternatives may be available. |
| Brain Analyzer | Brain Products | BV-BP-170-1000 | Alternatives may be available. |
| Dell Latitude 5580 Laptop | Dell | X5580T [210-AKJR] | Laptop for running MatLab, Actiware, and RemLogic as well as storing/uploading data |
| EC2 cream | Grass | 12643 | Possible alternatives include Ten20 paste and Lic2 electride cream |
| Embla REMLogic software | Natus Medical Inc. | 21475 | Alternatives may be available. |
| Embletta MPR PG Sys – XR – US | Natus Medical Inc. | 12077 | Embletta system for PSG recordings |
| Embletta MPR ST + Proxy Kit | Natus Medical Inc. | 12696 | Attachment to Embletta to record PSG sensors |
| Nuprep cleaning solution | Natus Medical Inc. | 12643 | Possible alternatives may be available. |
| Sleep Supplies Starter Kit for Embletta MPR ST/ST + Proxy | Natus Medical Inc. | 12643 | Started kit for sleeping including guaze, EC2 cream, NuPrep cleaning solution, cotton swabs and more. |
References
- Sadeh, A., Acebo, C., Seifer, R., Aytur, S., Carskadon, M. A. Activity-based assessment of sleep-wake patterns during the 1st year of life. Infant Behavioral Development. 18 (3), 329-337 (1998).
- Sadeh, A., Urbach, D., Lavie, P. Actigraphically-based automatic bedtime sleep-wake scoring: Validity and clinical applications. Journal Ambulatory Monitoring. 2 (3), 209-216 (1989).
- Rasch, B., Born, J. About sleep’s role in memory. Physiological Reviews. 93, 681-766 (2013).
- Werchan, D. M., Gómez, R. L. Wakefulness (not sleep) promotes generalization of word learning in 2.5-year-old children. Child Development. 85 (2), 429-436 (2014).
- Wang, J. Y., Weber, F. D., Zinke, K., Inostroza, M., Born, J. More effective consolidation of episodic long-term memory in children than adults-unrelated to sleep. Child Development. 89 (5), 1720-1734 (2018).
- Sonni, A., Spencer, R. M. C. Sleep protects memories from interference in older adults. Neurobiology of Aging. 36 (7), 2272-2281 (2015).
- Marshall, L., Helgadóttir, H., Mölle, M., Born, J. Boosting slow oscillations during sleep potentiates memory. Nature. 444 (7119), 610-613 (2006).
- Baran, B., Wilson, J., Spencer, R. M. C. REM-dependent repair of competitive memory suppression. Experimental Brain Research. 203 (2), 471-477 (2010).
- Diekelmann, S., Born, J. The memory function of sleep. Nature Reviews Neuroscience. 11 (2), 114-126 (2010).
- Stickgold, R. Sleep dependent memory consolidation. Nature. 437 (27), 1272-1278 (2005).
- Dudai, Y., Karni, A., Born, J. The consolidation and transformation of memory. Neuron. 88 (1), 20-32 (2010).
- Feld, G. B., Born, J. Sculpting memory during sleep: concurrent consolidation and forgetting. Current Opinion in Neurobiology. 44, 20-27 (2017).
- Staresina, B. P., et al. Hierarchical nesting of slow oscillations, spindles and ripples in the human hippocampus during sleep. Nature Neuroscience. 18 (11), 1679-1686 (2015).
- Ellenbogen, J. M., Payne, J. D., Stickgold, R. The role of sleep in declarative memory consolidation: passive, permissive, active or none?. Current Opinion Neurobiology. 16 (6), 716-722 (2006).
- Oudiette, D., Paller, K. A. Upgrading the sleeping brain with targeted memory reactivation. Trends in Cognitive Sciences. 17 (3), 142-149 (2013).
- Yonelinas, A. P., Ranganath, C., Ekstrom, A. D., Wiltgen, B. J. A contextual binding theory of episodic memory: systems consolidation reconsidered. Nature Reviews Neuroscience. 20, 364-375 (2019).
- Antony, J. W., Schapiro, A. C. Active and effective replay: systems consolidation reconsidered again. Nature Reviews Neuroscience. , (2019).
- Lam, J., Mahone, E. M., Mason, T., Scharf, S. M. The effects of napping on cognitive function in preschoolers. Journal of Developmental & Behavioral Pediatrics. 32 (2), 90-97 (2011).
- Kurth, S., Ringli, M., Geiger, A., Lebourgeois, M., Jenni, O. G., Huber, R. High-density sleep electroencephalogram study. Journal of Neuroscience. 30 (40), 13211-13219 (2010).
- Backhaus, J., Hoeckesfeld, R., Born, J., Hohagen, F., Junghanns, K. Immediate as well as delayed post learning sleep but not wakefulness enhances declarative memory consolidation in children. Neurobiology of Learning and Memory. 89 (1), 76-80 (2008).
- Wilhelm, I., Diekelmann, S., Born, J. Sleep in children improves memory performance on declarative but not procedural tasks TT – Bei Kindern verbessert Schlaf die Gedächtnisleistung für deklarative aber nicht für prozedurale Aufgaben. Learning and Memory. 15 (5), 373-377 (2008).
- Seehagen, S., Konrad, C., Herbert, J. S., Schneider, S. Timely sleep facilitates declarative memory consolidation in infants. Proceedings of the National Academy of Sciences. 112 (5), 1625-1629 (2015).
- Kurdziel, L., Duclos, K., Spencer, R. M. C. Sleep spindles in midday naps enhance learning in preschool children. Proceedings of the National Academy of the Sciences of the United States of America. 110 (43), 17267-17272 (2013).
- Kurdziel, L. B. F., Kent, J., Spencer, R. M. C. Sleep-dependent enhancement of emotional memory in early childhood. Scientific Reports. 8 (12609), 1-10 (2018).
- Desrochers, P. C., Kurdziel, L. B. F., Spencer, R. M. C. Delayed benefit of naps on motor learning in preschool children. Experimental Brain Research. 234 (3), 763-772 (2016).
- Maldonado, C. C., Bentley, A. J., Mitchell, D. A pictorial sleepiness scale based on cartoon faces. Sleep. 27 (3), 541-548 (2004).
- Stern, R. A., Arruda, J. E., Hooper, C. R., Wolfner, G. D., Morey, C. E. Visual analogue mood scales to measure internal mood state in neurologically impaired patients: Description and initial validity evidence. Aphasiology. 11 (1), 59-71 (1997).
- Plihal, W., Born, J. Effects of early and late nocturnal sleep on indicators of procedural and declarative memory. Journal of Cognitive Neuroscience. 9 (4), 534-547 (1997).
- Donohue, K. C., Spencer, R. M. C. Continuous re-exposure to environmental sound cues during sleep does not improve memory for semantically unrelated word pairs. Journal of Cognitive Education and Psychology. 10 (2), 167-177 (2015).
- Wilson, J. K., Baran, B., Pace-Schott, E. F., Ivry, R. B., Spencer, R. M. C. Sleep modulates word-pair learning but not motor sequence learning in healthy older adults. Neurobiology of Aging. 33 (5), 991-1000 (2012).
- Wamsley, E. J., et al. Reduced sleep spindles and spindle coherence in schizophrenia: Mechanisms of impaired memory consolidation?. Biological Psychiatry. 71 (2), 154-161 (2012).
- Mölle, M., Bergmann, T. O., Marshall, L., Born, J. Fast and slow spindles during the sleep slow oscillation: Disparate coalescence and engagement in memory processing. Sleep. 34 (10), 1411-1421 (2011).
- Acebo, C., et al. Sleep/wake patterns derived from activity monitoring and maternal report for healthy 1- to 5-year-old children. Sleep. 28 (12), 1568-1577 (2005).
- Acebo, C., et al. Estimating sleep patterns with activity monitoring in children and adolescents: How many nights are necessary for reliable measures?. Sleep. 22 (1), 95-103 (1999).
- Geiger, A., et al. The sleep EEG as a marker of intellectual ability in school age children. Sleep. 34 (2), 181-189 (2011).
- Wagner, U., Gais, S., Born, J. Emotional memory formation is enhanced across sleep intervals with high amounts of rapid eye movement sleep. Learning and Memory. 8, 112-119 (2001).
- Gómez, R. L., Bootzin, R. R., Nadel, L. Naps promote abstraction in language-learning infants. Psychological Science. 17 (8), 670-674 (2006).
- Konrad, C., Herbert, J. S., Schneider, S., Seehagen, S. Gist extraction and sleep in 12-month-old infants. Neurobiology of Learning and Memory. 134, 216-220 (2016).

