إنشاء مفصل الركبة على رقاقة لنمذجة أمراض المفاصل واختبار الأدوية
Summary
نحن نقدم طرقا مفصلة لتوليد أربعة أنواع من الأنسجة من الخلايا الجذعية الوسيطة البشرية ، والتي تستخدم لتلخيص الغضروف والعظام ووسادة الدهون والغشاء الزليلي في مفصل الركبة البشري. يتم دمج هذه الأنسجة الأربعة في مفاعل حيوي مخصص وتوصيلها من خلال الموائع الدقيقة ، وبالتالي توليد مفصل الركبة على رقاقة.
Abstract
يشكل ارتفاع معدل انتشار أمراض المفاصل المنهكة مثل هشاشة العظام (OA) عبئا اجتماعيا واقتصاديا كبيرا. حاليا ، الأدوية المتاحة التي تستهدف اضطرابات المفاصل هي في الغالب ملطفة. إن الحاجة غير الملباة إلى أدوية OA الفعالة المعدلة للمرض (DMOADs) ناتجة في المقام الأول عن عدم وجود نماذج مناسبة لدراسة آليات المرض واختبار DMOADs المحتملة. هنا ، نصف إنشاء نظام فسيولوجي دقيق يحاكي المفصل الزليلي المصغر (miniJoint) يتألف من مكونات الأنسجة الدهنية والليفية والعظمية الغضروفية المشتقة من الخلايا الجذعية الوسيطة البشرية (MSCs). للحصول على الأنسجة الدقيقة ثلاثية الأبعاد (3D) ، تم تغليف MSCs في الجيلاتين الميثكريليت القابل للربط الضوئي قبل أو بعد التمايز. ثم تم دمج تركيبات الأنسجة المحملة بالخلايا في مفاعل حيوي مطبوع 3D ، لتشكيل miniJoint. تم إدخال تدفقات منفصلة من الوسائط العظمية والليفية المنشأ والشحمية للحفاظ على الأنماط الظاهرية للأنسجة المعنية. تم اختراق تيار مشترك بشكل شائع من خلال الغضروف والأنسجة الزليلية والدهنية لتمكين تداخل الأنسجة. يسمح نمط التدفق هذا بتحريض الاضطرابات في واحد أو أكثر من مكونات الأنسجة للدراسات الآلية. علاوة على ذلك ، يمكن اختبار DMOADs المحتملة إما عن طريق “الإدارة الجهازية” من خلال جميع التيارات المتوسطة أو “الإدارة داخل المفصل” عن طريق إضافة الأدوية إلى تدفق محاكاة “السائل الزليلي” المشترك فقط. وبالتالي ، يمكن أن يكون miniJoint بمثابة منصة متعددة الاستخدامات في المختبر لدراسة آليات المرض بكفاءة واختبار الأدوية في الطب الشخصي.
Introduction
أمراض المفاصل مثل هشاشة العظام (OA) منتشرة للغاية وموهنة وتمثل سببا رئيسيا للإعاقة في جميع أنحاء العالم1. تشير التقديرات إلى أنه في الولايات المتحدة وحدها ، يؤثر OA على 27 مليون مريض ويحدث في 12.1٪ من البالغين الذين تتراوح أعمارهم بين 60 وما فوق2. لسوء الحظ ، فإن معظم الأدوية المستخدمة حاليا لإدارة أمراض المفاصل ملطفة ، ولا تتوفر أدوية OA فعالة لتعديل المرض (DMOADs)3. تنبع هذه الحاجة الطبية غير الملباة في المقام الأول من عدم وجود نموذج فعال لدراسة آليات المرض وتطوير DMOADs المحتملة. لا تعكس زراعة الخلايا التقليدية ثنائية الأبعاد (2D) الطبيعة ثلاثية الأبعاد لأنسجة المفاصل ، وغالبا ما يتم إعاقة زراعة الأنسجة من خلال موت الخلايا الكبير وعادة ما تفشل في تكرار الترابط الديناميكي للأنسجة4. بالإضافة إلى ذلك ، تقلل الاختلافات الجينية والتشريحية بشكل كبير من الأهمية الفسيولوجية للنماذج الحيوانية4.
تعد الأجهزة على الرقائق (OoCs) ، أو الأنظمة الفيزيولوجية الدقيقة ، مجالا بحثيا واعدا في واجهة الهندسة والبيولوجيا والطب. هذه المنصات في المختبر هي الحد الأدنى من الوحدات الوظيفية التي تكرر السمات الصحية أو المرضية المحددة لنظيراتها في الجسم الحي 5. علاوة على ذلك ، يمكن لهذه الأنظمة المصغرة استضافة خلايا ومصفوفات متنوعة ومحاكاة التفاعلات الفيزيائية الحيوية والكيميائية الحيوية بين الأنسجة المختلفة. لذلك ، فإن النظام الفسيولوجي الدقيق الذي يمكنه تلخيص المفصل الزليلي الأصلي بأمانة يعد بتقديم منصة فعالة لنمذجة أمراض المفاصل وتطوير DMOADs المحتملة.
يمكن عزل الخلايا الجذعية الوسيطة البشرية (MSCs) من العديد من الأنسجة في جميع أنحاء الجسم وتمييزها إلى سلالات عظمية المنشأ ، غضروفية ، وأديبوجينية6. تم استخدام MSCs بنجاح لهندسة الأنسجة المختلفة ، بما في ذلك العظام والغضاريف والأنسجة الدهنية6 ، مما يعني أنها تمثل مصدرا واعدا للخلايا لهندسة مكونات الأنسجة في مفصل الركبة. لقد طورنا مؤخرا نظاما مصغرا يحاكي المفاصل ، يسمى miniJoint ، والذي يشتمل على أنسجة العظام والغضاريف والأنسجة الليفية والدهنية المشتقة من MSC7. على وجه الخصوص ، يتيح التصميم الجديد الحديث المتبادل للأنسجة عن طريق تدفق الموائع الدقيقة أو التغلغل (الشكل 1). هنا ، نقدم بروتوكولات تصنيع مكونات الرقاقة ، وهندسة مكونات الأنسجة ، وزراعة الأنسجة المهندسة في الرقاقة ، وجمع الأنسجة للتحليلات النهائية.
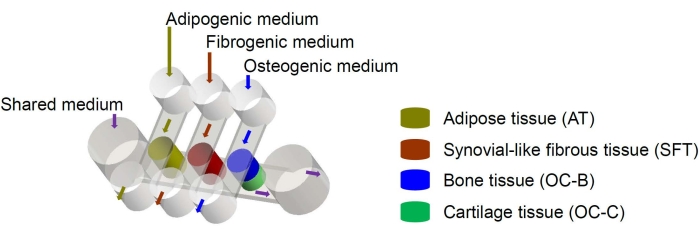
الشكل 1: رسم تخطيطي لشريحة miniJoint يوضح ترتيب مكونات الأنسجة المختلفة والتدفقات المتوسطة. OC = الأنسجة العظمية الغضروفية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
في هذه المقالة ، نقدم بروتوكولا لإنشاء نظام مفصل الركبة على رقاقة ، حيث يتم تشكيل العظام والغضاريف والأنسجة الدهنية والأنسجة الشبيهة بالغشاء الزليلي من MSCs ويتم استزراعها بشكل مشترك داخل مفاعل حيوي مخصص. يمثل هذا النظام متعدد المكونات المشتق من الخلايا البشرية مع ميزات التوصيل والتشغيل أ…
Divulgations
The authors have nothing to disclose.
Acknowledgements
تم دعم هذا البحث في المقام الأول بتمويل من المعاهد الوطنية للصحة (UG3 / UH3TR002136 ، UG3 / UH3TR003090). بالإضافة إلى ذلك ، نشكر الدكتور بول مانر (جامعة واشنطن) على توفير عينات الأنسجة البشرية والدكتور جيان تان لمساعدتهم في عزل MSCs وإنشاء تجمع الخلايا.
Materials
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
References
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biologie. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).

