Eklem hastalıklarını modellemek ve ilaçları test etmek için çip üzerinde diz eklemi oluşturulması
Summary
İnsan diz eklemindeki kıkırdak, kemik, yağ yastığı ve sinovyumu özetlemek için kullanılan insan mezenkimal kök hücrelerinden dört tip doku üretmek için ayrıntılı yöntemler sunuyoruz. Bu dört doku özelleştirilmiş bir biyoreaktöre entegre edilir ve mikroakışkanlar yoluyla bağlanır, böylece çip üzerinde bir diz eklemi oluşturur.
Abstract
Osteoartrit (OA) gibi zayıflatıcı eklem hastalıklarının yüksek prevalansı yüksek sosyoekonomik yük oluşturmaktadır. Günümüzde eklem bozukluklarını hedef alan mevcut ilaçlar çoğunlukla palyatiftir. Etkili hastalık modifiye edici OA ilaçlarına (DMOAD’ler) yönelik karşılanmamış ihtiyaç, öncelikle hastalık mekanizmalarını incelemek ve potansiyel DMOAD’leri test etmek için uygun modellerin bulunmamasından kaynaklanmaktadır. Burada, insan mezenkimal kök hücrelerinden (MSC’ler) türetilen adipoz, fibröz ve osteokondral doku bileşenlerinden oluşan minyatür bir sinovyal eklem taklit eden mikrofizyolojik sistemin (miniJoint) kurulmasını tarif ediyoruz. Üç boyutlu (3D) mikrodokuları elde etmek için, MSC’ler farklılaşmadan önce veya sonra fotoçapraz bağlanabilir metakrillenmiş jelatin içinde kapsüllendi. Hücre yüklü doku yapıları daha sonra miniJoint’i oluşturan 3D baskılı bir biyoreaktöre entegre edildi. İlgili doku fenotiplerini korumak için ayrı osteojenik, fibrojenik ve adipojenik ortam akışları tanıtıldı. Yaygın olarak paylaşılan bir akış, doku çapraz karışmasını sağlamak için kıkırdak, sinovyal ve yağ dokuları boyunca perfüze edildi. Bu akış paterni, mekanik çalışmalar için bir veya daha fazla doku bileşeninde pertürbasyonların indüksiyonuna izin verir. Ayrıca, potansiyel DMOAD’ler, tüm ortam akışları boyunca “sistemik uygulama” veya ilaçları yalnızca paylaşılan “sinovyal sıvı” simüle eden akışa ekleyerek “eklem içi uygulama” yoluyla test edilebilir. Böylece, miniJoint, hastalık mekanizmalarını verimli bir şekilde incelemek ve kişiselleştirilmiş tıpta ilaçları test etmek için çok yönlü bir in vitro platform olarak hizmet edebilir.
Introduction
Osteoartrit (OA) gibi eklem hastalıkları oldukça yaygın ve zayıflatıcıdır ve dünya çapında önde gelen bir sakatlık nedenini temsil etmektedir1. Sadece ABD’de OA’nın 27 milyon hastayı etkilediği ve 60 yaş ve üstü yetişkinlerin% 12.1’inde ortaya çıktığıtahmin edilmektedir. Ne yazık ki, şu anda eklem hastalıklarını yönetmek için kullanılan ilaçların çoğu palyatiftir ve etkili bir hastalık modifiye edici OA ilacı (DMOAD) mevcut değildir3. Bu karşılanmamış tıbbi ihtiyaç, öncelikle hastalık mekanizmalarını incelemek ve potansiyel DMOAD’leri geliştirmek için etkili bir modelin bulunmamasından kaynaklanmaktadır. Geleneksel iki boyutlu (2B) hücre kültürü, eklem dokularının 3B doğasını yansıtmaz ve doku eksplantlarının kültürü genellikle önemli hücre ölümü tarafından engellenir ve genellikle dinamik doku ara bağlantılarını çoğaltmada başarısız olur4. Ek olarak, genetik ve anatomik farklılıklar hayvan modellerinin fizyolojik alaka düzeyini önemli ölçüde azaltır4.
Çip üzerindeki organlar (OoC’ler) veya mikrofizyolojik sistemler, mühendislik, biyoloji ve tıp arayüzünde umut verici bir araştırma alanıdır. Bu in vitro platformlar, in vivo muadillerinin tanımlanmış sağlıklı veya patolojik özelliklerini kopyalayan minimal fonksiyonel birimlerdir5. Ayrıca, bu minyatür sistemler çeşitli hücrelere ve matrislere ev sahipliği yapabilir ve farklı dokular arasındaki biyofiziksel ve biyokimyasal etkileşimleri simüle edebilir. Bu nedenle, doğal sinovyal eklemi sadık bir şekilde özetleyebilen mikrofizyolojik bir sistem, eklem hastalıklarını modellemek ve potansiyel DMOAD’leri geliştirmek için etkili bir platform sunmayı vaat ediyor.
İnsan mezenkimal kök hücreleri (MSC’ler) vücuttaki birçok dokudan izole edilebilir ve osteojenik, kondrojenik ve adipojenik soylara ayrılabilir6. MSC’ler kemik, kıkırdak ve yağ dokusu6 dahil olmak üzere çeşitli dokuların mühendisliğini yapmak için başarıyla kullanılmıştır, bu nedenle diz ekleminin doku bileşenlerinin mühendisliği için umut verici bir hücre kaynağını temsil ettikleri anlamına gelir. Yakın zamanda, MSC kaynaklı kemik, kıkırdak, fibröz ve yağ dokularından oluşan miniJoint adlı minyatür eklem taklit eden mikrofizyolojik bir sistem geliştirdik7. Özellikle, yeni tasarım, mikroakışkan akış veya geçirgenlik yoluyla doku çapraz karışmasını sağlar (Şekil 1). Burada, çip bileşenlerinin imalatı, doku bileşenlerinin mühendisliği, çipteki mühendislik dokularının kültürü ve aşağı akış analizleri için dokuların toplanması için protokolleri sunuyoruz.
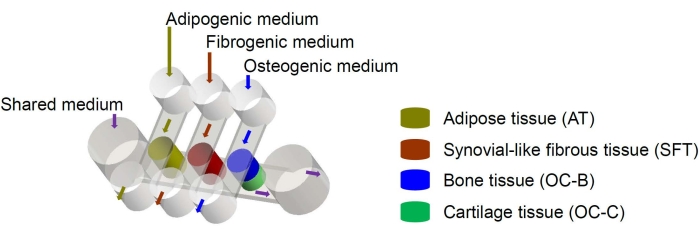
Şekil 1: Farklı doku bileşenlerinin ve ortam akışlarının düzenini gösteren miniJoint çipinin şeması. OC = osteokondral doku. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Bu makalede, kemik, kıkırdak, yağ dokusu ve sinovyum benzeri dokuların MSC’lerden oluşturulduğu ve özelleştirilmiş bir biyoreaktör içinde birlikte kültürlendiği bir çip üzerinde diz eklemi sistemi oluşturmak için bir protokol sunuyoruz. Tak ve çalıştır özelliklerine sahip bu çok bileşenli, insan hücresinden türetilmiş sistem, eklem hastalıklarının patogenezini incelemek ve ilaç geliştirmek için yeni bir aracı temsil etmektedir.
Farklı dokuların belirli kü…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Bu araştırma öncelikle Ulusal Sağlık Enstitüleri (UG3 / UH3TR002136, UG3 / UH3TR003090) tarafından finanse edilmiştir. Buna ek olarak, insan dokusu örneklerini sağladığı için Dr. Paul Manner’a (Washington Üniversitesi) ve MSC’leri izole etme ve hücre havuzu oluşturma konusundaki yardımları için Dr. Jian Tan’a teşekkür ederiz.
Materials
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
References
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biologie. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).

