Erstellung eines Kniegelenk-on-a-Chips zur Modellierung von Gelenkerkrankungen und zur Erprobung von Medikamenten
Summary
Wir stellen detaillierte Methoden zur Generierung von vier Gewebetypen aus humanen mesenchymalen Stammzellen vor, die zur Rekapitulation von Knorpel, Knochen, Fettpolster und Synovia im menschlichen Kniegelenk verwendet werden. Diese vier Gewebe werden in einen maßgeschneiderten Bioreaktor integriert und durch Mikrofluidik miteinander verbunden, so dass ein Kniegelenk-on-a-Chip entsteht.
Abstract
Die hohe Prävalenz von schwächenden Gelenkerkrankungen wie Arthrose (OA) stellt eine hohe sozioökonomische Belastung dar. Derzeit sind die verfügbaren Medikamente, die auf Gelenkerkrankungen abzielen, meist palliativ. Der ungedeckte Bedarf an wirksamen krankheitsmodifizierenden OA-Medikamenten (DMOADs) wurde in erster Linie durch das Fehlen geeigneter Modelle zur Untersuchung der Krankheitsmechanismen und zur Erprobung potenzieller DMOADs verursacht. In dieser Arbeit beschreiben wir die Etablierung eines mikrophysiologischen Miniatursystems (miniJoint), das aus fettigen, fibrösen und osteochondralen Gewebekomponenten besteht, die von humanen mesenchymalen Stammzellen (MSCs) abgeleitet sind. Um die dreidimensionalen (3D) Mikrogewebe zu erhalten, wurden MSCs vor oder nach der Differenzierung in photovernetzbare methacrylierte Gelatine eingekapselt. Die zellbeladenen Gewebekonstrukte wurden dann in einen 3D-gedruckten Bioreaktor integriert, wodurch das miniJoint entstand. Getrennte Ströme von osteogenen, fibrogenen und adipogenen Medien wurden eingeführt, um die jeweiligen Gewebephänotypen zu erhalten. Ein gemeinsam genutzter Strom wurde durch das Knorpel-, Synovial- und Fettgewebe perfundiert, um eine Gewebeübersprechung zu ermöglichen. Dieses Strömungsmuster ermöglicht die Induktion von Störungen in einer oder mehreren Gewebekomponenten für mechanistische Untersuchungen. Darüber hinaus können potenzielle DMOADs entweder durch “systemische Verabreichung” über alle Medienströme oder durch “intraartikuläre Verabreichung” getestet werden, indem die Medikamente nur dem gemeinsamen “Synovialflüssigkeit”-simulierenden Fluss zugesetzt werden. Damit kann das miniJoint als vielseitige In-vitro-Plattform dienen, um Krankheitsmechanismen effizient zu untersuchen und Medikamente in der personalisierten Medizin zu testen.
Introduction
Gelenkerkrankungen wie Arthrose (OA) sind weit verbreitet und schwächend und stellen weltweit eine der Hauptursachen für Behinderungendar 1. Es wird geschätzt, dass allein in den USA 27 Millionen Patienten von Arthrose betroffen sind und 12,1 % der Erwachsenen ab 60 Jahren auftreten2. Leider sind die meisten Medikamente, die derzeit zur Behandlung von Gelenkerkrankungen eingesetzt werden, palliativ, und es gibt keine wirksamen krankheitsmodifizierenden OA-Medikamente (DMOADs)3. Dieser ungedeckte medizinische Bedarf ergibt sich in erster Linie aus dem Fehlen eines wirksamen Modells zur Untersuchung der Krankheitsmechanismen und zur Entwicklung potenzieller DMOADs. Die konventionelle zweidimensionale (2D) Zellkultur spiegelt nicht die 3D-Natur von Gelenkgewebe wider, und die Kultur von Gewebeexplantaten wird oft durch einen signifikanten Zelltod behindert und repliziert in der Regel nicht die dynamischen Gewebeverbindungen4. Darüber hinaus verringern genetische und anatomische Unterschiede die physiologische Relevanz von Tiermodellenerheblich 4.
Organs-on-Chips (OoCs), also mikrophysiologische Systeme, sind ein vielversprechendes Forschungsfeld an der Schnittstelle von Ingenieurwissenschaften, Biologie und Medizin. Bei diesen In-vitro-Plattformen handelt es sich um minimalfunktionelle Einheiten, die definierte gesunde oder pathologische Merkmale ihrer In-vivo-Gegenstücke replizieren5. Darüber hinaus können diese miniaturisierten Systeme verschiedene Zellen und Matrizen beherbergen und die biophysikalischen und biochemischen Wechselwirkungen zwischen verschiedenen Geweben simulieren. Ein mikrophysiologisches System, das das native Synovialgelenk originalgetreu rekapitulieren kann, verspricht daher, eine effektive Plattform für die Modellierung von Gelenkerkrankungen und die Entwicklung potenzieller DMOADs zu bieten.
Humane mesenchymale Stammzellen (MSCs) können aus vielen Geweben im ganzen Körper isoliert und in osteogene, chondrogene und adipogene Linien differenziert werden6. MSCs wurden erfolgreich eingesetzt, um verschiedene Gewebe zu züchten, darunter Knochen, Knorpel und Fettgewebe6, was bedeutet, dass sie eine vielversprechende Zellquelle für die Entwicklung der Gewebekomponenten des Kniegelenks darstellen. Wir haben kürzlich ein mikrophysiologisches Miniatur-Gelenksystem namens miniJoint entwickelt, das aus MSC gewonnenes Knochen-, Knorpel-, Faser- und Fettgewebe umfasst7. Insbesondere ermöglicht das neuartige Design das Übersprechen von Gewebe durch mikrofluidische Strömung oder Permeation (Abbildung 1). Im Folgenden stellen wir die Protokolle für die Herstellung der Chipkomponenten, das Engineering der Gewebekomponenten, die Kultur der künstlich hergestellten Gewebe im Chip und die Entnahme von Geweben für nachgelagerte Analysen vor.
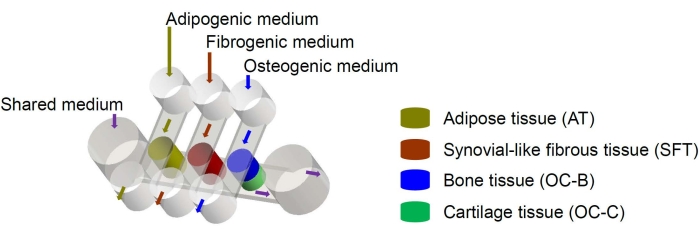
Abbildung 1: Schematische Darstellung des miniJoint-Chips, die die Anordnung der verschiedenen Gewebekomponenten und Mediumflüsse zeigt. OC = osteochondrales Gewebe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
In diesem Artikel stellen wir ein Protokoll zur Herstellung eines Kniegelenk-on-a-Chip-Systems vor, bei dem Knochen, Knorpel, Fettgewebe und synoviumähnliches Gewebe aus MSCs gebildet und in einem maßgeschneiderten Bioreaktor kokultiviert werden. Dieses aus menschlichen Zellen bestehende Mehrkomponentensystem mit Plug-and-Play-Funktionen stellt ein neues Werkzeug für die Untersuchung der Pathogenese von Gelenkerkrankungen und die Entwicklung von Medikamenten dar.
Da unterschiedliche Gewebe…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Diese Forschung wurde in erster Linie durch Mittel der National Institutes of Health (UG3/UH3TR002136, UG3/UH3TR003090) unterstützt. Darüber hinaus danken wir Dr. Paul Manner (University of Washington) für die Bereitstellung der menschlichen Gewebeproben und Dr. Jian Tan für ihre Hilfe bei der Isolierung der MSCs und der Erstellung des Zellpools.
Materials
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
References
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biologie. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).

