Creatie van een kniegewricht-op-een-chip voor het modelleren van gewrichtsaandoeningen en het testen van medicijnen
Summary
We bieden gedetailleerde methoden voor het genereren van vier soorten weefsels uit menselijke mesenchymale stamcellen, die worden gebruikt om het kraakbeen, bot, vetkussen en synovium in het menselijke kniegewricht samen te vatten. Deze vier weefsels zijn geïntegreerd in een aangepaste bioreactor en verbonden via microfluïdica, waardoor een kniegewricht-op-een-chip wordt gegenereerd.
Abstract
De hoge prevalentie van slopende gewrichtsaandoeningen zoals artrose (OA) vormt een hoge sociaaleconomische last. Momenteel zijn de beschikbare medicijnen die zich richten op gewrichtsaandoeningen meestal palliatief. De onvervulde behoefte aan effectieve disease-modifying OA drugs (DMOADs) is voornamelijk veroorzaakt door het ontbreken van geschikte modellen voor het bestuderen van de ziektemechanismen en het testen van potentiële DMOADs. Hierin beschrijven we de oprichting van een miniatuur synoviaal gewricht-nabootsend microfysiologisch systeem (miniJoint) bestaande uit vet-, vezel- en osteochondrale weefselcomponenten afgeleid van menselijke mesenchymale stamcellen (MSC’s). Om de driedimensionale (3D) microweefsels te verkrijgen, werden MSC’s ingekapseld in fotocrosslinkable methacrylated gelatine voor of na differentiatie. De met cellen beladen weefselconstructies werden vervolgens geïntegreerd in een 3D-geprinte bioreactor, waardoor de miniJoint werd gevormd. Afzonderlijke stromen van osteogene, fibrogene en adipogene media werden geïntroduceerd om de respectieve weefselfenotypen te behouden. Een algemeen gedeelde stroom werd doordrenkt door het kraakbeen, synoviale en vetweefsels om weefseloverspraak mogelijk te maken. Dit stromingspatroon maakt de inductie van verstoringen in een of meer van de weefselcomponenten voor mechanistische studies mogelijk. Bovendien kunnen potentiële DMOADs worden getest via “systemische toediening” via alle mediumstromen of “intra-articulaire toediening” door de geneesmiddelen toe te voegen aan alleen de gedeelde “synoviale vloeistof” -simulerende stroom. Zo kan de miniJoint dienen als een veelzijdig in vitro platform voor het efficiënt bestuderen van ziektemechanismen en het testen van geneesmiddelen in gepersonaliseerde geneeskunde.
Introduction
Gewrichtsziekten zoals artrose (OA) komen veel voor en zijn slopend en vormen wereldwijd een belangrijke oorzaak van invaliditeit1. Geschat wordt dat artrose alleen al in de VS 27 miljoen patiënten treft en voorkomt bij 12,1% van de volwassenen van 60 jaar en ouderdan 2 jaar. Helaas zijn de meeste geneesmiddelen die momenteel worden gebruikt om gewrichtsaandoeningen te beheersen palliatief en zijn er geen effectieve ziektemodificerende OA-geneesmiddelen (DMOADs) beschikbaar3. Deze onvervulde medische behoefte komt voornamelijk voort uit het ontbreken van een effectief model voor het bestuderen van de ziektemechanismen en het ontwikkelen van potentiële DMOADs. De conventionele tweedimensionale (2D) celcultuur weerspiegelt niet de 3D-aard van gewrichtsweefsels en de kweek van weefselexplantaten wordt vaak belemmerd door aanzienlijke celdood en slaagt er meestal niet in om de dynamische weefselverbindingen te repliceren4. Bovendien verminderen genetische en anatomische verschillen de fysiologische relevantie van diermodellen aanzienlijk4.
Organs-on-chips (OoC’s), of microfysiologische systemen, zijn een veelbelovend onderzoeksveld op het snijvlak van engineering, biologie en geneeskunde. Deze in vitro platforms zijn minimale functionele eenheden die gedefinieerde gezonde of pathologische kenmerken van hun in vivo tegenhangers repliceren5. Bovendien kunnen deze geminiaturiseerde systemen verschillende cellen en matrices hosten en de biofysische en biochemische interacties tussen verschillende weefsels simuleren. Daarom belooft een microfysiologisch systeem dat het inheemse synoviale gewricht getrouw kan samenvatten een effectief platform te bieden voor het modelleren van gewrichtsaandoeningen en het ontwikkelen van potentiële DMOADs.
Menselijke mesenchymale stamcellen (MSC’s) kunnen worden geïsoleerd uit vele weefsels in het lichaam en worden gedifferentieerd in osteogene, chongene en adipogene afstammingslijnen6. MSC’s zijn met succes gebruikt om verschillende weefsels te engineeren, waaronder bot, kraakbeen en vetweefsel6, wat betekent dat ze een veelbelovende celbron vormen voor het engineeren van de weefselcomponenten van het kniegewricht. We hebben onlangs een miniatuur gewricht-nabootsend microfysiologisch systeem ontwikkeld, genaamd miniJoint, dat bestaat uit MSC-afgeleide bot-, kraakbeen-, vezel- en vetweefsels7. In het bijzonder maakt het nieuwe ontwerp weefseloverspraak mogelijk door microfluïdische stroming of permeatie (figuur 1). Hierin presenteren we de protocollen voor de fabricage van de chipcomponenten, de engineering van de weefselcomponenten, de cultuur van de gemanipuleerde weefsels in de chip en de verzameling van weefsels voor downstream-analyses.
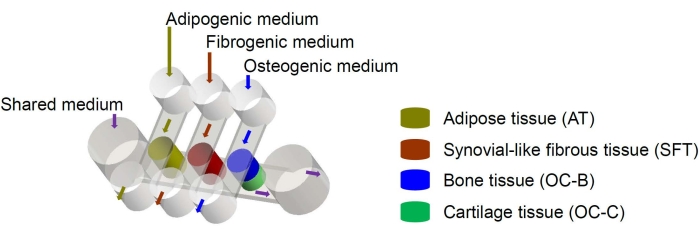
Figuur 1: Schema van de miniJoint chip met de rangschikking van de verschillende weefselcomponenten en medium flows. OC = osteochondraal weefsel. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
In dit artikel presenteren we een protocol voor het maken van een kniegewricht-op-een-chip-systeem, waarin bot, kraakbeen, vetweefsel en synoviumachtige weefsels worden gevormd uit MSC’s en co-gekweekt in een aangepaste bioreactor. Dit multi-component, van menselijke cellen afgeleide systeem met plug-and-play-functies vertegenwoordigt een nieuw hulpmiddel voor het bestuderen van de pathogenese van gewrichtsziekten en het ontwikkelen van medicijnen.
Aangezien verschillende weefsels de voorkeur…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Dit onderzoek werd voornamelijk ondersteund door financiering van de National Institutes of Health (UG3/UH3TR002136, UG3/UH3TR003090). Daarnaast bedanken we Dr. Paul Manner (University of Washington) voor het verstrekken van de menselijke weefselmonsters en Dr. Jian Tan voor hun hulp bij het isoleren van de MSC’s en het creëren van de celpool.
Materials
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
References
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biologie. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).

