Création d’une articulation du genou sur puce pour modéliser les maladies articulaires et tester des médicaments
Summary
Nous fournissons des méthodes détaillées pour générer quatre types de tissus à partir de cellules souches mésenchymateuses humaines, qui sont utilisées pour récapituler le cartilage, l’os, le coussinet adipeux et la synoviale dans l’articulation du genou humain. Ces quatre tissus sont intégrés dans un bioréacteur personnalisé et connectés par microfluidique, générant ainsi une articulation du genou sur puce.
Abstract
La forte prévalence de maladies articulaires débilitantes comme l’arthrose (OA) pose un fardeau socio-économique élevé. Actuellement, les médicaments disponibles qui ciblent les troubles articulaires sont principalement palliatifs. Le besoin non satisfait de médicaments efficaces modificateurs de la maladie pour l’arthrose (DMOAD) a été principalement causé par l’absence de modèles appropriés pour étudier les mécanismes de la maladie et tester les DMOAD potentiels. Ici, nous décrivons l’établissement d’un système microphysiologique miniature imitant l’articulation synoviale (miniJoint) comprenant des composants de tissus adipeux, fibreux et ostéochondrals dérivés de cellules souches mésenchymateuses humaines (CSM). Pour obtenir les microtissus tridimensionnels (3D), les CSM ont été encapsulées dans de la gélatine méthacrylée photoréticulable avant ou après la différenciation. Les constructions tissulaires chargées de cellules ont ensuite été intégrées dans un bioréacteur imprimé en 3D, formant le miniJoint. Des flux séparés de milieux ostéogène, fibrogéniques et adipogènes ont été introduits pour maintenir les phénotypes tissulaires respectifs. Un flux commun a été perfusé à travers les tissus cartilagineux, synovial et adipeux pour permettre la diaphonie tissulaire. Ce schéma d’écoulement permet l’induction de perturbations dans un ou plusieurs composants tissulaires pour les études mécanistiques. En outre, les DMOAD potentiels peuvent être testés soit par « administration systémique » à travers tous les flux intermédiaires, soit par « administration intraarticulaire » en ajoutant les médicaments uniquement au flux de simulation de « liquide synovial » partagé. Ainsi, le miniJoint peut servir de plateforme in vitro polyvalente pour étudier efficacement les mécanismes de la maladie et tester des médicaments en médecine personnalisée.
Introduction
Les maladies articulaires comme l’arthrose (OA) sont très répandues et débilitantes et représentent l’une des principales causes d’invalidité dans le monde1. On estime qu’aux États-Unis seulement, l’arthrose touche 27 millions de patients et survient chez 12,1% des adultes âgés de 60 ans et plus2. Malheureusement, la plupart des médicaments actuellement utilisés pour gérer les maladies articulaires sont palliatifs, et aucun médicament modificateur de la maladie (DMOAD) efficace n’est disponible3. Ce besoin médical non satisfait découle principalement de l’absence d’un modèle efficace pour étudier les mécanismes de la maladie et développer des DMOAD potentiels. La culture cellulaire bidimensionnelle conventionnelle (2D) ne reflète pas la nature 3D des tissus articulaires, et la culture d’explants tissulaires est souvent entravée par une mort cellulaire importante et ne parvient généralement pas à reproduire les interconnexions tissulaires dynamiques4. De plus, les différences génétiques et anatomiques réduisent significativement la pertinence physiologique des modèles animaux4.
Les organes sur puce (OoC), ou systèmes microphysiologiques, sont un domaine de recherche prometteur à l’interface de l’ingénierie, de la biologie et de la médecine. Ces plateformes in vitro sont des unités fonctionnelles minimales qui reproduisent des caractéristiques saines ou pathologiques définies de leurs homologues in vivo 5. De plus, ces systèmes miniaturisés peuvent héberger diverses cellules et matrices et simuler les interactions biophysiques et biochimiques entre différents tissus. Par conséquent, un système microphysiologique capable de récapituler fidèlement l’articulation synoviale native promet d’offrir une plate-forme efficace pour la modélisation des maladies articulaires et le développement de DMOAD potentiels.
Les cellules souches mésenchymateuses humaines (CSM) peuvent être isolées de nombreux tissus dans tout le corps et différenciées en lignées ostéogène, chondrogéniques et adipogènes6. Les CSM ont été utilisées avec succès pour concevoir divers tissus, y compris les os, le cartilage et le tissu adipeux6, ce qui signifie qu’ils représentent une source cellulaire prometteuse pour l’ingénierie des composants tissulaires de l’articulation du genou. Nous avons récemment mis au point un système microphysiologique miniature imitant les articulations, appelé miniJoint, qui comprend des tissus osseux, cartilagineux, fibreux et adipeux dérivésdu MSC 7. En particulier, la nouvelle conception permet la diaphonie tissulaire par écoulement microfluidique ou perméation (Figure 1). Nous présentons ici les protocoles pour la fabrication des composants de la puce, l’ingénierie des composants tissulaires, la culture des tissus modifiés dans la puce et la collecte des tissus pour les analyses en aval.
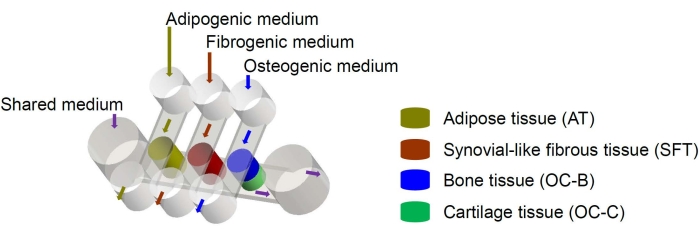
Figure 1 : Schéma de la puce miniJoint montrant la disposition des différents composants tissulaires et des écoulements du milieu. OC = tissu ostéochondral. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Dans cet article, nous présentons un protocole pour créer un système d’articulation du genou sur puce, dans lequel l’os, le cartilage, le tissu adipeux et les tissus de type synoviale sont formés à partir de CSM et co-cultivés dans un bioréacteur personnalisé. Ce système multi-composants, dérivé de cellules humaines avec des fonctionnalités plug-and-play, représente un nouvel outil pour étudier la pathogenèse des maladies articulaires et développer des médicaments.
Étant…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Cette recherche a été principalement financée par les National Institutes of Health (UG3/UH3TR002136, UG3/UH3TR003090). De plus, nous remercions le Dr Paul Manner (Université de Washington) d’avoir fourni les échantillons de tissus humains et le Dr Jian Tan de son aide dans l’isolement des CSM et la création du pool cellulaire.
Materials
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
References
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biologie. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).

