整合酶缺陷慢病毒载体载体的制备及其在细胞 CRISPR/Cas9-mediated 基因敲除中的表达
Summary
我们描述了整合酶缺乏慢病毒载体载体 (IDLVs) 作为向细胞传递 CRISPR/Cas9 的工具的生产策略。由于能够在细胞中调节快速和健壮的基因编辑, IDLVs 为基因的传递提供了一个更安全、同样有效的载体平台, 与整合酶能力的载体相比。
Abstract
慢病毒载体载体是一种理想的选择, 提供基因编辑组件的细胞, 由于其能力稳定传感广泛的细胞和调解高水平的基因表达。然而, 它们融入宿主细胞基因组的能力增强了插入致突变的风险, 从而提高了安全性, 并限制了它们在临床环境中的使用。此外, 这些整合能力的慢病毒载体载体 (ICLVs) 提供的基因编辑组件的持续表达增加了混杂基因靶向的可能性。作为一种替代方法, 开发了新一代整合酶缺陷慢病毒载体矢量 (IDLVs), 解决了其中的许多问题。这里提出了一个新的和改进的 IDLV 平台 CRISPR 介导的基因编辑的生产协议, 并列出了这些载体的纯化和浓度所涉及的步骤, 并利用 HEK-293T 的转导和基因编辑效率细胞被证明。此协议易于伸缩, 可用于生成具有传感单元格体外和体内的高效度 IDLVs。此外, 该协议可以很容易地适应生产 ICLVs。
Introduction
精确的基因编辑是主要的生物医学进步的基石, 涉及发展新的策略来解决遗传疾病。在基因编辑技术的前沿是依靠使用clustered regularlyinterspaced s园艺palindromic repeats (CRISPR)/Cas9 系统的方法, 最初确定作为抗病毒遗传物质入侵的细菌免疫成分 (在引用1,2) 中进行了检查。CRISPR/Cas9 系统对其他基因编辑工具的主要优势, 如锌指核酸 (ZFNs) 和转录激活因子核酸 (TALENs) (参照3), 是质粒设计的相对简单性和CRISPR 组件的构建–这一功能推动了将基因编辑从少数专业实验室扩展到更广泛的研究社区。此外, CRISPR/Cas9 编程的简单性和其多路目标识别的能力进一步推动了它作为一种成本效益和易于使用的技术的普及。在研究人员向细胞提供这种基因编辑组件的各种方法中, 病毒载体仍然是目前最流行和最有效的系统。
慢病毒载体矢量 (lv) 已成为一种选择工具, 用于将CRISPR/Cas9系统的组件在体内用于不同的应用程序4, 5, 6, 7。一些关键功能使 lv 成为这个过程的一个流行的选择, 包括它们感染分裂和非分裂细胞的能力, 低免疫原性和极小的细胞毒性 (在参考8中被审查)。因此, LV 介导的基因治疗已被用于治疗传染性疾病, 如 HIV-1, HBV, 和 HSV-1, 以及纠正的缺陷, 如囊性纤维化和新血管性黄斑变性等人类遗传性疾病4,5,7,9,10,11. 此外, lv 已被有效地修改, 以进行多重基因编辑在不同的基因组位点使用单一的向量系统12。
然而, lv 融入宿主基因组的固有特性可能是诱变性的, 而且常常妨碍其作为转基因运载工具的效用, 特别是在临床环境中。此外, 由于稳定集成的 lv 表达他们的转基因在可持续的高水平, 这个系统是不适用于交付基因编辑组分例如 CRISPR/Cas9;过度表达的 Cas9-guide RNA (gRNA) 和类似的蛋白质, 如 ZFNs, 是与高级别的离靶效应, 其中包括不良突变13,14,15,16,17 , 并可能增强细胞毒性18。因此, 为了实现精确的基因编辑和最小的离靶效应, 有必要设计系统, 使基因编辑成分的瞬时表达。
近年来, 在单元格16、19、20、21 (在参考22中复查) 中, 已开发出各种交付平台以瞬时表达 CRISPR/Cas9。这些方法包括依赖直接将纯化的 Cas9 与适当的导 rna 一起引入细胞, 这在与质粒介导的转染16相比较中被证明更有效。研究表明, 由导 RNA/Cas9 颗粒组成的 ribonucleoprotein (RNP) 配合物在其靶上进行 DNA 解切后迅速转过来, 表明这些成分的短期表达足以达到健壮基因编辑16。可想而知, 非整合病毒载体平台, 如腺相关病毒载体 (自动增值服务) 可以提供一个可行的替代方案, 提供基因编辑机制的细胞。不幸的是, AAV 衣壳的封装能力明显低于 lv (< 5kb), 这严重阻碍了它们在单个向量中封装多组件 CRISPR 工具包的能力 (在参考8中进行了审查).值得注意的是, 添加抑制组蛋白乙酰的化合物 (例如, 丁酸钠23) 或阻碍细胞周期 (如, 咖啡因24) 已经显示增加慢病毒载体效价。尽管最近取得了一些进展, 但迄今为止发展起来的瞬态表达系统仍然受到一些缺陷的阻碍, 例如生产效率降低, 导致病毒滴度降低, 病毒的传导效率低。这些方法25。
整合酶缺乏慢病毒载体载体 (IDLVs) 是基因运载工具发展的一个重要进步, 因为它们结合了 lv 的包装能力和细胞中 AAV 样 episomal 维护的额外好处。这些功能帮助 IDLVs 在很大程度上规避了与整合向量有关的主要问题, 即持续过度表达潜在的毒性元素和整合介导的致突变性。以前已证明 IDLVs 可以成功修改以增强 episomal 基因表达式26,27。关于 IDLV 介导的 CRISPR/Cas9 交付, 低生产效价和较低表达的 episome 基因组相对于整合酶精通慢病毒载体系统限制其效用为善意工具, 以提供基因组编辑转基因结构。我们最近证明, 与 IDLV 生产相关的转基因表达和病毒效价都有明显的增强, 包括在病毒表达式卡带28内的转录因子 Sp1 的结合点。改良的 IDLVs 支持 CRISPR 介导的基因编辑体外(在 HEK-293T 细胞) 和体内(在有丝分裂后的脑神经元), 同时诱导最小的离靶突变相比, 相应的 ICLV 介导系统28。总的来说, 我们开发了一个新的, 紧凑的, 在一个 IDLV 平台上进行的 CRISPR 工具包, 并概述了使用这种运载工具, 以增强基因编辑的各种优势。
介绍了 IDLV-CRISPR/Cas9 系统的生产方案, 包括 IDLVs 的组装、纯化、浓缩、滴定等各个步骤, 以及验证这些载体的基因编辑功效的策略。该协议易于扩展, 以满足不同调查人员的需要, 旨在成功地生成 LV 矢量, 其范围为 1 x 1010传感单元 (TU)/mL。通过本协议生成的向量可以有效地感染几种不同的细胞类型, 包括难以传感器的胚胎干细胞、造血细胞 (T 细胞和巨噬细胞), 培养和在体内-注入的神经元。此外, 该议定书同样适用于类似数量的整合酶能力慢病毒载体载体的生产。
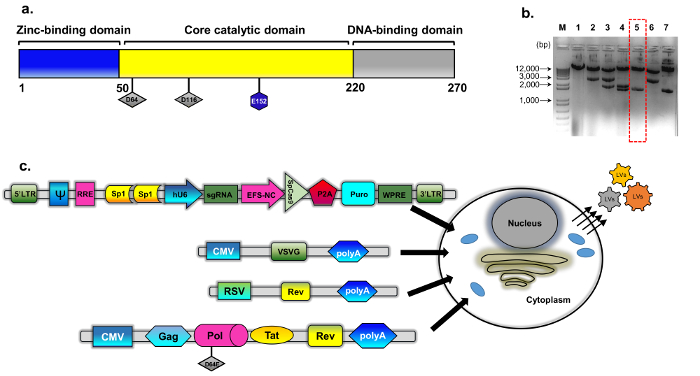
图 1: IDLV 包装.(a)野生型整合酶蛋白(b ) 的示意图该改性质粒来源于 psPAX2 (见方法, 质粒结构)。具有代表性的琼脂糖凝胶图像的克隆整合酶克隆筛选。采用标准质粒 dna 分离小试剂盒进行了 EcoRV 和 SphI 的消化, 分析了 dna 样品的制备。在INT中, D64E 替换的直接 (桑格) 排序方法进一步验证了正确消化的克隆 (数字5、虚线红色框)。整合酶包装盒被命名为 pBK43。(c)用于生成 IDLV-CRISPR/Cas9 向量的瞬变转染协议的示意图, 显示了用 VSV、包装和转基因磁带 (Sp1-CRISPR/Cas9 的多项质粒) 转移的293T 细胞。从细胞膜芽出的病毒微粒含有载体的全长 RNA (用转基因卡带表示)。第二代 IDLV 包装系统使用, 其中包括调节蛋白达和启示录转速表达式进一步补充从一个单独的卡带 (合胞病毒-转速-质粒)。Abbrev: LTR 长端重复、VSV、水泡口炎病毒 G 蛋白、pCMV 巨细胞病毒启动子;瓣肉瘤病毒促进剂;实用 (转速响应元素)。表达式盒中的其他调控元素包括 Sp1-binding 站点、转速响应元件 (实用)、土拨鼠肝炎病毒转录后水平调节元件 (WPRE)、核心伸长因子1α启动子 (EFS NC)、矢量封装元素ψ (psi), 人巨细胞病毒 (cmv) 启动子和人类 U6 启动子。请单击此处查看此图的较大版本.
Protocol
Representative Results
Discussion
IDLVs 已经开始成为体内基因编辑的首选载体, 特别是在遗传疾病的背景下, 这主要是由于与这些媒介相关联的突变风险低, 与整合交付平台22,28. 在当前手稿中, 我们试图详细说明最近在实验室28中开发的改进的 IDLV-CRISPR/Cas9 系统的生产相关的协议。
对现有平台的修改
使用此方法, 我们能够在 1 x …
Disclosures
The authors have nothing to disclose.
Acknowledgements
我们要感谢生物学系, 杜克大学医学院和院长办公室的基础科学, 杜克大学。我们还感谢杜克病毒媒介核心成员对手稿的评论。质粒 pLenti CRISPRv2 是来自冯张 (广研院) 的礼物。LV 包装系统, 包括质粒 psPAX2, VSV, pMD2. g 和 pRSV 是来自 Trono (瑞士 EPFL) 的一种礼物。这项工作的财政支助由南卡罗来纳大学医学院提供, 补助金 RDF18080-E202 (B. K)。
Materials
| Equipment | |||
| Optima XPN-80 Ultracentrifuge | Beckman Coulter | A99839 | |
| Allegra 25R tabletop centrifuge | Beckman Coulter | 369434 | |
| xMark Microplate Absorbance plate reader | Bio-Rad | 1681150 | |
| BD FACS | Becton Dickinson | 338960 | |
| Inverted fluorescence microscope | Leica | DM IRB2 | |
| 0.45-μm filter unit, 500mL | Corning | 430773 | |
| Conical bottom ultracentrifugation tubes | Seton Scientific | 5067 | |
| Conical tube adapters | Seton Scientific | PN 4230 | |
| SW32Ti swinging-bucket rotor | Beckman Coulter | 369650 | |
| 15 mL conical centrifuge tubes | Corning | 430791 | |
| 50mL conical centrifuge tubes | Corning | 430291 | |
| High-binding 96-well plates | Corning | 3366 | |
| 150 mm TC-Treated Cell Culture dishes with 20 mm Grid | Corning | 353025 | |
| 100mm TC-Treated Culture Dish | Corning | 430167 | |
| 0.22 μM filter unit, 1L | Corning | 430513 | |
| QIAprep Spin Miniprep Kit (50) | Qiagen | 27104 | |
| Tissue culture pipettes, 5 mL | Corning | 4487 | |
| Tissue culture pipettes, 10 mL | Corning | 4488 | |
| Tissue culture pipettes, 25 mL | Corning | 4489 | |
| Hemacytometer with cover slips | Cole-Parmer | UX-79001-00 | |
| Name | Company | Catalog Number | Comments |
| Cell culture reagents | |||
| Human embryonic kidney 293T (HEK 293T) cells | ATCC | CRL-3216 | |
| 293FT cells | Thermo Fisher Scientific | R70007 | |
| DMEM, high glucose media | Gibco | 11965 | |
| Cosmic Calf Serum | Hyclone | SH30087.04 | |
| Antibiotic-antimycotic solution, 100X | Sigma Aldrich | A5955-100ML | |
| Sodium pyruvate | Sigma Aldrich | S8636-100ML | |
| Non-Essential Amino Acid (NEAA) | Hyclone | SH30087.04 | |
| RPMI 1640 media | Thermo Fisher Scientific | 11875-085 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Trypsin-EDTA 0.05% | Gibco | 25300054 | |
| BES (N, N-bis (2-hydroxyethyl)-2-amino-ethanesulfonic acid) | Sigma Aldrich | B9879 – BES | |
| Gelatin | Sigma Aldrich | G1800-100G | |
| Name | Company | Catalog Number | Comments |
| p24 ELISA reagents | |||
| Monoclonal anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | 3537 | |
| HIV-1 standards | NIH AIDS Research and Reference Reagent Program | SP968F | |
| Polyclonal rabbit anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | SP451T | |
| Goat anti-rabbit horseradish peroxidase IgG | Sigma Aldrich | 12-348 | Working concentration 1:1500 |
| Normal mouse serum, Sterile, 500mL | Equitech-Bio | SM30-0500 | |
| Goat serum, Sterile, 10mL | Sigma | G9023 | Working concentration 1:1000 |
| TMB peroxidase substrate | KPL | 5120-0076 | Working concentration 1:10,000 |
| Name | Company | Catalog Number | Comments |
| Plasmids | |||
| psPAX2 | Addgene | 12260 | |
| pMD2.G | Addgene | 12259 | |
| pRSV-Rev | Addgene | 12253 | |
| lentiCRISPR v2 | Addgene | 52961 | |
| Name | Company | Catalog Number | Comments |
| Restriction enzymes | |||
| BsrGI | New England Biolabs | R0575S | |
| BsmBI | New England Biolabs | R0580S | |
| EcoRV | New England Biolabs | R0195S | |
| KpnI | New England Biolabs | R0142S | |
| PacI | New England Biolabs | R0547S | |
| SphI | New England Biolabs | R0182S |
References
- Horvath, P., Barrangou, R. CRISPR/Cas, the immune system of bacteria and archaea. Science. 327 (5962), 167-170 (2010).
- Marraffini, L. A., Sontheimer, E. J. CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea. Nat Rev Genet. 11 (3), 181-190 (2010).
- Kim, H., Kim, J. S. A guide to genome engineering with programmable nucleases. Nat Rev Genet. 15 (5), 321-334 (2014).
- Bellec, J., et al. CFTR inactivation by lentiviral vector-mediated RNA interference and CRISPR-Cas9 genome editing in human airway epithelial cells. Curr Gene Ther. 15 (5), 447-459 (2015).
- Kennedy, E. M., et al. Suppression of hepatitis B virus DNA accumulation in chronically infected cells using a bacterial CRISPR/Cas RNA-guided DNA endonuclease. Virology. 476, 196-205 (2015).
- Roehm, P. C., et al. Inhibition of HSV-1 Replication by Gene Editing Strategy. Sci Rep. 6, 23146 (2016).
- Wang, W., et al. CCR5 gene disruption via lentiviral vectors expressing Cas9 and single guided RNA renders cells resistant to HIV-1 infection. PLoS One. 9 (12), e115987 (2014).
- Kantor, B., Bailey, R. M., Wimberly, K., Kalburgi, S. N., Gray, S. J. Methods for gene transfer to the central nervous system. Adv Genet. 87, 125-197 (2014).
- Lebbink, R. J., et al. A combinational CRISPR/Cas9 gene-editing approach can halt HIV replication and prevent viral escape. Sci Rep. 7, 41968 (2017).
- Xu, L., et al. CRISPR/Cas9-Mediated CCR5 Ablation in Human Hematopoietic Stem/Progenitor Cells Confers HIV-1 Resistance In Vivo. Mol Ther. , (2017).
- Yiu, G., Tieu, E., Nguyen, A. T., Wong, B., Smit-McBride, Z. Genomic Disruption of VEGF-A Expression in Human Retinal Pigment Epithelial Cells Using CRISPR-Cas9 Endonuclease. Invest Ophthalmol Vis Sci. 57 (13), 5490-5497 (2016).
- Kabadi, A. M., Ousterout, D. G., Hilton, I. B., Gersbach, C. A. Multiplex CRISPR/Cas9-based genome engineering from a single lentiviral vector. Nucleic Acids Res. 42 (19), e147 (2014).
- Fu, Y., Sander, J. D., Reyon, D., Cascio, V. M., Joung, J. K. Improving CRISPR-Cas nuclease specificity using truncated guide RNAs. Nat Biotechnol. 32 (3), 279-284 (2014).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat Biotechnol. 31 (9), 827-832 (2013).
- Kim, S., Kim, D., Cho, S. W., Kim, J., Kim, J. S. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Res. 24 (6), 1012-1019 (2014).
- Pattanayak, V., et al. High-throughput profiling of off-target DNA cleavage reveals RNA-programmed Cas9 nuclease specificity. Nat Biotechnol. 31 (9), 839-843 (2013).
- Shalem, O., et al. Genome-scale CRISPR-Cas9 knockout screening in human cells. Science. 343 (6166), 84-87 (2014).
- Schaefer, K. A., et al. Unexpected mutations after CRISPR-Cas9 editing in vivo. Nat Methods. 14 (6), 547-548 (2017).
- Choi, J. G., et al. Lentivirus pre-packed with Cas9 protein for safer gene editing. Gene Ther. 23 (7), 627-633 (2016).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
- Truong, D. J., et al. Development of an intein-mediated split-Cas9 system for gene therapy. Nucleic Acids Res. 43 (13), 6450-6458 (2015).
- Nelson, C. E., Gersbach, C. A. Engineering Delivery Vehicles for Genome Editing. Annu Rev Chem Biomol Eng. 7, 637-662 (2016).
- Jaalouk, D. E., Crosato, M., Brodt, P., Galipeau, J. Inhibition of histone deacetylation in 293GPG packaging cell line improves the production of self-inactivating MLV-derived retroviral vectors. Virol J. 3, 27 (2006).
- Ellis, B. L., Potts, P. R., Porteus, M. H. Creating higher titer lentivirus with caffeine. Hum Gene Ther. 22 (1), 93-100 (2011).
- Hoban, M. D., et al. Delivery of Genome Editing Reagents to Hematopoietic Stem/Progenitor Cells. Curr Protoc Stem Cell Biol. 36, 1-10 (2016).
- Bayer, M., et al. A large U3 deletion causes increased in vivo expression from a nonintegrating lentiviral vector. Mol Ther. 16 (12), 1968-1976 (2008).
- Kantor, B., Ma, H., Webster-Cyriaque, J., Monahan, P. E., Kafri, T. Epigenetic activation of unintegrated HIV-1 genomes by gut-associated short chain fatty acids and its implications for HIV infection. Proc Natl Acad Sci U S A. 106 (44), 18786-18791 (2009).
- Ortinski, P. I., O’Donovan, B., Dong, X., Kantor, B. Integrase-Deficient Lentiviral Vector as an All-in-One Platform for Highly Efficient CRISPR/Cas9-Mediated Gene Editing. Mol Ther Methods Clin Dev. 5, 153-164 (2017).
- Kantor, B., et al. Notable reduction in illegitimate integration mediated by a PPT-deleted, nonintegrating lentiviral vector. Mol Ther. 19 (3), 547-556 (2011).
- Berkhout, B., Verhoef, K., van Wamel, J. L., Back, N. K. Genetic instability of live, attenuated human immunodeficiency virus type 1 vaccine strains. J Virol. 73 (2), 1138-1145 (1999).
- Gomez-Gonzalo, M., et al. The hepatitis B virus X protein induces HIV-1 replication and transcription in synergy with T-cell activation signals: functional roles of NF-kappaB/NF-AT and SP1-binding sites in the HIV-1 long terminal repeat promoter. J Biol Chem. 276 (38), 35435-35443 (2001).
- Kim, Y. S., et al. Artificial zinc finger fusions targeting Sp1-binding sites and the trans-activator-responsive element potently repress transcription and replication of HIV-1. J Biol Chem. 280 (22), 21545-21552 (2005).
- Ortinski, P. I., Lu, C., Takagaki, K., Fu, Z., Vicini, S. Expression of distinct alpha subunits of GABAA receptor regulates inhibitory synaptic strength. J Neurophysiol. 92 (3), 1718-1727 (2004).
- Van Lint, C., et al. Transcription factor binding sites downstream of the human immunodeficiency virus type 1 transcription start site are important for virus infectivity. J Virol. 71 (8), 6113-6127 (1997).
- Van Lint, C., Ghysdael, J., Paras, P., Burny, A., Verdin, E. A transcriptional regulatory element is associated with a nuclease-hypersensitive site in the pol gene of human immunodeficiency virus type 1. J Virol. 68 (4), 2632-2648 (1994).
- Xu, W., Russ, J. L., Eiden, M. V. Evaluation of residual promoter activity in gamma-retroviral self-inactivating (SIN) vectors. Mol Ther. 20 (1), 84-90 (2012).
- . Testing for Replication Competent Retrovirus (RCR)/Lentivirus (RCL) in Retroviral and Lentiviral Vector Based Gene Therapy Products – Revisiting Current FDA Recommendations Available from: https://sites.duke.edu/dvvc/files/2016/05/FDA-recommendation-for-RCR-testing.pdf (2017)
- . Biosafety in Microbiological and Biomedical Laboratories Available from: https://www.cdc.gov/biosafety/publications/bmbl5/bmbl.pdf (2017)
- Dull, T., et al. A third-generation lentivirus vector with a conditional packaging system. J Virol. 72 (11), 8463-8471 (1998).
- Liu, X. S., et al. Editing DNA Methylation in the Mammalian Genome. Cell. 167 (1), 233-247 (2016).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Zetsche, B., et al. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell. 163 (3), 759-771 (2015).

