Um protocolo para a produção de Lentivirus vetores Integrase deficiente CRISPR/Cas9-mediada Gene nocaute em dividir células
Summary
Descrevemos a estratégia de produção de vetores de Lentivirus integrase deficiente (IDLVs) como veículos para a entrega CRISPR/Cas9 para as células. Com uma capacidade de mediar a edição de gene rápido e robusto nas células, IDLVs apresentar um mais seguro e plataforma de vector igualmente eficazes para a entrega do gene comparado com vetores integrase-competentes.
Abstract
Particulas de Lentivirus vetores são uma escolha ideal para a entrega de componentes de edição de gene de células devido à sua capacidade para estàvel transducing uma ampla variedade de células e mediando a altos níveis de expressão gênica. No entanto, sua capacidade de integrar o genoma celular do hospedeiro aumenta o risco de mutagenicidade insercional e assim gera preocupações de segurança e limita o seu uso em situações clínicas. Além disso, a expressão persistente de gene-editando componentes entregues por estes aumentos de integração-competente Lentivirus vetores (ICLVs) a probabilidade de promíscuo gene alvejar. Como alternativa, foi desenvolvida uma nova geração de vetores de Lentivirus integrase deficiente (IDLVs) que aborda muitas dessas preocupações. Aqui o protocolo de produção de uma nova e melhorada plataforma IDLV para edição de genes mediada por CRISPR e lista as etapas envolvidas na purificação e concentração de tais vetores é descrita e sua transdução e gene-edição eficiência usando HEK-293T demonstrou-se células. Este protocolo é facilmente escalável e pode ser usado para gerar IDLVs foram capazes de transducing células in vitro e in vivo. Além disso, este protocolo pode ser facilmente adaptado para a produção de ICLVs.
Introduction
Edição de gene preciso constitui a pedra angular das grandes avanços biomédicos que envolvem o desenvolvimento de novas estratégias para combater doenças genéticas. Na vanguarda das tecnologias de edição de gene é o método baseando-se no uso do cabrilhantado regularly –eunterspaced short palindromic repeats (CRISPR) / sistema de Cas9 que foi inicialmente identificado como um componente da imunidade bacteriana contra a invasão de material genético viral (revisto em referências1,2). Uma grande vantagem do sistema CRISPR/Cas9 sobre outras ferramentas de edição de gene, como nucleases dedo de zinco (ZFNs) e as nucleases efetoras como ativador da transcrição (TALENs) (revistas em referência3), é a relativa simplicidade de design do plasmídeo e construção de componentes CRISPR — um recurso que tem alimentado a expansão do gene-edição de alguns laboratórios especializados para uma comunidade de pesquisa muito mais ampla. Além disso, a simplicidade de programação CRISPR/Cas9 e sua capacidade de reconhecimento do alvo multiplexado alimentaram ainda mais sua popularidade como uma tecnologia de baixo custo e fácil de usar. Entre os vários métodos disponíveis para pesquisadores entregar tais componentes de edição de gene para as células, vetores virais continuam a ser de longe o sistema mais popular e eficiente.
Vetores de Lentivirus (LVs) têm emergido como o veículo de escolha para entregar os componentes do CRISPR/Cas9 sistema na vivo para diversas aplicações4,5,6,7. Vários recursos chaves fazem LVs uma escolha popular para este processo, incluindo a sua capacidade de infectar células de divisão e não dividindo, baixa imunogenicidade e mínima toxicidade celular (revisto em referência8). Como resultado, a terapia gênica mediada por LV tem sido empregada em tratamentos de doenças infecciosas, tais como o HBV, HIV-1 e HSV-1, bem como na correção de defeitos subjacentes humanas doenças hereditárias, como fibrose cística e degeneração macular neo-vascular 4 , 5 , 7 , 9 , 10 , 11. Além disso, a LVs foram efetivamente modificados para realizar a edição de gene multiplex em distinta loci genômicos usando um vetor único sistema12.
No entanto, a propriedade inerente de LVs para integrar o genoma do hospedeiro pode ser mutagênico e frequentemente desfavorecem sua utilidade como veículos de entrega do transgene, especialmente em situações clínicas. Além disso, desde que integrado estàvel LVs expressam seus transgenes níveis elevados sustentavelmente, este sistema é suficientemente adaptados para a entrega de componentes de edição de gene como CRISPR/Cas9; superexpressão de RNA Cas9-guia (gRNA) e proteínas similares, tais como ZFNs, estão associados com níveis elevados de efeitos fora do alvo, que incluem mutações indesejáveis13,14,15,16 , 17 e que potencialmente pode melhorar a citotoxicidade18. Portanto, para obter precisão edição de gene com efeitos mínimos fora do alvo, é imperativo para design de sistemas que permitem a expressão transiente de gene editando componentes.
Nos últimos anos, uma variedade de plataformas de entrega foram desenvolvidos para expressar transitoriamente CRISPR/Cas9 em células16,19,20,21 (revisto em referência22). Estes incluem métodos que dependem diretamente introduzir Cas9 purificado, juntamente com as guia apropriada RNAs em células, que foi mostrado para ser mais eficaz no gene alvo-edição em comparação com a transfeccao mediada por plasmídeo16. Estudos têm demonstrado que ribonucleoprotein (RNP) complexos consistindo de guia RNA/Cas9 partículas são rapidamente virou depois da mediação de clivagem de DNA em seus alvos, sugerindo que a expressão a curto prazo desses componentes é suficiente para alcançar gene robusto edição16. É concebível, não-integração de plataformas de vetor viral como vetores de vírus adeno-associado (AAVs) podem fornecer uma alternativa viável para entregar máquinas edição de gene em células. Infelizmente, capsids AAV possuem capacidade de embalagem significativamente menor do que o LVs (< 5KB), que dificulta severamente sua capacidade para empacotar o toolkit CRISPR multi-componentes dentro de um único vetor (revisto em referência8). É interessante notar que a adição de compostos que inibem a histona deacetilases (por exemplo, o butirato de sódio23) ou impedir o ciclo celular (por exemplo, cafeína24) foram mostrados para aumentar a concentração de particulas de Lentivirus. Apesar dos progressos recentes, os sistemas de expressão transiente desenvolvidos até agora ainda são impedidos por várias deficiências, tais como a baixa eficiência da produção, que levam a reduzida concentração viral e transdução de baixa eficiência dos vírus gerados através de tais abordagens25.
Vetores de Lentivirus integrase deficiente (IDLVs) representam um grande avanço no desenvolvimento de veículos de entrega de gene, como eles combinam a capacidade de empacotamento de VLS com o benefício adicionado de AAV-como manutenção epissomal nas células. Esses recursos ajudam IDLVs largamente contornar as principais questões associadas com a integração de vetores, vis-à-vis a superexpressão contínua do potencial genotóxico de elementos e mutagenicidade mediada por integração. Foi previamente demonstrado que IDLVs podem ser modificadas com êxito para melhorar a expressão de gene epissomal26,27. Com relação à entrega de mediada por IDLV CRISPR/Cas9, títulos de baixa produção e menor expressão dos genomas episome-suportado em relação a sistemas de Lentivirus integrase-proficiente limita sua utilidade como ferramentas de bona fide para a entrega de genoma-edição construções de transgénicas. Recentemente demonstramos que tanto a expressão do transgene e títulos virais associados à produção de IDLV são significativamente melhorados através da inclusão de binding sites para o fator de transcrição Sp1 dentro da gaveta de expressão viral28. Os IDLVs modificados robustamente suportado gene mediada por CRISPR edição tanto in vitro (em células HEK-293T) e na vivo (no pós mitóticas neurônios), enquanto a indução de mutações de fora do alvo mínimas comparadas com o correspondente mediada por ICLV sistemas de28. Em geral, desenvolvemos um romance, compacto, tudo-em-um kit de ferramentas CRISPR executados em uma plataforma IDLV e descritas as várias vantagens de usar esse veículo entrega para edição avançada do gene.
Aqui, o protocolo de produção do sistema de IDLV-CRISPR/Cas9 é descrito, incluindo as diversas etapas envolvidas em assembly, purificação, concentração e titulação da IDLVs, bem como estratégias para validar a eficácia de gene-edição destes vetores. Este protocolo é facilmente escalável para atender as necessidades de diferentes investigadores e é projetado para gerar com êxito vetores de LV, com uma concentração na faixa de 1 x 1010 transducing unidades (TU) / mL. Os vetores gerados através deste protocolo podem ser utilizados para infectar eficientemente vários diferentes tipos de células, incluindo células-tronco embrionárias difícil-para-transduce, células hematopoiéticas (células T e macrófagos) e culta e vivo em– neurônios injetados. Além disso, o protocolo é igualmente adequado para a produção de vetores de Lentivirus integrase-competente em quantidades semelhantes.
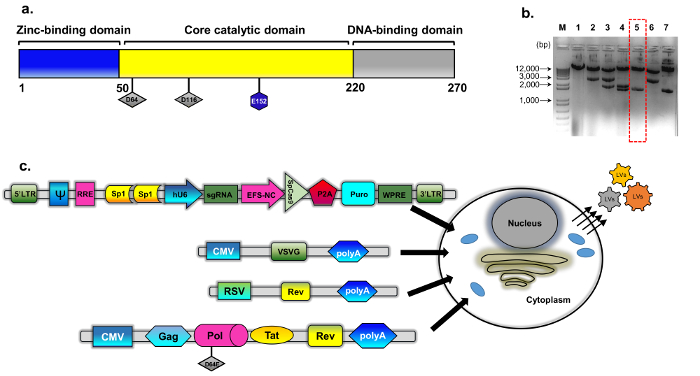
Figura 1: embalagem de IDLV. (a) esquema do tipo selvagem integrase proteína (b) o plasmídeo modificado foi derivado de psPAX2 (ver métodos, construção de plasmídeo para detalhes). Imagem de gel de agarose representante dos clones selecionados para clones mutantes integrase. Preparado usando um isolamento de DNA plasmídeo padrão mini kit de amostras de DNA foram analisadas por digestão com EcoRV e SphI. O clone digerido corretamente (número 5, caixa vermelha tracejada) verificou-se ainda mais por sequenciamento direto (Sanger) para a substituição de D64E em INT. A fita de empacotamento deficiente integrase foi nomeada pBK43. (c) diagrama esquemático do protocolo do transfection transiente empregadas para gerar vetores de IDLV-CRISPR/Cas9, mostrando 293T células transfectadas com VSV-G, embalagens e fitas do transgene (Sp1-CRISPR/Cas9 tudo-em-um plasmídeo). Partículas virais que brote para fora da membrana celular contêm o RNA completo do vetor (expressado o transgene cassete). A segunda geração do sistema de embalagem-IDLV foi usada, que inclui as proteínas reguladoras Tat e expressão de Rev. Rev é complementada ainda mais de uma gaveta separada (RSV-REV-plasmídeo). Abrev: vírus de repetição, VSV-G, estomatite vesicular LTR-Long-terminal G-proteína, promotor de pCMV-citomegalovírus; Promotor de Rous sarcoma vírus (RSV); RRE-(elemento de resposta Rev). Outros elementos reguladores na gaveta a expressão incluem locais Sp1-obrigatórios, elemento Rev Response (RRE), marmota hepatite vírus Posttranscriptional regulamentar elemento (WPRE), um promotor de 1 α fator núcleo-alongamento (EFS-NC), a embalagem de vetor elemento ψ (psi), promotor de citomegalovírus (CMV) humano e humano U6 promotor. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
IDLVs começaram a emergir como o veículo de escolha para na vivo gene-edição, especialmente no contexto de doenças genéticas, devido em grande parte para o baixo risco de mutagênese associado a estes vetores, em comparação com a integração de plataformas de entrega22 , 28. no manuscrito atual, nós procuramos detalhar o protocolo associado com a produção do sistema melhorada para a IDLV-CRISPR/Cas9 tudo-em-um que foi recentemente desenvolvid…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Gostaríamos de agradecer o departamento de neurobiologia, Duke University School of Medicine e gabinete do reitor para a ciência básica, Duke University. Agradecemos também a membros do núcleo do vetor Viral Duke para comentários sobre o manuscrito. Plasmídeo pLenti CRISPRv2 foi presente do Feng Zhang (Broad Institute). O sistema de LV-embalagem, incluindo o psPAX2 de plasmídeos, VSV-G, pMD2.G e pRSV-Rev foi um presente tipo de Didier Trono (EPFL, Suíça). Apoio financeiro para este trabalho foi fornecido pela Universidade de Carolina do Sul escola de medicina, conceda RDF18080-E202 (Rafaella).
Materials
| Equipment | |||
| Optima XPN-80 Ultracentrifuge | Beckman Coulter | A99839 | |
| Allegra 25R tabletop centrifuge | Beckman Coulter | 369434 | |
| xMark Microplate Absorbance plate reader | Bio-Rad | 1681150 | |
| BD FACS | Becton Dickinson | 338960 | |
| Inverted fluorescence microscope | Leica | DM IRB2 | |
| 0.45-μm filter unit, 500mL | Corning | 430773 | |
| Conical bottom ultracentrifugation tubes | Seton Scientific | 5067 | |
| Conical tube adapters | Seton Scientific | PN 4230 | |
| SW32Ti swinging-bucket rotor | Beckman Coulter | 369650 | |
| 15 mL conical centrifuge tubes | Corning | 430791 | |
| 50mL conical centrifuge tubes | Corning | 430291 | |
| High-binding 96-well plates | Corning | 3366 | |
| 150 mm TC-Treated Cell Culture dishes with 20 mm Grid | Corning | 353025 | |
| 100mm TC-Treated Culture Dish | Corning | 430167 | |
| 0.22 μM filter unit, 1L | Corning | 430513 | |
| QIAprep Spin Miniprep Kit (50) | Qiagen | 27104 | |
| Tissue culture pipettes, 5 mL | Corning | 4487 | |
| Tissue culture pipettes, 10 mL | Corning | 4488 | |
| Tissue culture pipettes, 25 mL | Corning | 4489 | |
| Hemacytometer with cover slips | Cole-Parmer | UX-79001-00 | |
| Name | Company | Catalog Number | Comments |
| Cell culture reagents | |||
| Human embryonic kidney 293T (HEK 293T) cells | ATCC | CRL-3216 | |
| 293FT cells | Thermo Fisher Scientific | R70007 | |
| DMEM, high glucose media | Gibco | 11965 | |
| Cosmic Calf Serum | Hyclone | SH30087.04 | |
| Antibiotic-antimycotic solution, 100X | Sigma Aldrich | A5955-100ML | |
| Sodium pyruvate | Sigma Aldrich | S8636-100ML | |
| Non-Essential Amino Acid (NEAA) | Hyclone | SH30087.04 | |
| RPMI 1640 media | Thermo Fisher Scientific | 11875-085 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Trypsin-EDTA 0.05% | Gibco | 25300054 | |
| BES (N, N-bis (2-hydroxyethyl)-2-amino-ethanesulfonic acid) | Sigma Aldrich | B9879 – BES | |
| Gelatin | Sigma Aldrich | G1800-100G | |
| Name | Company | Catalog Number | Comments |
| p24 ELISA reagents | |||
| Monoclonal anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | 3537 | |
| HIV-1 standards | NIH AIDS Research and Reference Reagent Program | SP968F | |
| Polyclonal rabbit anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | SP451T | |
| Goat anti-rabbit horseradish peroxidase IgG | Sigma Aldrich | 12-348 | Working concentration 1:1500 |
| Normal mouse serum, Sterile, 500mL | Equitech-Bio | SM30-0500 | |
| Goat serum, Sterile, 10mL | Sigma | G9023 | Working concentration 1:1000 |
| TMB peroxidase substrate | KPL | 5120-0076 | Working concentration 1:10,000 |
| Name | Company | Catalog Number | Comments |
| Plasmids | |||
| psPAX2 | Addgene | 12260 | |
| pMD2.G | Addgene | 12259 | |
| pRSV-Rev | Addgene | 12253 | |
| lentiCRISPR v2 | Addgene | 52961 | |
| Name | Company | Catalog Number | Comments |
| Restriction enzymes | |||
| BsrGI | New England Biolabs | R0575S | |
| BsmBI | New England Biolabs | R0580S | |
| EcoRV | New England Biolabs | R0195S | |
| KpnI | New England Biolabs | R0142S | |
| PacI | New England Biolabs | R0547S | |
| SphI | New England Biolabs | R0182S |
References
- Horvath, P., Barrangou, R. CRISPR/Cas, the immune system of bacteria and archaea. Science. 327 (5962), 167-170 (2010).
- Marraffini, L. A., Sontheimer, E. J. CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea. Nat Rev Genet. 11 (3), 181-190 (2010).
- Kim, H., Kim, J. S. A guide to genome engineering with programmable nucleases. Nat Rev Genet. 15 (5), 321-334 (2014).
- Bellec, J., et al. CFTR inactivation by lentiviral vector-mediated RNA interference and CRISPR-Cas9 genome editing in human airway epithelial cells. Curr Gene Ther. 15 (5), 447-459 (2015).
- Kennedy, E. M., et al. Suppression of hepatitis B virus DNA accumulation in chronically infected cells using a bacterial CRISPR/Cas RNA-guided DNA endonuclease. Virology. 476, 196-205 (2015).
- Roehm, P. C., et al. Inhibition of HSV-1 Replication by Gene Editing Strategy. Sci Rep. 6, 23146 (2016).
- Wang, W., et al. CCR5 gene disruption via lentiviral vectors expressing Cas9 and single guided RNA renders cells resistant to HIV-1 infection. PLoS One. 9 (12), e115987 (2014).
- Kantor, B., Bailey, R. M., Wimberly, K., Kalburgi, S. N., Gray, S. J. Methods for gene transfer to the central nervous system. Adv Genet. 87, 125-197 (2014).
- Lebbink, R. J., et al. A combinational CRISPR/Cas9 gene-editing approach can halt HIV replication and prevent viral escape. Sci Rep. 7, 41968 (2017).
- Xu, L., et al. CRISPR/Cas9-Mediated CCR5 Ablation in Human Hematopoietic Stem/Progenitor Cells Confers HIV-1 Resistance In Vivo. Mol Ther. , (2017).
- Yiu, G., Tieu, E., Nguyen, A. T., Wong, B., Smit-McBride, Z. Genomic Disruption of VEGF-A Expression in Human Retinal Pigment Epithelial Cells Using CRISPR-Cas9 Endonuclease. Invest Ophthalmol Vis Sci. 57 (13), 5490-5497 (2016).
- Kabadi, A. M., Ousterout, D. G., Hilton, I. B., Gersbach, C. A. Multiplex CRISPR/Cas9-based genome engineering from a single lentiviral vector. Nucleic Acids Res. 42 (19), e147 (2014).
- Fu, Y., Sander, J. D., Reyon, D., Cascio, V. M., Joung, J. K. Improving CRISPR-Cas nuclease specificity using truncated guide RNAs. Nat Biotechnol. 32 (3), 279-284 (2014).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat Biotechnol. 31 (9), 827-832 (2013).
- Kim, S., Kim, D., Cho, S. W., Kim, J., Kim, J. S. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Res. 24 (6), 1012-1019 (2014).
- Pattanayak, V., et al. High-throughput profiling of off-target DNA cleavage reveals RNA-programmed Cas9 nuclease specificity. Nat Biotechnol. 31 (9), 839-843 (2013).
- Shalem, O., et al. Genome-scale CRISPR-Cas9 knockout screening in human cells. Science. 343 (6166), 84-87 (2014).
- Schaefer, K. A., et al. Unexpected mutations after CRISPR-Cas9 editing in vivo. Nat Methods. 14 (6), 547-548 (2017).
- Choi, J. G., et al. Lentivirus pre-packed with Cas9 protein for safer gene editing. Gene Ther. 23 (7), 627-633 (2016).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
- Truong, D. J., et al. Development of an intein-mediated split-Cas9 system for gene therapy. Nucleic Acids Res. 43 (13), 6450-6458 (2015).
- Nelson, C. E., Gersbach, C. A. Engineering Delivery Vehicles for Genome Editing. Annu Rev Chem Biomol Eng. 7, 637-662 (2016).
- Jaalouk, D. E., Crosato, M., Brodt, P., Galipeau, J. Inhibition of histone deacetylation in 293GPG packaging cell line improves the production of self-inactivating MLV-derived retroviral vectors. Virol J. 3, 27 (2006).
- Ellis, B. L., Potts, P. R., Porteus, M. H. Creating higher titer lentivirus with caffeine. Hum Gene Ther. 22 (1), 93-100 (2011).
- Hoban, M. D., et al. Delivery of Genome Editing Reagents to Hematopoietic Stem/Progenitor Cells. Curr Protoc Stem Cell Biol. 36, 1-10 (2016).
- Bayer, M., et al. A large U3 deletion causes increased in vivo expression from a nonintegrating lentiviral vector. Mol Ther. 16 (12), 1968-1976 (2008).
- Kantor, B., Ma, H., Webster-Cyriaque, J., Monahan, P. E., Kafri, T. Epigenetic activation of unintegrated HIV-1 genomes by gut-associated short chain fatty acids and its implications for HIV infection. Proc Natl Acad Sci U S A. 106 (44), 18786-18791 (2009).
- Ortinski, P. I., O’Donovan, B., Dong, X., Kantor, B. Integrase-Deficient Lentiviral Vector as an All-in-One Platform for Highly Efficient CRISPR/Cas9-Mediated Gene Editing. Mol Ther Methods Clin Dev. 5, 153-164 (2017).
- Kantor, B., et al. Notable reduction in illegitimate integration mediated by a PPT-deleted, nonintegrating lentiviral vector. Mol Ther. 19 (3), 547-556 (2011).
- Berkhout, B., Verhoef, K., van Wamel, J. L., Back, N. K. Genetic instability of live, attenuated human immunodeficiency virus type 1 vaccine strains. J Virol. 73 (2), 1138-1145 (1999).
- Gomez-Gonzalo, M., et al. The hepatitis B virus X protein induces HIV-1 replication and transcription in synergy with T-cell activation signals: functional roles of NF-kappaB/NF-AT and SP1-binding sites in the HIV-1 long terminal repeat promoter. J Biol Chem. 276 (38), 35435-35443 (2001).
- Kim, Y. S., et al. Artificial zinc finger fusions targeting Sp1-binding sites and the trans-activator-responsive element potently repress transcription and replication of HIV-1. J Biol Chem. 280 (22), 21545-21552 (2005).
- Ortinski, P. I., Lu, C., Takagaki, K., Fu, Z., Vicini, S. Expression of distinct alpha subunits of GABAA receptor regulates inhibitory synaptic strength. J Neurophysiol. 92 (3), 1718-1727 (2004).
- Van Lint, C., et al. Transcription factor binding sites downstream of the human immunodeficiency virus type 1 transcription start site are important for virus infectivity. J Virol. 71 (8), 6113-6127 (1997).
- Van Lint, C., Ghysdael, J., Paras, P., Burny, A., Verdin, E. A transcriptional regulatory element is associated with a nuclease-hypersensitive site in the pol gene of human immunodeficiency virus type 1. J Virol. 68 (4), 2632-2648 (1994).
- Xu, W., Russ, J. L., Eiden, M. V. Evaluation of residual promoter activity in gamma-retroviral self-inactivating (SIN) vectors. Mol Ther. 20 (1), 84-90 (2012).
- . Testing for Replication Competent Retrovirus (RCR)/Lentivirus (RCL) in Retroviral and Lentiviral Vector Based Gene Therapy Products – Revisiting Current FDA Recommendations Available from: https://sites.duke.edu/dvvc/files/2016/05/FDA-recommendation-for-RCR-testing.pdf (2017)
- . Biosafety in Microbiological and Biomedical Laboratories Available from: https://www.cdc.gov/biosafety/publications/bmbl5/bmbl.pdf (2017)
- Dull, T., et al. A third-generation lentivirus vector with a conditional packaging system. J Virol. 72 (11), 8463-8471 (1998).
- Liu, X. S., et al. Editing DNA Methylation in the Mammalian Genome. Cell. 167 (1), 233-247 (2016).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Zetsche, B., et al. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell. 163 (3), 759-771 (2015).

