Preparazione di aziridine non attivate enantiopure e sintesi di biemamide B, D ed epiallo-isomuscarina
Summary
In questo studio, prepariamo sia enantiomeri di aziridina-2-carbossilato, che vengono utilizzati nella sintesi asimmetrica di alcaloidi, tra cui biemamide B e D, e (-)-epiallo-isomuscarina.
Abstract
Le aziridine eterocicliche contenenti azoto sono sinteticamente molto preziose per la preparazione di molecole azacicliche e acicliche. Tuttavia, è molto difficile e laborioso produrre aziridine in forme otticamente pure su larga scala per applicare la sintesi asimmetrica dei composti aza. Fortunatamente, abbiamo raggiunto con successo entrambi gli enantiomeri (2R) – e (2S) -aziridina-2-carbossilati con il gruppo α-metilbenzile che dona elettroni all’azoto dell’anello come aziridine non attivate. Queste aziridine di partenza hanno due gruppi funzionali distinti: anello a tre membri altamente reattivo e carbossilato versatile. Sono applicabili nell’apertura dell’anello o nella trasformazione dell’anello con aziridina e nella trasformazione del gruppo funzionale in altri dal carbossilato. Entrambi questi enantiomeri sono stati utilizzati nella preparazione di composti amminoaciclici e/o aza-eterociclici biologicamente importanti in modo asimmetrico. In particolare, questo rapporto descrive la prima sintesi asimmetrica espediente di entrambi gli enantiomeri di 5, prodotti naturali marini di tipo 6-diidrouracile biemamide B e D come potenziali inibitori del TGF-β. Questa sintesi consisteva nella reazione di apertura dell’anello regio- e stereoselettiva dell’aziridina-2-carbossilato e nella successiva formazione di 4-aminoteteraidropirimidina-2,4-dione. Un altro esempio in questo protocollo ha riguardato una reazione di Mukaiyama altamente stereoselettiva di aziridina-2-carbossilato e silil enol etere, seguendo l’apertura dell’anello aziridina intramolecolare per fornire un facile e facile accesso alla (-)-epiallo-isomuscarina.
Introduction
Piccoli anelli costituiti da ciclopropani, ossirani e aziridine si trovano in vari composti come prodotti naturali e farmaci 1,2. Sono utilizzati principalmente come materiali di partenza sfruttando la loro tensione ad anello. Tra i composti a tre anelli, l’aziridina è stata studiata meno ampiamente a causa della sua instabilità e reattività incontrollabile3. Come mostrato nelle mappe del potenziale elettrostatico (Figura 1), un gruppo attaccato all’anello aziridina-azoto, sia che doni elettroni o che attiri elettroni, rende diversa la basicità dell’azoto. Questa differenza fornisce un contrasto sorprendente con la reattività e la selettività delle aziridine corrispondenti.
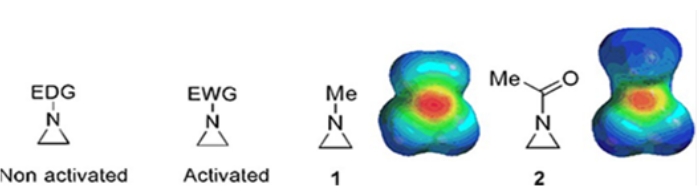
Figura 1: Strutture chimiche di aziridine “attivate” e “non attivate” e mappe del potenziale elettrostatico dei loro esempi rappresentativi N-metilaziridina e N-acetilaziridina4. Questa cifra è stata modificata con il permesso di Ranjith et al.4. Fare clic qui per visualizzare una versione più grande di questa figura.
Quando l’azoto ad anello ha un gruppo di ritiro di elettroni, come solfonato, fosfonato e carbammato, lo chiamiamo aziridina “attivata”. Questo è prontamente reattivo con i nucleofili per compensare la sua instabilità con un ambito limitato di regiochimica. Queste aziridine attivate vengono preparate attraverso vari metodi catalitici e utilizzate come materiale di partenza. Gran parte della recente chimica dell’aziridina si è occupata di queste aziridine attivate. Tuttavia, le aziridine attivate subiscono alcune restrizioni derivanti dalla loro instabilità e dalla limitata portata di reazione dell’apertura dell’anello. D’altra parte, le aziridine che portano sostituenti che donano elettroni, come i gruppi alchilici o alchilici sostituiti, all’anello azoto chiamato “non attivato”4, sono relativamente stabili nella maggior parte delle circostanze e possono essere lasciate sul banco per lungo tempo senza una decomposizione significativa. Le reazioni nucleofile di apertura dell’anello dell’aziridina non attivata avvengono attraverso la formazione di ioni aziridinio. La maggior parte delle reazioni di apertura dell’anello aziridina e delle trasformazioni dell’anello procedono in modo altamente regiochimico. Tuttavia, pochissimi rapporti di letteratura discutono la preparazione di aziridine non attivate otticamente pure con sostituenti nelle posizioni C2 o C3 5,6.
Questo documento mostra la preparazione di successo di derivati del gruppo α-metilbenzile contenente aziridina-2-carbossilato, in particolare (-)-mentoloil (1R)-feniletilaziridina-2-carbossilati come miscela diastereomerica, dalla reazione del 2,3-dibromopropionato e (1R)-feniletilammina. Da questa miscela diastereomerica, enantiopuro (1R)-feniletil-(2R)- e (2S)-aziridina-2-carbossilati come loro esteri (-)-mentololica sono stati ottenuti in forme otticamente pure mediante ricristallizzazione selettiva da MeOH e n-pentano su scale multi-cento chili (Figura 1)7. Questi esteri (-)-mentolilici possono essere facilmente convertiti nei loro esteri etilici o metilici mediante transesterificazione in presenza di magnesio o carbonato di potassio7. Questi composti possono anche essere preparati facilmente su scala di laboratorio dalle reazioni degli alchili 2,3-dibromopropionati o del vinile triflato di α-chetoestere con 2-feniletilammina chirale seguita dalla separazione della miscela diastereomerica utilizzando la semplice cromatografia a colonna flash8.
Una volta che abbiamo enantiopura chirale aziridina-2-carbossilato, possiamo sintetizzare varie molecole bersaglio cicliche e acicliche contenenti azoto biologicamente importanti basate su trasformazioni di gruppi funzionali di carbossilato e reazioni di apertura dell’anello aziridina altamente regio– e stereoselettivo 6,9,10. La prima sintesi asimmetrica espediente è stata applicata sia per gli enantiomeri di 5, 6-diidrouracile-tipo prodotti naturali marini biemamide B e D come potenziali inibitori del TGF-β11,12. In secondo luogo, la sintesi diastereoselettiva di β-(aziridin-2-il)-β-idrossi chetoni è stata ottenuta dalla reazione aldolica di Mukaiyama di 1-(1-feniletil)-aziridina-2-carbossildeide otticamente pura e vari silani di enolo in presenza di ZnCl2, in alta resa (>82%) con stereoselettività quasi perfetta (98:2 dr) attraverso uno stato di transizione controllato dalla chelazione. Questi sono stati utilizzati per la sintesi asimmetrica degli alcaloidi epiallo-isomuscarinici 13,14,15.
Protocol
Representative Results
Discussion
Le aziridine come eterocicli a tre membri contenenti azoto hanno un enorme potenziale per le marziali di partenza sintetiche o intermedi per preparare molecole organiche ricche di azoto. Sulla base del gruppo che porta all’anello azoto, sono classificati come aziridine “attivate” e “non attivate” la cui reattività chimica e selettività sono diverse. Tuttavia, sono disponibili metodi molto limitati per preparare questa preziosa aziridina in una forma otticamente attiva.
Il protocollo in ques…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questa ricerca è stata sostenuta dalla National Research Foundation of Korea (NRF-2020R1A2C1007102 e 2021R1A5A6002803) con il Center for New Directions in Organic Synthesis e una sovvenzione HUFS 2022.
Materials
| (2R)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester, 98% | Sigma-Aldrich | 57054-0 | |
| (2S)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester | Sigma-Aldrich | 57051-6 | |
| 1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride | TCI | 424331-25 g | CAS No: 25952-53-8 |
| 1,4-Dioxane | SAMCHUN | D0654-1 kg | CAS No: 123-91-1 |
| 1-Hydroxybenzotriazole hydrate | Aldrich | 219-989-7-50 g | CAS No: 123333-53-9 |
| 2,6-Lutidine | Alfa Aesar | A10478-AP, 500 mL | CAS No: 108-48-5 |
| Acetonitrile | SAMCHUN | A0127-18 L | CAS No: 75-05-8 |
| Acetonitrile-d3 | Cambridge Isotope Laboratories, | 15G-744-25 g | CAS No: 2206-26-0 |
| Aluminum chloride hexahydrate | Aldrich | 231-208-1, 500 g | CAS No : 7784-13-6 |
| Bruker AVANCE III HD (400 MHz) spectrometer | Bruker | NA | |
| Chloroform-d | Cambridge Isotope Laboratories, | 100 g | CAS No: 865-49-6 |
| Dichloromethane | SAMCHUN | M0822-18 L | CAS No: 75-09-2 |
| Dimethyl sulfoxide-d6 | Cambridge Isotope Laboratories, | 25 g | CAS No: 2206-27-1 |
| Ethanol | EMSURE | 1009831000,1L | CAS No: 64-17-5 |
| Ethyl acetate | SAMCHUN | E0191-18 L | CAS No: 141-78-6 |
| High resolution mass spectra/MALDI-TOF/TOF Mass Spectrometry | AB SCIEX | 4800 Plus | High resolution mass spectra |
| JASCO P-2000 | JASCO | P-2000 | For optical rotation |
| Lithium aluminum hydride | TCI | L0203-100 g | CAS No: 16853-85-3 |
| L-Selectride, 1 M solution in THF | Acros | 176451000, 100 mL | CAS No: 38721-52-7 |
| Methanol | SAMCHUN | M0585-18 L | CAS No: 67-56-1 |
| N-[(9H-Fluoren-9-ylmethoxy)carbonyl]-β-alanine | TCI | F08825G-5 g | CAS No: 35737-10-1 |
| N-Ethyldiisopropylamine | Aldrich | 230-392-0, 100 mL | CAS No: 7087-68-5 |
| n-Hexane | SAMCHUN | H0114-18 L | CAS No: 110-54-3 |
| Ninhydrin | Alfa Aesar | A10409-250 g | CAS No: 485-47-2 |
| p-Anisaldehyde | aldrich | A88107-5 g | CAS No: 123-11-5 |
| Phosphomolybdic acid hydrate | TCI | P1910-100 g | CAS No: 51429-74-4 |
| Sodium azide | D.S.P | 703301-500 g | CAS No: 26628-22-8 |
| Sodium Hydride 60% dispersion in mineral oil | Sigma-Aldrich | 452912-100 G | CAS No: 7646-69-7 |
| Sodium hydroxide | DUKSAN | A31226-1 kg | CAS No: 1310-73-2 |
| Sodium sulfate | SAMCHUN | S1011-1 kg | CAS No: 7757-82-6 |
| Thin Layer Chromatography (TLC) | Merck | 100390 | |
| Tert-Butyldimethylsilyl trifluoromethanesulfonate, 98% | Aldrich | 274-102-0, 25 g | CAS NO: 69739-34-0 |
| Tetrahydrofuran | SAMCHUN | T0148-18 L | CAS No: 109-99-9 |
| Triethylethylamine | DAEJUNG | 8556-4400-1 L | CAS No: 121-44-8 |
| UV light | Korea Ace Sci | TN-4C | 254 nm |
| Zinc chloride, anhydrous, 98+% | Alfa Aesar | A16281-22100 g | CAS No : 7646-85-7 |
References
- Pitzer, K. S. Strain energies of cyclic hydrocarbons. Science. 101 (2635), 672 (1945).
- Dudev, T., Lim, C. Ring strain energies from ab initio calculations. Journal of the American Chemical Society. 120 (18), 4450-4458 (1998).
- D’hooghe, M., Ha, H. -. J. . Synthesis of 4- to 7-Membered Heterocycles by Ring Expansion. , (2016).
- Ranjith, J., Ha, H. -. J. Synthetic applications of aziridinium ions. Molecules. 26 (6), 1744 (2021).
- Sweeney, J. B. Aziridines: epoxides’ ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Stankovic, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Lee, W. K., Ha, H. -. J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Tranchant, M. J., Dalla, V., Jabin, I., Decroix, B. Reaction of vinyl triflates of α-keto esters with primary amines: efficient synthesis of aziridine carboxylates. Tetrahedron. 58 (42), 8425-8432 (2002).
- Ha, H. -. J., Jung, J. -. H., Lee, W. K. Application of regio- and stereoselective functional group transformation of chiral aziridine-2-carboxylate. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- Kim, Y., et al. Preparation of 2,3-diaminopropionate from ring opening of aziridine-2-carboxylate. Tetrahedron Letters. 46 (25), 4407-4409 (2005).
- Srivastava, N., Macha, L., Ha, H. -. J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Zhang, F., et al. Biemamides A-E, inhibitors of the TGF-β pathway that block the epithelial to mesenchymal transition. Organic Letters. 20 (18), 5529-5532 (2018).
- Srivastava, N., Ha, H. -. J. Highly efficient and stereoselective Mukaiyama Aldol reaction with chiral aziridine-2-carboxaldehyde and its synthetic applications. Asian Journal of Organic Chemistry. 11 (1), 2021005671 (2021).
- Kempter, I., et al. Synthesis and structural characterization of the isomuscarines. Tetrahedron. 70 (10), 1918-1927 (2014).
- Pirrrung, M. C., DeAmicis, C. V. Total synthesis of the muscarines. Tetrahedron Letters. 29 (2), 159-162 (1988).

