Preparación de aziridinas no activadas enantiopure y síntesis de biemamida B, D y epiallo-isomuscarina
Summary
En este estudio, preparamos ambos enantiómeros de aziridina-2-carboxilato, que se utilizan en la síntesis asimétrica de alcaloides, incluyendo biemamida B y D, y (-)-epiallo-isomuscarina.
Abstract
Las aziridinas heterociclos que contienen nitrógeno son sintéticamente muy valiosas para la preparación de moléculas azacíclicas y acíclicas. Sin embargo, es muy difícil y laborioso hacer aziridinas en formas ópticamente puras a gran escala para aplicar la síntesis asimétrica de compuestos aza. Afortunadamente, logramos con éxito tanto los enantiómeros (2R)- como (2S)-aziridina-2-carboxilatos con el grupo α-metilbencil donante de electrones en el anillo de nitrógeno como aziridinas no activadas. Estas aziridinas iniciales tienen dos grupos funcionales distintos: anillo de tres miembros altamente reactivo y carboxilato versátil. Son aplicables en la apertura del anillo o la transformación del anillo con aziridina y en la transformación del grupo funcional a otros a partir del carboxilato. Ambos enantiómeros se utilizaron en la preparación de compuestos amino acíclicos y/o aza-heterocíclicos biológicamente importantes de manera asimétrica. Específicamente, este informe describe la primera síntesis asimétrica conveniente de ambos enantiómeros de 5, productos naturales marinos de tipo 6-dihidrouracilo biemamida B y D como posibles inhibidores de TGF-β. Esta síntesis consistió en la reacción de apertura de anillo regio- y estereoselectiva de aziridina-2-carboxilato y la posterior formación de 4-aminoteterahidropirimidina-2,4-diona. Un ejemplo más en este protocolo trató una reacción de Mukaiyama altamente estereoselectiva de aziridina-2-carboxilato y silil enol éter, después de la apertura del anillo intramolecular de aziridina para proporcionar un acceso fácil y fácil a (-)-epiallo-isomuscarina.
Introduction
Pequeños anillos que consisten en ciclopropanos, oxiranos y aziridinas se encuentran en varios compuestos como productos naturales y medicamentos 1,2. Se utilizan principalmente como materiales de partida que explotan su cepa de anillo. Entre los compuestos de tres anillos, la aziridina se ha estudiado menos extensamente debido a su inestabilidad y reactividad incontrolable3. Como se muestra en los mapas de potencial electrostático (Figura 1), un grupo unido al anillo de aziridina-nitrógeno, ya sea donante de electrones o atraídor de electrones, hace que la basicidad del nitrógeno sea diferente. Esta diferencia proporciona un contraste sorprendente con la reactividad y selectividad de las aziridinas correspondientes.
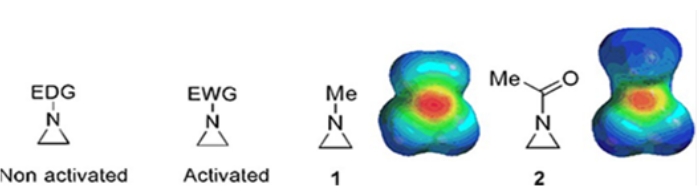
Figura 1: Estructuras químicas de aziridinas “activadas” y “no activadas” y mapas de potencial electrostático de sus ejemplos representativos N-metilaziridina y N-acetilaziridina4. Esta cifra ha sido modificada con permiso de Ranjith et al.4. Haga clic aquí para ver una versión más grande de esta figura.
Cuando el anillo de nitrógeno tiene un grupo de extracción de electrones, como sulfonato, fosfonato y carbamato, lo llamamos aziridina “activada”. Esto es fácilmente reactivo con nucleófilos para compensar su inestabilidad con un alcance limitado de regioquímica. Estas aziridinas activadas se preparan a través de varios métodos catalíticos y se utilizan como material de partida. Gran parte de la química reciente de la aziridina se ha ocupado de estas aziridinas activadas. Sin embargo, las aziridinas activadas sufren ciertas restricciones resultantes de su inestabilidad y alcance de reacción limitado de la apertura del anillo. Por otro lado, las aziridinas que llevan sustituyentes donantes de electrones, como el alquilo o los grupos alquilo sustituidos, en el anillo de nitrógeno llamado “no activado”4, son relativamente estables en la mayoría de las circunstancias y pueden dejarse en el banco durante mucho tiempo sin una descomposición significativa. Las reacciones nucleófilas de apertura de anillo de la aziridina no activada ocurren a través de la formación de iones aziridinio. La mayoría de las reacciones de apertura de anillos de aziridina y transformaciones de anillos proceden de una manera altamente regioquímica. Sin embargo, muy pocos informes de la literatura discuten la preparación de aziridinas no activadas ópticamente puras con sustituyentes en las posiciones C2 o C3 5,6.
Este trabajo muestra la preparación exitosa de α-metilbencil-que contienen aziridina-2-carboxilato quiral como su mezcla diastereomérica, específicamente (-)-mentolilo (-)-feniletilaziridina-2-carboxilatos como su mezcla diastereomérica, a partir de la reacción de 2,3-dibromopropionato y (1R)-feniletilamina. A partir de esta mezcla diastereomérica, se obtuvieron enantiopios (1R)-feniletil-(2R)- y (2S)-aziridina-2-carboxilatos como sus ésteres (-)-mentolilo en formas ópticamente puras mediante recristalización selectiva de MeOH y n-pentano en escalas de varios cien kilos (Figura 1)7. Estos ésteres (-)-mentolílicos se pueden convertir fácilmente en sus ésteres etílicos o metílicos mediante transesterificación en presencia de carbonato de magnesio o potasio7. Estos compuestos también se pueden preparar fácilmente a escala de laboratorio a partir de las reacciones de alquil 2,3-dibromopropionatos o el triflato de vinilo de α-cetoster con 2-feniletilamina quiral seguido de la separación de la mezcla diastereomérica mediante cromatografía simple de columna flash8.
Una vez que tenemos aziridina-2-carboxilato quiral enantiopure, podemos sintetizar varias moléculas diana cíclicas y acíclicas que contienen nitrógeno biológicamente importantes basadas en transformaciones de grupos funcionales de carboxilato y reacciones de apertura de anillos de aziridina altamente regio- y estereoselectivas 6,9,10. La primera síntesis asimétrica conveniente se aplicó tanto para los enantiómeros de 5, 6-dihidrouracilo tipo productos naturales marinos biemamida B y D como potenciales inhibidores de TGF-β11,12. En segundo lugar, la síntesis diastereoselectiva de β-(aziridin-2-yl)-β-hidroxi cetonas se logró mediante la reacción aldol de Mukaiyama de 1-(1-feniletil)-aziridina-2-carboxaldehído ópticamente puro y varios silanos enol en presencia de ZnCl2, en alto rendimiento (>82%) con estereoselectividad casi perfecta (98:2 dr) a través de un estado de transición controlado por quelación. Estos fueron utilizados para la síntesis asimétrica de alcaloides epiallo-isomuscarinos 13,14,15.
Protocol
Representative Results
Discussion
Las aziridinas como heterociclos de tres miembros que contienen nitrógeno tienen un enorme potencial para que los marciales o intermedios sintéticos de inicio preparen moléculas orgánicas ricas en nitrógeno. Según el grupo que contiene nitrógeno en el anillo, se clasifican como aziridinas “activadas” y “no activadas” cuya reactividad química y selectividad son diferentes. Sin embargo, hay métodos muy limitados disponibles para preparar esta valiosa aziridina en una forma ópticamente activa.
<p class="jove_…Disclosures
The authors have nothing to disclose.
Acknowledgements
Esta investigación fue apoyada por la Fundación Nacional de Investigación de Corea (NRF-2020R1A2C1007102 y 2021R1A5A6002803) con el Centro de Nuevas Direcciones en Síntesis Orgánica y una Subvención HUFS 2022.
Materials
| (2R)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester, 98% | Sigma-Aldrich | 57054-0 | |
| (2S)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester | Sigma-Aldrich | 57051-6 | |
| 1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride | TCI | 424331-25 g | CAS No: 25952-53-8 |
| 1,4-Dioxane | SAMCHUN | D0654-1 kg | CAS No: 123-91-1 |
| 1-Hydroxybenzotriazole hydrate | Aldrich | 219-989-7-50 g | CAS No: 123333-53-9 |
| 2,6-Lutidine | Alfa Aesar | A10478-AP, 500 mL | CAS No: 108-48-5 |
| Acetonitrile | SAMCHUN | A0127-18 L | CAS No: 75-05-8 |
| Acetonitrile-d3 | Cambridge Isotope Laboratories, | 15G-744-25 g | CAS No: 2206-26-0 |
| Aluminum chloride hexahydrate | Aldrich | 231-208-1, 500 g | CAS No : 7784-13-6 |
| Bruker AVANCE III HD (400 MHz) spectrometer | Bruker | NA | |
| Chloroform-d | Cambridge Isotope Laboratories, | 100 g | CAS No: 865-49-6 |
| Dichloromethane | SAMCHUN | M0822-18 L | CAS No: 75-09-2 |
| Dimethyl sulfoxide-d6 | Cambridge Isotope Laboratories, | 25 g | CAS No: 2206-27-1 |
| Ethanol | EMSURE | 1009831000,1L | CAS No: 64-17-5 |
| Ethyl acetate | SAMCHUN | E0191-18 L | CAS No: 141-78-6 |
| High resolution mass spectra/MALDI-TOF/TOF Mass Spectrometry | AB SCIEX | 4800 Plus | High resolution mass spectra |
| JASCO P-2000 | JASCO | P-2000 | For optical rotation |
| Lithium aluminum hydride | TCI | L0203-100 g | CAS No: 16853-85-3 |
| L-Selectride, 1 M solution in THF | Acros | 176451000, 100 mL | CAS No: 38721-52-7 |
| Methanol | SAMCHUN | M0585-18 L | CAS No: 67-56-1 |
| N-[(9H-Fluoren-9-ylmethoxy)carbonyl]-β-alanine | TCI | F08825G-5 g | CAS No: 35737-10-1 |
| N-Ethyldiisopropylamine | Aldrich | 230-392-0, 100 mL | CAS No: 7087-68-5 |
| n-Hexane | SAMCHUN | H0114-18 L | CAS No: 110-54-3 |
| Ninhydrin | Alfa Aesar | A10409-250 g | CAS No: 485-47-2 |
| p-Anisaldehyde | aldrich | A88107-5 g | CAS No: 123-11-5 |
| Phosphomolybdic acid hydrate | TCI | P1910-100 g | CAS No: 51429-74-4 |
| Sodium azide | D.S.P | 703301-500 g | CAS No: 26628-22-8 |
| Sodium Hydride 60% dispersion in mineral oil | Sigma-Aldrich | 452912-100 G | CAS No: 7646-69-7 |
| Sodium hydroxide | DUKSAN | A31226-1 kg | CAS No: 1310-73-2 |
| Sodium sulfate | SAMCHUN | S1011-1 kg | CAS No: 7757-82-6 |
| Thin Layer Chromatography (TLC) | Merck | 100390 | |
| Tert-Butyldimethylsilyl trifluoromethanesulfonate, 98% | Aldrich | 274-102-0, 25 g | CAS NO: 69739-34-0 |
| Tetrahydrofuran | SAMCHUN | T0148-18 L | CAS No: 109-99-9 |
| Triethylethylamine | DAEJUNG | 8556-4400-1 L | CAS No: 121-44-8 |
| UV light | Korea Ace Sci | TN-4C | 254 nm |
| Zinc chloride, anhydrous, 98+% | Alfa Aesar | A16281-22100 g | CAS No : 7646-85-7 |
References
- Pitzer, K. S. Strain energies of cyclic hydrocarbons. Science. 101 (2635), 672 (1945).
- Dudev, T., Lim, C. Ring strain energies from ab initio calculations. Journal of the American Chemical Society. 120 (18), 4450-4458 (1998).
- D’hooghe, M., Ha, H. -. J. . Synthesis of 4- to 7-Membered Heterocycles by Ring Expansion. , (2016).
- Ranjith, J., Ha, H. -. J. Synthetic applications of aziridinium ions. Molecules. 26 (6), 1744 (2021).
- Sweeney, J. B. Aziridines: epoxides’ ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Stankovic, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Lee, W. K., Ha, H. -. J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Tranchant, M. J., Dalla, V., Jabin, I., Decroix, B. Reaction of vinyl triflates of α-keto esters with primary amines: efficient synthesis of aziridine carboxylates. Tetrahedron. 58 (42), 8425-8432 (2002).
- Ha, H. -. J., Jung, J. -. H., Lee, W. K. Application of regio- and stereoselective functional group transformation of chiral aziridine-2-carboxylate. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- Kim, Y., et al. Preparation of 2,3-diaminopropionate from ring opening of aziridine-2-carboxylate. Tetrahedron Letters. 46 (25), 4407-4409 (2005).
- Srivastava, N., Macha, L., Ha, H. -. J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Zhang, F., et al. Biemamides A-E, inhibitors of the TGF-β pathway that block the epithelial to mesenchymal transition. Organic Letters. 20 (18), 5529-5532 (2018).
- Srivastava, N., Ha, H. -. J. Highly efficient and stereoselective Mukaiyama Aldol reaction with chiral aziridine-2-carboxaldehyde and its synthetic applications. Asian Journal of Organic Chemistry. 11 (1), 2021005671 (2021).
- Kempter, I., et al. Synthesis and structural characterization of the isomuscarines. Tetrahedron. 70 (10), 1918-1927 (2014).
- Pirrrung, M. C., DeAmicis, C. V. Total synthesis of the muscarines. Tetrahedron Letters. 29 (2), 159-162 (1988).

