에난티오퓨어 비활성화 아지리딘의 제조 및 비에마미드 B, D, 및 에피알로-이소무스카린의 합성
Summary
이 연구에서, 우리는 비에마미드 B와 D를 포함한 알칼로이드의 비대칭 합성에 사용되는 아지리딘-2-카르복실레이트의 거울상 이성질체와 (-)-에피알로-이소무스카린을 모두 준비한다.
Abstract
질소-함유 헤테로사이클 아지리딘은 아자사이클릭 및 비사이클릭 분자의 제조에 합성적으로 매우 가치가 있다. 그러나 아자 화합물의 비대칭 합성을 적용하기 위해 대규모로 광학적으로 순수한 형태의 아지리딘을 만드는 것은 매우 어렵고 힘들다. 다행히도, 우리는 거울상 이성질체 (2R)- 및 (2S)-아지리딘-2-카르복실레이트를 모두 비활성화된 아지리딘으로서 고리 질소에서 전자-공여 α-메틸벤질기를 성공적으로 달성하였다. 이들 출발 아지리딘은 두 개의 별개의 작용기-고도로 반응성인 삼원 고리 및 다용도 카르복실레이트-를 갖는다. 이들은 아지리딘을 사용한 고리 개환 또는 고리 변형 및 카르복실레이트에서 다른 사람으로의 작용기 변형에 적용 가능합니다. 이들 거울상이성질체 둘 다는 생물학적으로 중요한 아미노 비사이클릭 및/또는 아자-헤테로시클릭 화합물의 제조에 비대칭적인 방식으로 이용되었다. 구체적으로, 이 보고서는 잠재적인 TGF-β 억제제로서 5, 6-디히드로우라실형 해양 천연물 비엠아미드 B 및 D의 거울상이성질체 둘 다의 첫 번째 편리한 비대칭 합성을 기술한다. 이 합성은 레지오- 아지리딘-2-카르복실레이트의 입체선택적 개환 반응 및 4-아미노테라하이드로피리미딘-2,4-디온의 후속 형성으로 구성되었다. 이 프로토콜의 또 다른 예는 아지리딘-2-카르복실레이트 및 실릴 에놀 에테르의 고도로 입체선택적인 무카이야마 반응을 다루었고, 이어서 분자내 아지리딘 고리-개환에 이어서 (-)-에피알로-이소무스카린에 대한 용이하고 용이한 접근을 제공한다.
Introduction
사이클로프로판, 옥시란 및 아지리딘으로 구성된 작은 고리는 천연 제품 및 약물 1,2와 같은 다양한 화합물에서 발견됩니다. 그들은 주로 그들의 고리 변형을 이용하는 출발 물질로 사용된다. 3고리 화합물 중에서, 아지리딘은 그의 불안정성과 통제할 수 없는 반응성으로 인해 덜 광범위하게 연구되어 왔다3. 정전기 전위 지도(그림 1)에서 볼 수 있듯이, 아지리딘 고리에 부착된 그룹은 전자 공여 또는 전자 유인 여부에 관계없이 질소의 염기성을 다르게 만듭니다. 이러한 차이는 상응하는 아지리딘의 반응성 및 선택성에 대한 현저한 대조를 제공한다.
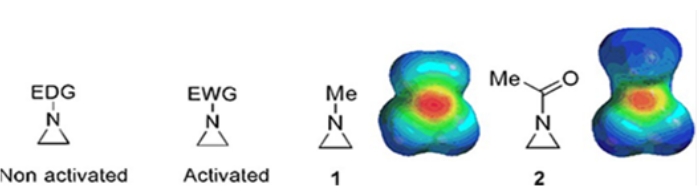
그림 1: “활성화된” 및 “비활성화된” 아지리딘의 화학 구조 및 그들의 대표적인 예인 N-메틸아지리딘 및 N-아세틸아지리딘4의 정전기적 전위 지도. 이 그림은 Ranjith et al.4의 허가를 받아 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
고리 질소가 설포네이트, 포스포네이트 및 카바메이트와 같은 전자 인출기를 가질 때, 우리는 그것을 “활성화된”아지리딘이라고 부릅니다. 이것은 제한된 범위의 위치 화학으로 그 불안정성을 보상하기 위해 친핵체와 쉽게 반응합니다. 이들 활성화된 아지리딘은 다양한 촉매 방법을 통해 제조되고 출발 물질로서 사용된다. 최근의 아지리딘 화학의 대부분은 이러한 활성화된 아지리딘을 다루었다. 그러나, 활성화된 아지리딘은 고리 개구부의 그들의 불안정성 및 제한된 반응 범위로부터 야기되는 특정 제한을 겪는다. 한편, “비활성화”4라고 불리는 고리 질소에서 알킬 또는 치환된 알킬기와 같은 전자 공여 치환기를 지닌 아지리딘은 대부분의 상황에서 비교적 안정하며 큰 분해없이 장시간 벤치에 남아있을 수 있습니다. 비활성화된 아지리딘의 친핵성 개환 반응은 아지리디늄 이온의 형성을 통해 발생한다. 아지리딘 개환 및 고리 변형의 대부분의 반응은 고도로 regiochemical 방식으로 진행됩니다. 그러나, C2 또는 C3 위치 5,6에서 치환기를 갖는 광학적으로 순수한 비활성화 아지리딘의 제조를 논의하는 문헌 보고서는 거의 없다.
이 논문은 2,3-디브로모프로피오네이트와 (1R)-페닐에틸아민의 반응으로부터 α-메틸벤질기 함유 키랄 아지리딘-2-카르복실레이트 유도체, 구체적으로 (-)-멘톨릴(1R)-페닐에틸아지리딘-2-카르복실레이트의 부분입체이성질체 혼합물로서의 성공적인 제조를 보여준다. 이러한 부분입체이성질체 혼합물로부터, 거울상이성질체 (1R)-페닐에틸-(2R)- 및 (2S)-아지리딘-2-카르복실레이트를 이들의 (-)-멘톨릴 에스테르로서 수백킬로 스케일 상에서 MeOH 및 n-펜탄으로부터 선택적 재결정화에 의해 광학적으로 순수한 형태로 수득하였다(도 1)7). 이들 (-)-멘톨릴 에스테르는 마그네슘 또는 탄산칼륨7의 존재 하에 에스테르 교환반응에 의해 그들의 에틸 또는 메틸 에스테르로 용이하게 전환될 수 있다. 이들 화합물은 또한 알킬 2,3-디브로모프로피오네이트 또는 α-케토에스테르의 비닐 트리플레이트와 키랄 2-페닐에틸아민의 반응으로부터 실험실 규모로 용이하게 제조될 수 있고, 이어서 간단한 플래쉬 컬럼 크로마토그래피8을 사용하여 부분입체이성질체 혼합물의 분리에 의해 제조될 수 있다.
일단 우리가 거울상 순수 키랄 아지리딘-2-카르복실레이트를 갖게 되면, 우리는 카르복실레이트와 고도로 regio- 및 입체 선택적인 아지리딘-고리 개방 반응 6,9,10의 작용기 변형에 기초하여 생물학적으로 중요한 표적 분자를 포함하는 다양한 고리형 및 비고리형 질소-함유 표적 분자를 합성할 수 있다. 첫 번째 편익 비대칭 합성은 잠재적 TGF-β 억제제11,12로서 5, 6-디히드로우라실형 해양 천연물 비엠아미드 B 및 D의 거울상이성질체 모두에 적용되었다. 둘째로, β-(아지리딘-2-일)-β-히드록시케톤의 부분입체선택적 합성은 ZnCl2의 존재 하에 광학적으로 순수한 1-(1-페닐에틸)-아지리딘-2-카르복스알데히드와 다양한 에놀실란의 무카이야마 알돌 반응에 의해 달성되었고, 킬레이트화 조절된 전이 상태를 통해 거의 완벽한 입체선택성(98:2 dr)을 갖는 고수율(>82%)로 달성되었다. 이들은 에피알로-이소무스카린 알칼로이드13,14,15의 비대칭 합성을 위해 사용되었다.
Protocol
Representative Results
Discussion
질소-함유 삼원 헤테로사이클로서의 아지리딘은 질소가 풍부한 유기 분자를 제조하기 위해 합성 출발 무술 또는 중간체에 대한 엄청난 잠재력을 갖는다. 고리 질소에서의 그룹 베어링에 기초하여, 그들은 화학적 반응성과 선택성이 다른 “활성화”및 “비 활성화”아지리딘으로 분류됩니다. 그러나, 이 귀중한 아지리딘을 광학적으로 활성인 형태로 제조하기 위해 매우 제한된 방법이 이용가능하다. </…
Disclosures
The authors have nothing to disclose.
Acknowledgements
본 연구는 한국연구재단(NRF-2020R1A2C1007102 및 2021R1A5A6002803)과 유기합성의 새로운 방향센터, 2022년 HUFS 그랜트의 지원을 받았다.
Materials
| (2R)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester, 98% | Sigma-Aldrich | 57054-0 | |
| (2S)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester | Sigma-Aldrich | 57051-6 | |
| 1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride | TCI | 424331-25 g | CAS No: 25952-53-8 |
| 1,4-Dioxane | SAMCHUN | D0654-1 kg | CAS No: 123-91-1 |
| 1-Hydroxybenzotriazole hydrate | Aldrich | 219-989-7-50 g | CAS No: 123333-53-9 |
| 2,6-Lutidine | Alfa Aesar | A10478-AP, 500 mL | CAS No: 108-48-5 |
| Acetonitrile | SAMCHUN | A0127-18 L | CAS No: 75-05-8 |
| Acetonitrile-d3 | Cambridge Isotope Laboratories, | 15G-744-25 g | CAS No: 2206-26-0 |
| Aluminum chloride hexahydrate | Aldrich | 231-208-1, 500 g | CAS No : 7784-13-6 |
| Bruker AVANCE III HD (400 MHz) spectrometer | Bruker | NA | |
| Chloroform-d | Cambridge Isotope Laboratories, | 100 g | CAS No: 865-49-6 |
| Dichloromethane | SAMCHUN | M0822-18 L | CAS No: 75-09-2 |
| Dimethyl sulfoxide-d6 | Cambridge Isotope Laboratories, | 25 g | CAS No: 2206-27-1 |
| Ethanol | EMSURE | 1009831000,1L | CAS No: 64-17-5 |
| Ethyl acetate | SAMCHUN | E0191-18 L | CAS No: 141-78-6 |
| High resolution mass spectra/MALDI-TOF/TOF Mass Spectrometry | AB SCIEX | 4800 Plus | High resolution mass spectra |
| JASCO P-2000 | JASCO | P-2000 | For optical rotation |
| Lithium aluminum hydride | TCI | L0203-100 g | CAS No: 16853-85-3 |
| L-Selectride, 1 M solution in THF | Acros | 176451000, 100 mL | CAS No: 38721-52-7 |
| Methanol | SAMCHUN | M0585-18 L | CAS No: 67-56-1 |
| N-[(9H-Fluoren-9-ylmethoxy)carbonyl]-β-alanine | TCI | F08825G-5 g | CAS No: 35737-10-1 |
| N-Ethyldiisopropylamine | Aldrich | 230-392-0, 100 mL | CAS No: 7087-68-5 |
| n-Hexane | SAMCHUN | H0114-18 L | CAS No: 110-54-3 |
| Ninhydrin | Alfa Aesar | A10409-250 g | CAS No: 485-47-2 |
| p-Anisaldehyde | aldrich | A88107-5 g | CAS No: 123-11-5 |
| Phosphomolybdic acid hydrate | TCI | P1910-100 g | CAS No: 51429-74-4 |
| Sodium azide | D.S.P | 703301-500 g | CAS No: 26628-22-8 |
| Sodium Hydride 60% dispersion in mineral oil | Sigma-Aldrich | 452912-100 G | CAS No: 7646-69-7 |
| Sodium hydroxide | DUKSAN | A31226-1 kg | CAS No: 1310-73-2 |
| Sodium sulfate | SAMCHUN | S1011-1 kg | CAS No: 7757-82-6 |
| Thin Layer Chromatography (TLC) | Merck | 100390 | |
| Tert-Butyldimethylsilyl trifluoromethanesulfonate, 98% | Aldrich | 274-102-0, 25 g | CAS NO: 69739-34-0 |
| Tetrahydrofuran | SAMCHUN | T0148-18 L | CAS No: 109-99-9 |
| Triethylethylamine | DAEJUNG | 8556-4400-1 L | CAS No: 121-44-8 |
| UV light | Korea Ace Sci | TN-4C | 254 nm |
| Zinc chloride, anhydrous, 98+% | Alfa Aesar | A16281-22100 g | CAS No : 7646-85-7 |
References
- Pitzer, K. S. Strain energies of cyclic hydrocarbons. Science. 101 (2635), 672 (1945).
- Dudev, T., Lim, C. Ring strain energies from ab initio calculations. Journal of the American Chemical Society. 120 (18), 4450-4458 (1998).
- D’hooghe, M., Ha, H. -. J. . Synthesis of 4- to 7-Membered Heterocycles by Ring Expansion. , (2016).
- Ranjith, J., Ha, H. -. J. Synthetic applications of aziridinium ions. Molecules. 26 (6), 1744 (2021).
- Sweeney, J. B. Aziridines: epoxides’ ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Stankovic, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Lee, W. K., Ha, H. -. J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Tranchant, M. J., Dalla, V., Jabin, I., Decroix, B. Reaction of vinyl triflates of α-keto esters with primary amines: efficient synthesis of aziridine carboxylates. Tetrahedron. 58 (42), 8425-8432 (2002).
- Ha, H. -. J., Jung, J. -. H., Lee, W. K. Application of regio- and stereoselective functional group transformation of chiral aziridine-2-carboxylate. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- Kim, Y., et al. Preparation of 2,3-diaminopropionate from ring opening of aziridine-2-carboxylate. Tetrahedron Letters. 46 (25), 4407-4409 (2005).
- Srivastava, N., Macha, L., Ha, H. -. J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Zhang, F., et al. Biemamides A-E, inhibitors of the TGF-β pathway that block the epithelial to mesenchymal transition. Organic Letters. 20 (18), 5529-5532 (2018).
- Srivastava, N., Ha, H. -. J. Highly efficient and stereoselective Mukaiyama Aldol reaction with chiral aziridine-2-carboxaldehyde and its synthetic applications. Asian Journal of Organic Chemistry. 11 (1), 2021005671 (2021).
- Kempter, I., et al. Synthesis and structural characterization of the isomuscarines. Tetrahedron. 70 (10), 1918-1927 (2014).
- Pirrrung, M. C., DeAmicis, C. V. Total synthesis of the muscarines. Tetrahedron Letters. 29 (2), 159-162 (1988).

