ज़ेब्राफ़िश में कशेरुकी विभाजन का अध्ययन करने के लिए एक 3-डी टेल एक्सप्लांट संस्कृति
Summary
यहां, हम जेब्राफिश पीछे शरीर धुरी के 3-डी ऊतक संस्कृति के लिए प्रोटोकॉल प्रस्तुत करते हैं, जो कशेरुकी विभाजन के लाइव अध्ययन को सक्षम करता है। यह एक्सप्लांट मॉडल अक्ष विस्तार, मॉर्फोजेन स्रोतों में परिवर्तन, और उपकोशिकीय रिज़ॉल्यूशन ऊतक-स्तर लाइव इमेजिंग पर नियंत्रण प्रदान करता है।
Abstract
कशेरुकी भ्रूण उनके प्रमुख शरीर धुरी को दोहराव वाले सोमाइट्स, कशेरुकी, मांसपेशियों और त्वचा के अग्रदूतों के रूप में पैटर्न करते हैं। सोमाइट्स उत्तरोत्तर प्रीसॉमिटिक मेसोडर्म (पीएसएम) से खंडित होते हैं क्योंकि भ्रूण के पूंछ अंत में पीछे की ओर बढ़ जाता है। सोमाइट्स नियमित समय-समय पर और आकार में पैमाने के साथ बनाते हैं। ज़ेब्राफ़िश एक लोकप्रिय मॉडल जीव है क्योंकि यह आनुवंशिक रूप से ट्रैक करने योग्य है और इसमें पारदर्शी भ्रूण हैं जो लाइव इमेजिंग के लिए अनुमति देते हैं। फिर भी, सोमितोजेनेसिस के दौरान, मछली भ्रूण एक बड़े, गोलाई जर्दी के चारों ओर लपेटा जाता है। यह ज्यामिति जेब्राफिश भ्रूण में पीएसएम ऊतक की लाइव इमेजिंग को सीमित करती है, विशेष रूप से उच्च संकल्पों पर जिसके लिए एक करीबी उद्देश्य काम करने की दूरी की आवश्यकता होती है। यहां, हम जेब्राफिश पूंछ के एक्सप्लांट की लाइव इमेजिंग के लिए एक चपटा 3-डी ऊतक संस्कृति विधि पेश करते हैं। पूंछ एक्सप्लांट अक्ष विस्तार की आनुपातिक मंदी और रोस्ट्रोकाउडल सोमाइट लंबाई को छोटा करके अक्षुण्ण भ्रूण की नकल करते हैं। हम आगे एक्सप्लांट संस्कृति के माध्यम से धुरी विस्तार गति को स्टाल करने में सक्षम हैं। यह, पहली बार, हमें अक्षीय विस्तार के यंत्रवादी इनपुट से संकेत ढाल के रासायनिक इनपुट को सुलझाने में सक्षम बनाता है। भविष्य के अध्ययनों में, इस विधि को माइक्रोफ्लुइडिक सेटअप के साथ जोड़ा जा सकता है ताकि समय-नियंत्रित दवा क्षोभ या कशेरुकी विभाजन की स्क्रीनिंग को बिना किसी दवा प्रवेश चिंताओं के अनुमति दी जा सके।
Introduction
जीवों के मेटामेरिक विभाजन का व्यापक रूप से प्रकृति में उपयोग किया जाता है। शरीर की योजना1में कशेरुकी, मांसपेशियों, नसों, जहाजों, अंगों या पत्तियों जैसे पार्श्व अंगों की कार्यक्षमता के लिए बार-बार संरचनाएं आवश्यक हैं। अक्षीय सममता की ऐसी शारीरिक और ज्यामितीय बाधाओं के परिणामस्वरूप, बिलातेरिया के अधिकांश फायला- जैसे एनेलिड्स, आर्थ्रोपोड्स, और तार-प्रदर्शन उनके भ्रूणीय ऊतकों (जैसे,ेक्टोडर्म, मेसोडर्म) एंटेरो-पीछे।
कशेरुकी भ्रूण क्रमिक रूप से प्रमुख शरीर धुरी के साथ अपने पैराक्सियल मेसोडर्म को प्रजातियों-विशिष्ट अंतराल, गिनती और आकार वितरण के साथ सोमाइट्स में खंडित करते हैं। एक प्रजाति के भीतर व्यक्तिगत भ्रूण के बीच इतनी मजबूती के बावजूद, सोमाइट विभाजन कशेरुकी प्रजातियों के बीच में बहुमुखी है । विभाजन समय अंतराल के एक विशाल शासन में होता है (जेब्राफिश में 25 मिनट से मनुष्यों में 5 घंटे तक), आकार (जेब्राफिश की पूंछ सोमाइट्स में ~ 20 माइक्रोन से चूहों के ट्रंक सोलाइट्स में ~ 200 माइक्रोन) और मायने रखता है (जेब्राफिश में 32 से मकई सांपों में ~ 300 तक)2. इससे भी दिलचस्प बात यह है कि मछली भ्रूण तापमान की एक विस्तृत श्रृंखला में विकसित हो सकते हैं (जेब्राफिश के लिए ~ 20.5 डिग्री सेल्सियस से 34 डिग्री सेल्सियस तक) जबकि दोनों विभाजन अंतराल और अक्षीय विस्तार गति के लिए क्षतिपूर्ति करके उचित आकार वितरण के साथ अपनी सोमाइट्स को बरकरार रखते हैं। इस तरह की दिलचस्प विशेषताओं से परे, ज़ेब्राफ़िश सहोदर भ्रूण के साथ-साथ उनके सुलभ आनुवंशिक उपकरणों के बाहरी, समकालिक और पारदर्शी विकास के कारण कशेरुकी में विभाजन का अध्ययन करने के लिए एक उपयोगी मॉडल जीव के रूप में रहता है। एक माइक्रोस्कोपी के नजरिए से प्रतिकूल रूप से, टेलीओस्ट भ्रूण एक भारी गोलाकार जर्दी पर विकसित होते हैं, इसके चारों ओर गैस्ट्रूटिंग ऊतक को खींचते हैं और गोलाई करतेहैं (चित्रा 1A)। इस लेख में, हम जेब्राफिश पूंछ के लिए एक चपटा 3-डी ऊतक एक्सप्लांट संस्कृति पेश करते हैं। यह एक्सप्लांट सिस्टम जर्दी द्रव्यमान की गोलाकार बाधाओं को दरकिनार करता है, जिससे सोमाइट पैटर्निंग के लिए मछली भ्रूण के उच्च संकल्प लाइव इमेजिंग तक पहुंच की अनुमति होती है।
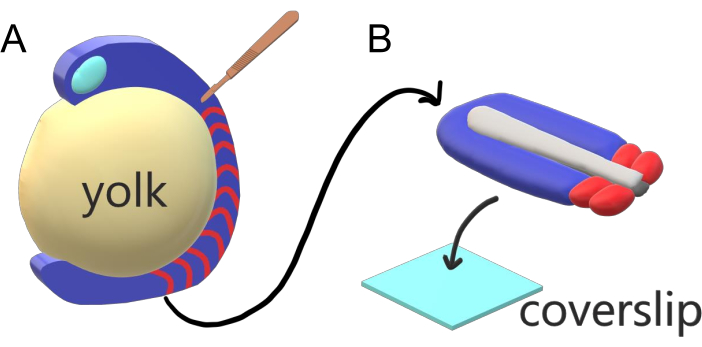
चित्रा 1:जेब्राफिश भ्रूण के लिए स्लाइड चैंबर एक्सप्लांट सिस्टम। (A)जेब्राफिश भ्रूण लाइव इमेजिंग के लिए फायदे हैं, जैसे गैस्ट्रूटिंग भ्रूणीय ऊतक (नीला) की पारदर्शिता, लेकिन ऊतक एक भारी गोलाकार जर्दी द्रव्यमान (पीला) के आसपास बनता है जो अक्षुण्ण भ्रूण में निकट उद्देश्य, उच्च-संकल्प इमेजिंग को रोकता है। पूंछ एक्सप्लांट्स को माइक्रोसर्जिकल चाकू (भूरे रंग) से शुरू किया जा सकता है जो सोमाइट्स (लाल) के ऊतक पूर्वकाल से काटा जाता है और पीछे की जर्दी के साथ सीमा पर जारी रहता है। (ख)विच्छेदित पूंछ के एक्सप्लांट्स को कवरस्लिप (हल्के नीले) डोरसोवेंट्रली पर रखा जा सकता है; तंत्रिका ऊतक (हल्के भूरे) को शीर्ष पर और नीचे नोटोकॉर्ड (डार्क ग्रे) रखना। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
Protocol
Representative Results
Discussion
यह लेख एक ऊतक संस्कृति एक्सप्लांट तकनीक का एक विस्तृत प्रोटोकॉल प्रस्तुत करता है जिसे हमने हाल ही में जेब्राफिश भ्रूण के लिएविकसित और उपयोग किया है। हमारी तकनीक लड़की 8 और जेब्राफिश9,</sup…
Disclosures
The authors have nothing to disclose.
Acknowledgements
हम मछली के रखरखाव के लिए AECOM ज़ेब्राफ़िश कोर सुविधा और सिनसिनाटी बच्चों की पशु चिकित्सा सेवाओं, तकनीकी सहायता के लिए सिनसिनाटी बच्चों की इमेजिंग कोर, वीडियो उत्पादन के साथ सहायता के लिए दीदार सप्रोव और पांडुलिपि संपादन के लिए हन्ना सीवॉल का शुक्रिया अदा करते हैं । इस प्रकाशन में रिपोर्ट किए गए शोध को राष्ट्रीय स्वास्थ्य संस्थानों के राष्ट्रीय सामान्य चिकित्सा विज्ञान संस्थान द्वारा पुरस्कार संख्या R35GM140805 से ई.M.Ö के तहत समर्थित किया गया था । सामग्री पूरी तरह से लेखकों की जिम्मेदारी है और जरूरी नहीं कि स्वास्थ्य के राष्ट्रीय संस्थानों के आधिकारिक विचारों का प्रतिनिधित्व करता है ।
Materials
| 1 mL Sub-Q Syringe with PrecisionGlide Needle | Becton, Dickinson and Co. | REF 309597 | for dechorionating embryos and manipulations |
| 200 Proof Ethanol, Anhydrous | Decon Labs | 2701 | for immunostaining |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | for tissue dissection media |
| Calcium Chloride Anhydrous, Powder | Sigma-Aldrich | 499609 | for tissue dissection media |
| Dimethylsulfoxide | Sigma-Aldrich | D5879 | for immunostaining |
| Disposable Scalpel, #10 Stainless Steel | Integra-Miltex | MIL4-411 | for preparing tape slide wells |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | 886-86-2 | (optional) for anesthesizing tissues older than 20 somites stage |
| Fetal Bovine Serum (FBS) | ThermoFisher | A3160601 | additional for tissue culture media |
| Goat anti-Mouse IgG2b, Alexa Fluor 594 | Invitrogen | Cat#A-21145; RRID: AB_2535781 | secondary antibody for immunostaining |
| L-15 Medium with L-Glutamine w/o Phenol Red | GIBCO | 21083-027 | for tissue dissection media |
| Methanol | Sigma-Aldrich | 179337 | for immunostaining |
| Microsurgical Corneal Knife 2.85 mm Angled Tip Double Bevel Blade | Surgical Specialties | 72-2863 | for tissue dissection |
| Mouse monoclonal anti-ppERK | Sigma-Aldrich | Cat#M8159; RRID:AB_477245 | for ppERK immunostaining |
| NucRed Live 647 ReadyProbes Reagent | Invitrogen | R37106 | (optional) for live staining of cell nuclei |
| Paraformaldehyde Powder, 95% | Sigma-Aldrich | 158127 | for fixation of samples for immunostaining |
| Rat Tail Collagen Coating Solution | Sigma-Aldrich | 122-20 | (optional) for chemically activating slide chambers |
| Stage Top Incubator | Tokai Hit | tokai-hit-stxg | (optional) for temperature control during live imaging |
| Transparent Tape 3/4'' | Scotch | S-9782 | for preparing tape slide wells |
| Triton X-100 | Sigma-Aldrich | X100 | for immunostaining |
| Tween 20 | Sigma-Aldrich | P1379 | for immunostaining |
| Zebrafish: Tg(actb2:2xMCP-NLS-EGFP) | Campbell et al., 2015 | ZFIN: ZDB-TGCONSTRCT-150624-4 | transgenic fish with nuclear localized EGFP |
| Zebrafish: Tg(Ola.Actb:Hsa.HRAS-EGFP) | Cooper et al., 2005 | ZFIN: ZDB-TGCONSTRCT-070117-75 | transgenic fish with cell membrane localized EGFP |
References
- Assheton, R. . Growth in length: Embryological Essays. , (1916).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454 (7202), 335-339 (2008).
- Westerfield, M. . The Zebrafish Book: a guide for the laboratory use of zebrafish (Danio rerio), 3rd edition. , (1995).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (1700003), (2017).
- Simsek, M. F., Ozbudak, E. M. Spatial fold change of Fgf signaling encodes positional information for segmental determination in zebrafish. Cell Reports. 24 (1), 66-78 (2018).
- Dubrulle, J., Pourquié, O. fgf8 mRNA decay establishes a gradient that couples axial elongation to patterning in the vertebrate embryo. Nature. 427 (6973), 419-422 (2004).
- Diez del Corral, R., et al. Opposing FGF and Retinoid Pathways Control Ventral Neural Pattern, Neuronal Differentiation, and Segmentation during Body Axis Extension. Neuron. 40 (1), 65-79 (2003).
- Stern, H. M., Hauschka, S. D. Neural tube and notochord promote in vitro myogenesis in single somite explants. Developmental Biology. 167 (1), 87-103 (1995).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics. 228 (3), 464-474 (2003).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in molecular biology. 546 (11), 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Developmental Biology. 406 (2), 172-185 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).

