Un cultivo de explantes de cola 3-D para estudiar la segmentación de vertebrados en el pez cebra
Summary
Aquí, presentamos el protocolo para el cultivo de tejidos 3-D del eje posterior del cuerpo del pez cebra, lo que permite el estudio en vivo de la segmentación de vertebrados. Este modelo de explant proporciona control sobre el alargamiento del eje, alteración de las fuentes de morfógenos y obtención de imágenes vivas a nivel de tejido de resolución subcelular.
Abstract
Los embriones de vertebrados modelan su eje corporal principal como somitas repetitivas, los precursores de las vértebras, los músculos y la piel. Las somitas se segmentan progresivamente desde el mesodermo presomático (PSM) a medida que el extremo de la cola del embrión se alarga posteriormente. Los somitas se forman con periodicidad regular y escala en tamaño. El pez cebra es un organismo modelo popular, ya que es genéticamente manejable y tiene embriones transparentes que permiten obtener imágenes vivas. Sin embargo, durante la somitogénesis, los embriones de peces se envuelven alrededor de una yema grande y redondeada. Esta geometría limita las imágenes vivas de tejido PSM en embriones de pez cebra, particularmente a resoluciones más altas que requieren una distancia de trabajo objetiva cercana. Aquí, presentamos un método aplanado de la cultura del tejido de 3-D para la proyección de imagen viva de los explantes de la cola del pez cebra. Los explantes de cola imitan los embriones intactos mostrando una desaceleración proporcional de la elongación del eje y el acortamiento de las longitudes de somita rostrocaudal. Además, somos capaces de detener la velocidad de elongación del eje a través del cultivo de explantes. Esto, por primera vez, nos permite desenredar la entrada química de los gradientes de señalización de la entrada mecanicista de la elongación axial. En estudios futuros, este método se puede combinar con una configuración microfluídica para permitir perturbaciones farmacéuticas controladas por el tiempo o la detección de la segmentación de vertebrados sin ningún problema de penetración de fármacos.
Introduction
La segmentación metamérica de organismos es ampliamente utilizada en la naturaleza. Las estructuras repetidas son esenciales para la funcionalidad de órganos laterales como vértebras, músculos, nervios, vasos, extremidades u hojas en un plan corporal1. Como resultado de tales restricciones fisiológicas y geométricas de la simetría axial, la mayoría de los filos de Bilateria-tales como anélidos, artrópodos, y cordados-exhiben la segmentación de sus tejidos embrionarios (e.g., ectodermo, mesodermo) antero-posteriorly.
Los embriones de vertebrados segmentan secuencialmente su mesodermo paraxial a lo largo del eje principal del cuerpo en somitas con intervalos específicos de la especie, recuentos y distribuciones de tamaño. A pesar de tal robustez entre embriones individuales dentro de una especie, la segmentación de somita es versátil entre las especies de vertebrados. La segmentación ocurre en un vasto régimen de intervalos de tiempo (de 25 min en el pez cebra a 5 h en humanos), tamaños (de ~20 μm en somitas de cola de pez cebra a ~200 μm en somites de tronco de ratones) y recuentos (de 32 en pez cebra a ~300 en serpientes de maíz)2. Más interesante aún, los embriones de peces pueden desarrollarse en un amplio rango de temperaturas (desde ~ 20.5 ° C hasta 34 ° C para el pez cebra) mientras mantienen sus somitas intactas con distribuciones de tamaño adecuadas al compensar tanto los intervalos de segmentación como las velocidades de elongación axial. Más allá de estas interesantes características, el pez cebra se mantiene como un organismo modelo útil para estudiar la segmentación en vertebrados debido al desarrollo externo, síncrono y transparente de una plenitud de embriones hermanos, así como sus herramientas genéticas accesibles. Negativamente desde una perspectiva de microscopía, los embriones de teleósteo se desarrollan en una yema esférica voluminosa, estirando y redondeando el tejido gastrulante a su alrededor (Figura 1A). En este artículo, presentamos un cultivo de explantes de tejido 3-D aplanado para colas de pez cebra. Este sistema de explantes evita las restricciones esféricas de la masa de yema, lo que permite el acceso a imágenes vivas de alta resolución de embriones de peces para el modelado de somita.
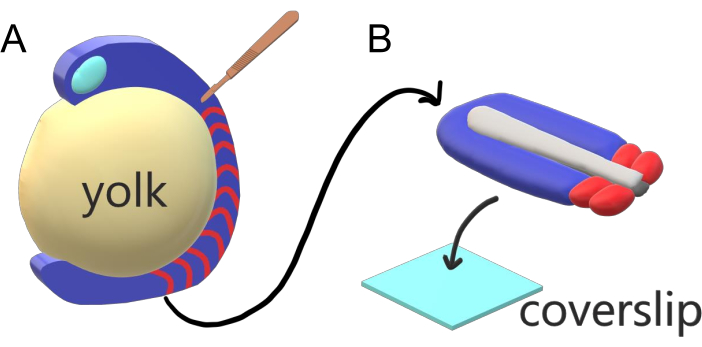
Figura 1:Sistema de explante de cámara deslizante para embriones de pez cebra. (A) Los embriones de pez cebra tienen ventajas para la obtención de imágenes vivas, como la transparencia del tejido embrionario gastrulado (azul), pero el tejido se forma alrededor de una masa de yema esférica voluminosa (amarillo) que impide obtener imágenes casi objetivas y de alta resolución en embriones intactos. Los explantes de cola se pueden diseccionar comenzando con un cuchillo microquirúrgico (marrón) cortado del tejido anterior de somitas (rojo) y continuando en el borde con la yema posterior. (B) Los explantes de cola disecados pueden colocarse en un cubrebocas (azul claro) dorsoventralmente; mantener el tejido neural (gris claro) en la parte superior y la notocorda (gris oscuro) en la parte inferior. Haga clic aquí para ver una versión más amplia de esta figura.
Protocol
Representative Results
Discussion
Este artículo presenta un protocolo detallado de una técnica del explant de la cultura del tejido que desarrollamos y utilizamos recientemente5 para los embriones del pez cebra. Nuestra técnica se basa en los métodos de explantación anteriores en el polluelo8 y el pez cebra9,10,11 organismos modelo. Los explantes de cola preparados con este protocolo pueden sobrevivir hasta >1…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos a la AECOM Zebrafish Core Facility y Cincinnati Children’s Veterinary Services por el mantenimiento de peces, al Cincinnati Children’s Imaging Core por la asistencia técnica, a Didar Saparov por la asistencia con la producción de video y a Hannah Seawall por editar el manuscrito. La investigación reportada en esta publicación fue apoyada por el Instituto Nacional de Ciencias Médicas Generales de los Institutos Nacionales de Salud bajo el Número de Premio R35GM140805 a E.M.Ö. El contenido es responsabilidad exclusiva de los autores y no representa necesariamente los puntos de vista oficiales de los Institutos Nacionales de Salud.
Materials
| 1 mL Sub-Q Syringe with PrecisionGlide Needle | Becton, Dickinson and Co. | REF 309597 | for dechorionating embryos and manipulations |
| 200 Proof Ethanol, Anhydrous | Decon Labs | 2701 | for immunostaining |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | for tissue dissection media |
| Calcium Chloride Anhydrous, Powder | Sigma-Aldrich | 499609 | for tissue dissection media |
| Dimethylsulfoxide | Sigma-Aldrich | D5879 | for immunostaining |
| Disposable Scalpel, #10 Stainless Steel | Integra-Miltex | MIL4-411 | for preparing tape slide wells |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | 886-86-2 | (optional) for anesthesizing tissues older than 20 somites stage |
| Fetal Bovine Serum (FBS) | ThermoFisher | A3160601 | additional for tissue culture media |
| Goat anti-Mouse IgG2b, Alexa Fluor 594 | Invitrogen | Cat#A-21145; RRID: AB_2535781 | secondary antibody for immunostaining |
| L-15 Medium with L-Glutamine w/o Phenol Red | GIBCO | 21083-027 | for tissue dissection media |
| Methanol | Sigma-Aldrich | 179337 | for immunostaining |
| Microsurgical Corneal Knife 2.85 mm Angled Tip Double Bevel Blade | Surgical Specialties | 72-2863 | for tissue dissection |
| Mouse monoclonal anti-ppERK | Sigma-Aldrich | Cat#M8159; RRID:AB_477245 | for ppERK immunostaining |
| NucRed Live 647 ReadyProbes Reagent | Invitrogen | R37106 | (optional) for live staining of cell nuclei |
| Paraformaldehyde Powder, 95% | Sigma-Aldrich | 158127 | for fixation of samples for immunostaining |
| Rat Tail Collagen Coating Solution | Sigma-Aldrich | 122-20 | (optional) for chemically activating slide chambers |
| Stage Top Incubator | Tokai Hit | tokai-hit-stxg | (optional) for temperature control during live imaging |
| Transparent Tape 3/4'' | Scotch | S-9782 | for preparing tape slide wells |
| Triton X-100 | Sigma-Aldrich | X100 | for immunostaining |
| Tween 20 | Sigma-Aldrich | P1379 | for immunostaining |
| Zebrafish: Tg(actb2:2xMCP-NLS-EGFP) | Campbell et al., 2015 | ZFIN: ZDB-TGCONSTRCT-150624-4 | transgenic fish with nuclear localized EGFP |
| Zebrafish: Tg(Ola.Actb:Hsa.HRAS-EGFP) | Cooper et al., 2005 | ZFIN: ZDB-TGCONSTRCT-070117-75 | transgenic fish with cell membrane localized EGFP |
References
- Assheton, R. . Growth in length: Embryological Essays. , (1916).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454 (7202), 335-339 (2008).
- Westerfield, M. . The Zebrafish Book: a guide for the laboratory use of zebrafish (Danio rerio), 3rd edition. , (1995).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (1700003), (2017).
- Simsek, M. F., Ozbudak, E. M. Spatial fold change of Fgf signaling encodes positional information for segmental determination in zebrafish. Cell Reports. 24 (1), 66-78 (2018).
- Dubrulle, J., Pourquié, O. fgf8 mRNA decay establishes a gradient that couples axial elongation to patterning in the vertebrate embryo. Nature. 427 (6973), 419-422 (2004).
- Diez del Corral, R., et al. Opposing FGF and Retinoid Pathways Control Ventral Neural Pattern, Neuronal Differentiation, and Segmentation during Body Axis Extension. Neuron. 40 (1), 65-79 (2003).
- Stern, H. M., Hauschka, S. D. Neural tube and notochord promote in vitro myogenesis in single somite explants. Developmental Biology. 167 (1), 87-103 (1995).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics. 228 (3), 464-474 (2003).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in molecular biology. 546 (11), 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Developmental Biology. 406 (2), 172-185 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).

