Een 3D Tail Explant-cultuur om gewervelde segmentatie bij zebravissen te bestuderen
Summary
Hier presenteren we het protocol voor 3D-weefselkweek van de achterste lichaamsas van zebravissen, waardoor live studie van gewervelde segmentatie mogelijk is. Dit explantmodel biedt controle over de verlenging van de as, wijziging van morfogene bronnen en live beeldvorming op weefselniveau op subcellulair resolutieniveau.
Abstract
Gewervelde embryo’s patroon hun belangrijkste lichaamsas als repetitieve somieten, de voorlopers van wervels, spieren en huid. Somieten segmenteren geleidelijk van het presomitische mesoderm (PSM) terwijl het staarteinde van het embryo achterstedig verlengt. Somieten vormen zich met regelmatige periodiciteit en schaal in grootte. Zebravis is een populair modelorganisme omdat het genetisch tracteerbaar is en transparante embryo’s heeft die levende beeldvorming mogelijk maken. Niettemin worden tijdens somitogenese visembryo’s om een grote, rondende dooier gewikkeld. Deze geometrie beperkt de levende beeldvorming van PSM-weefsel in zebravisembryo’s, met name bij hogere resoluties die een nauwe objectieve werkafstand vereisen. Hier presenteren we een afgeplatte 3D-weefselkweekmethode voor levende beeldvorming van zebravisstaart explants. Staart explants bootsen intacte embryo’s na door een proportionele vertraging van de verlenging van de as en verkorting van rostrocaudal somietlengtes. We zijn verder in staat om de verlengingssnelheid van de as door de explantcultuur te vertragen. Dit stelt ons voor het eerst in staat om de chemische input van signaalgradiënten te ontwarren uit de mechanistische input van axiale rek. In toekomstige studies kan deze methode worden gecombineerd met een microfluïdische opstelling om tijdgestuurde farmaceutische verstoringen of screening van gewervelde gewervelde segmentatie mogelijk te maken zonder problemen met de penetratie van geneesmiddelen.
Introduction
Metamerische segmentatie van organismen wordt veel gebruikt in de natuur. Herhaalde structuren zijn essentieel voor de functionaliteit van laterale organen zoals wervels, spieren, zenuwen, bloedvaten, ledematen of bladeren in een lichaamsplan1. Als gevolg van dergelijke fysiologische en geometrische beperkingen van de axiale symmetrie, de meeste phyla van Bilateria-zoals anneliden, geleedpotigen, en chordaten-vertonen segmentatie van hun embryonale weefsels (bijv. ectoderm, mesoderm) antero-posteriorly.
Gewervelde embryo’s segmenteren hun paraxiale mesoderm langs de hoofdas van het lichaam achtereenvolgens in somieten met soortspecifieke intervallen, tellingen en grootteverdelingen. Ondanks deze robuustheid tussen individuele embryo’s binnen een soort, is somietsegmentatie veelzijdig tussen gewervelde soorten. Segmentatie vindt plaats in een uitgebreid regime van tijdsintervallen (van 25 min in zebravissen tot 5 uur bij mensen), maten (van ~20 μm in staart somieten van zebravissen tot ~200 μm in stam somieten van muizen) en tellingen (van 32 in zebravissen tot ~300 in maïsslangen)2. Interessanter is dat visembryo’s zich kunnen ontwikkelen in een breed scala aan temperaturen (van ~ 20,5 °C tot 34 °C voor zebravissen) terwijl ze hun somieten intact houden met de juiste grootteverdelingen door zowel segmentatie-intervallen als axiale reksnelheden te compenseren. Naast dergelijke interessante kenmerken blijft zebravis een nuttig modelorganisme om segmentatie bij gewervelde dieren te bestuderen vanwege de externe, synchrone en transparante ontwikkeling van een plenitude van embryo’s van broers en zussen en hun toegankelijke genetische hulpmiddelen. Vanuit microscopieperspectief ontwikkelen teleostembryo’s zich op een omvangrijke bolvormige dooier, die het gastrulerende weefsel eromheen uitrekt en rondt (figuur 1A). In dit artikel presenteren we een afgeplatte 3D-weefsel explantcultuur voor zebravisstaarten. Dit explantsysteem omzeilt de bolvormige beperkingen van dooiermassa, waardoor toegang wordt verstondkbaar tot live beeldvorming met hoge resolutie van visembryo’s voor somietpatronen.
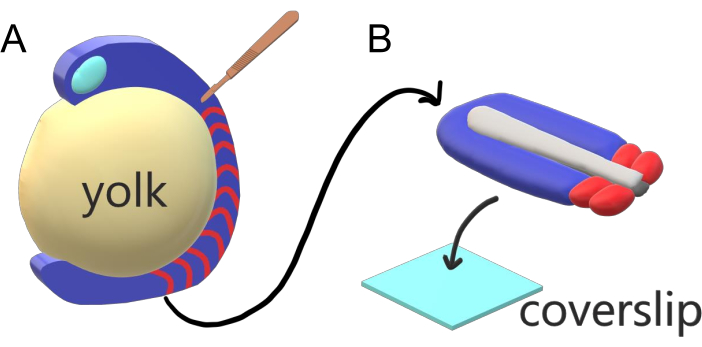
Figuur 1: Slide Chamber Explant System for Zebrafish Embryos. (A) Zebravisembryo’s hebben voordelen voor levende beeldvorming, zoals de transparantie van gastrulerend embryonaal weefsel (blauw), maar het weefsel vormt zich rond een omvangrijke bolvormige dooiermassa (geel) die beeldvorming met een hoge resolutie in intacte embryo’s voorkomt. Staart explants kunnen worden ontleed beginnend met een microchirurgische mes (bruin) gesneden uit het weefsel voorste van somieten (rood) en verder op de grens met de dooier posteriorly. (B) Ontlede staart explants kunnen op een afdeklip (lichtblauw) dorsoventrally worden geplaatst; het houden van neuraal weefsel (lichtgrijs) aan de bovenkant en notochord (donkergrijs) aan de onderkant. Klik hier om een grotere versie van deze afbeelding te bekijken.
Protocol
Representative Results
Discussion
Dit artikel presenteert een gedetailleerd protocol van een weefselkweek explant techniek die we onlangs hebben ontwikkeld en gebruikt5 voor zebravis embryo’s. Onze techniek bouwt voort op de vorige explantmethoden in kuiken8 en zebravis9,10,11 modelorganismen. Staart explants bereid met dit protocol kunnen overleven zolang >12 uur in een eenvoudige diakamer, blijven verlengen van d…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We danken de AECOM Zebrafish Core Facility en Cincinnati Children’s Veterinary Services voor visonderhoud, de Cincinnati Children’s Imaging Core voor technische bijstand, Didar Saparov voor hulp bij videoproductie en Hannah Seawall voor het bewerken van het manuscript. Onderzoek dat in deze publicatie werd gerapporteerd, werd ondersteund door het National Institute of General Medical Sciences van de National Institutes of Health onder awardnummer R35GM140805 to E.M.Ö. De inhoud valt uitsluitend onder de verantwoordelijkheid van de auteurs en vertegenwoordigt niet noodzakelijkerwijs de officiële opvattingen van de National Institutes of Health.
Materials
| 1 mL Sub-Q Syringe with PrecisionGlide Needle | Becton, Dickinson and Co. | REF 309597 | for dechorionating embryos and manipulations |
| 200 Proof Ethanol, Anhydrous | Decon Labs | 2701 | for immunostaining |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | for tissue dissection media |
| Calcium Chloride Anhydrous, Powder | Sigma-Aldrich | 499609 | for tissue dissection media |
| Dimethylsulfoxide | Sigma-Aldrich | D5879 | for immunostaining |
| Disposable Scalpel, #10 Stainless Steel | Integra-Miltex | MIL4-411 | for preparing tape slide wells |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | 886-86-2 | (optional) for anesthesizing tissues older than 20 somites stage |
| Fetal Bovine Serum (FBS) | ThermoFisher | A3160601 | additional for tissue culture media |
| Goat anti-Mouse IgG2b, Alexa Fluor 594 | Invitrogen | Cat#A-21145; RRID: AB_2535781 | secondary antibody for immunostaining |
| L-15 Medium with L-Glutamine w/o Phenol Red | GIBCO | 21083-027 | for tissue dissection media |
| Methanol | Sigma-Aldrich | 179337 | for immunostaining |
| Microsurgical Corneal Knife 2.85 mm Angled Tip Double Bevel Blade | Surgical Specialties | 72-2863 | for tissue dissection |
| Mouse monoclonal anti-ppERK | Sigma-Aldrich | Cat#M8159; RRID:AB_477245 | for ppERK immunostaining |
| NucRed Live 647 ReadyProbes Reagent | Invitrogen | R37106 | (optional) for live staining of cell nuclei |
| Paraformaldehyde Powder, 95% | Sigma-Aldrich | 158127 | for fixation of samples for immunostaining |
| Rat Tail Collagen Coating Solution | Sigma-Aldrich | 122-20 | (optional) for chemically activating slide chambers |
| Stage Top Incubator | Tokai Hit | tokai-hit-stxg | (optional) for temperature control during live imaging |
| Transparent Tape 3/4'' | Scotch | S-9782 | for preparing tape slide wells |
| Triton X-100 | Sigma-Aldrich | X100 | for immunostaining |
| Tween 20 | Sigma-Aldrich | P1379 | for immunostaining |
| Zebrafish: Tg(actb2:2xMCP-NLS-EGFP) | Campbell et al., 2015 | ZFIN: ZDB-TGCONSTRCT-150624-4 | transgenic fish with nuclear localized EGFP |
| Zebrafish: Tg(Ola.Actb:Hsa.HRAS-EGFP) | Cooper et al., 2005 | ZFIN: ZDB-TGCONSTRCT-070117-75 | transgenic fish with cell membrane localized EGFP |
References
- Assheton, R. . Growth in length: Embryological Essays. , (1916).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454 (7202), 335-339 (2008).
- Westerfield, M. . The Zebrafish Book: a guide for the laboratory use of zebrafish (Danio rerio), 3rd edition. , (1995).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (1700003), (2017).
- Simsek, M. F., Ozbudak, E. M. Spatial fold change of Fgf signaling encodes positional information for segmental determination in zebrafish. Cell Reports. 24 (1), 66-78 (2018).
- Dubrulle, J., Pourquié, O. fgf8 mRNA decay establishes a gradient that couples axial elongation to patterning in the vertebrate embryo. Nature. 427 (6973), 419-422 (2004).
- Diez del Corral, R., et al. Opposing FGF and Retinoid Pathways Control Ventral Neural Pattern, Neuronal Differentiation, and Segmentation during Body Axis Extension. Neuron. 40 (1), 65-79 (2003).
- Stern, H. M., Hauschka, S. D. Neural tube and notochord promote in vitro myogenesis in single somite explants. Developmental Biology. 167 (1), 87-103 (1995).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics. 228 (3), 464-474 (2003).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in molecular biology. 546 (11), 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Developmental Biology. 406 (2), 172-185 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).

