Zebra Balıklarında Omurgalı Segmentasyonunu İncelemek için 3-D Kuyruk Eksplant Kültürü
Summary
Burada, omurgalı segmentasyonunun canlı çalışmasını sağlayan zebra balığı arka vücut ekseninin 3 boyutlu doku kültürü protokolünü sunuyoruz. Bu eksplant model eksen uzama, morfojen kaynaklarının değiştirilmesi ve hücre altı çözünürlük doku düzeyinde canlı görüntüleme üzerinde kontrol sağlar.
Abstract
Omurgalı embriyolar ana vücut eksenlerini tekrarlayan somitler, omurların, kasların ve cildin öncülleri olarak düzenlerler. Embriyonun kuyruk ucu arka olarak uzadıkça presomitik mezodermden (PSM) giderek bölünür. Düzenli periyodiklik ve boyut ölçeği ile somites oluşur. Zebra balığı, genetik olarak çekişli olduğu ve canlı görüntülemeye izin veren şeffaf embriyolara sahip olduğu için popüler bir model organizmadır. Bununla birlikte, somitogenez sırasında, balık embriyoları büyük, yuvarlatılmış bir yumurta sarısı etrafına sarılır. Bu geometri, zebra balığı embriyolarındaki PSM dokusunun canlı görüntülenmesini, özellikle de yakın objektif çalışma mesafesi gerektiren daha yüksek çözünürlüklerde sınırlar. Burada zebra balığı kuyruk eksplantlarının canlı görüntülenmesi için düzleştirilmiş 3 boyutlu doku kültürü yöntemi sunuyoruz. Kuyruk eksplantları, eksen uzamasının orantılı bir yavaşlamasını ve rostrocaudal somit uzunluklarının kısalmasıyla bozulmamış embriyoları taklit eder. Eksen uzama hızını eksplant kültürü ile daha da durdurabiliyoruz. Bu, ilk kez, akssal uzamanın mekanistik girdisinden sinyal gradyanlarının kimyasal girişini çözememizi sağlar. Gelecekteki çalışmalarda, bu yöntem, zaman kontrollü farmasötik pertürbasyonlara veya omurgalı segmentasyonunun herhangi bir ilaç penetrasyon endişesi olmadan taranmasına izin vermek için mikroakışkan bir kurulumla birleştirilebilir.
Introduction
Organizmaların metamerik segmentasyonu doğada yaygın olarak kullanılmaktadır. Tekrarlanan yapılar, omurlar, kaslar, sinirler, damarlar, uzuvlar veya bir vücut planındaki yapraklar gibi yanal organların işlevselliği için gereklidir1. Eksenel simetrinin bu tür fizyolojik ve geometrik kısıtlamalarının bir sonucu olarak, Bilateria’nın annelidler, eklembacaklılar ve akorlar gibi çoğu phyla embriyonik dokularının (örneğin, ektoderm, mesoderm) antero-posteriorly segmentasyonunu sergiler.
Omurgalı embriyolar, paraksiyal mezodermlerini ana vücut ekseni boyunca sırayla türlere özgü aralıklar, sayımlar ve boyut dağılımları ile somitlere ayırırlar. Bir tür içindeki bireysel embriyolar arasında bu kadar sağlam olmasına rağmen, omurgalı türler arasında somit segmentasyonu çok yönlüdür. Segmentasyon, geniş bir zaman aralıkları rejiminde (zebra balıklarında 25 dakikadan insanlarda 5 h’ye kadar), boyutlarda (zebra balıklarının kuyruk somitlerinde ~20 μm’den farelerin gövde somitlerinde ~ 200 μm’ye) ve sayımlarda (zebra balıklarında 32’den mısır yılanlarında ~ 300’e)2. Daha ilginçtir ki, balık embriyoları çok çeşitli sıcaklıklarda (zebra balıkları için ~20,5 °C’den 34 °C’ye kadar) gelişebilirken, hem segmentasyon aralıklarını hem de eksenel uzama hızlarını telafi ederek uygun boyut dağılımlarıyla somitlerini sağlam tutarlar. Bu ilginç özelliklerin ötesinde zebra balığı, kardeş embriyolarının bir bolluğu ve erişilebilir genetik araçlarının dış, senkron ve şeffaf gelişimi nedeniyle omurgalılarda segmentasyonu incelemek için yararlı bir model organizma olarak kalır. Mikroskopi açısından olumsuz olarak, teleost embriyoları hacimli küresel bir yumurta sarısı üzerinde gelişir, etrafındaki gastrulating dokusunu gererek ve yuvarlar (Şekil 1A). Bu yazıda zebra balığı kuyrukları için düzleştirilmiş 3 boyutlu doku eksplant kültürü sunuyoruz. Bu eksplant sistem, yumurta sarısı kütlesinin küresel kısıtlamalarını atlatarak somit desenleme için balık embriyolarının yüksek çözünürlüklü canlı görüntülemesine erişim sağlar.
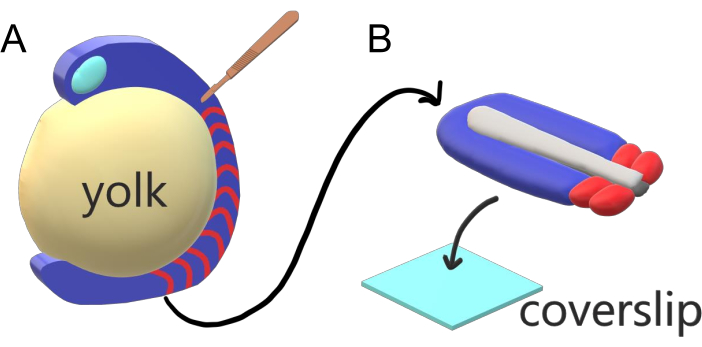
Şekil 1: Zebra Balığı Embriyoları için Slayt Odası Eksplant Sistemi. (A) Zebra balığı embriyolarının canlı görüntüleme için avantajları vardır, örneğin gastrulating embriyonik dokunun şeffaflığı (mavi), ancak doku, sağlam embriyolarda neredeyse objektif, yüksek çözünürlüklü görüntülemeyi önleyen hacimli küresel bir yumurta sarısı kütlesi (sarı) etrafında oluşur. Kuyruk eksplantları, somitlerin doku ön kısmından (kırmızı) kesilen mikrocerrahi bir bıçakla (kahverengi) başlayarak ve arka plan sarısı ile sınırda devam ederek kesilebilir. (B) Diseksiyonlu kuyruk eksplantları bir kapak (açık mavi) dorsoventrally üzerine yerlenebilir; üstte sinir dokusu (açık gri), altta notochord (koyu gri) tutmak. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Bu makalede zebra balığı embriyolarıiçin son zamanlarda geliştirdiğimiz ve kullandığımız bir doku kültürü eksplant tekniğinin ayrıntılı bir protokolü sunulmaktadır. Tekniğimiz civciv8 ve zebra balığı 9 ,10,11model organizmalarda önceki eksplant yöntemleri üzerine inşa edilmektedir. Bu protokolle hazırlanan kuyruk eksplantları, basit bir slayt odasında…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Balık bakımı için AECOM Zebrafish Core Facility ve Cincinnati Çocuk Veterinerlik Hizmetlerine, teknik yardım için Cincinnati Çocuk Görüntüleme Çekirdeğine, video prodüksiyona yardım için Didar Saparov’a ve el yazmasını düzenlediği için Hannah Seawall’a teşekkür ederiz. Bu yayında bildirilen araştırmalar, Ulusal Sağlık Enstitüleri Ulusal Genel Tıp Bilimleri Enstitüsü tarafından R35GM140805 ödül numarası altında E.M.Ö. İçerik sadece yazarların sorumluluğundadır ve Ulusal Sağlık Enstitülerinin resmi görüşlerini temsil etmek zorunda değildir.
Materials
| 1 mL Sub-Q Syringe with PrecisionGlide Needle | Becton, Dickinson and Co. | REF 309597 | for dechorionating embryos and manipulations |
| 200 Proof Ethanol, Anhydrous | Decon Labs | 2701 | for immunostaining |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | for tissue dissection media |
| Calcium Chloride Anhydrous, Powder | Sigma-Aldrich | 499609 | for tissue dissection media |
| Dimethylsulfoxide | Sigma-Aldrich | D5879 | for immunostaining |
| Disposable Scalpel, #10 Stainless Steel | Integra-Miltex | MIL4-411 | for preparing tape slide wells |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | 886-86-2 | (optional) for anesthesizing tissues older than 20 somites stage |
| Fetal Bovine Serum (FBS) | ThermoFisher | A3160601 | additional for tissue culture media |
| Goat anti-Mouse IgG2b, Alexa Fluor 594 | Invitrogen | Cat#A-21145; RRID: AB_2535781 | secondary antibody for immunostaining |
| L-15 Medium with L-Glutamine w/o Phenol Red | GIBCO | 21083-027 | for tissue dissection media |
| Methanol | Sigma-Aldrich | 179337 | for immunostaining |
| Microsurgical Corneal Knife 2.85 mm Angled Tip Double Bevel Blade | Surgical Specialties | 72-2863 | for tissue dissection |
| Mouse monoclonal anti-ppERK | Sigma-Aldrich | Cat#M8159; RRID:AB_477245 | for ppERK immunostaining |
| NucRed Live 647 ReadyProbes Reagent | Invitrogen | R37106 | (optional) for live staining of cell nuclei |
| Paraformaldehyde Powder, 95% | Sigma-Aldrich | 158127 | for fixation of samples for immunostaining |
| Rat Tail Collagen Coating Solution | Sigma-Aldrich | 122-20 | (optional) for chemically activating slide chambers |
| Stage Top Incubator | Tokai Hit | tokai-hit-stxg | (optional) for temperature control during live imaging |
| Transparent Tape 3/4'' | Scotch | S-9782 | for preparing tape slide wells |
| Triton X-100 | Sigma-Aldrich | X100 | for immunostaining |
| Tween 20 | Sigma-Aldrich | P1379 | for immunostaining |
| Zebrafish: Tg(actb2:2xMCP-NLS-EGFP) | Campbell et al., 2015 | ZFIN: ZDB-TGCONSTRCT-150624-4 | transgenic fish with nuclear localized EGFP |
| Zebrafish: Tg(Ola.Actb:Hsa.HRAS-EGFP) | Cooper et al., 2005 | ZFIN: ZDB-TGCONSTRCT-070117-75 | transgenic fish with cell membrane localized EGFP |
References
- Assheton, R. . Growth in length: Embryological Essays. , (1916).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454 (7202), 335-339 (2008).
- Westerfield, M. . The Zebrafish Book: a guide for the laboratory use of zebrafish (Danio rerio), 3rd edition. , (1995).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (1700003), (2017).
- Simsek, M. F., Ozbudak, E. M. Spatial fold change of Fgf signaling encodes positional information for segmental determination in zebrafish. Cell Reports. 24 (1), 66-78 (2018).
- Dubrulle, J., Pourquié, O. fgf8 mRNA decay establishes a gradient that couples axial elongation to patterning in the vertebrate embryo. Nature. 427 (6973), 419-422 (2004).
- Diez del Corral, R., et al. Opposing FGF and Retinoid Pathways Control Ventral Neural Pattern, Neuronal Differentiation, and Segmentation during Body Axis Extension. Neuron. 40 (1), 65-79 (2003).
- Stern, H. M., Hauschka, S. D. Neural tube and notochord promote in vitro myogenesis in single somite explants. Developmental Biology. 167 (1), 87-103 (1995).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics. 228 (3), 464-474 (2003).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in molecular biology. 546 (11), 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Developmental Biology. 406 (2), 172-185 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).

