Une culture d’explantation de queue 3D pour étudier la segmentation des vertébrés chez le poisson zèbre
Summary
Ici, nous présentons le protocole pour la culture tissulaire 3D de l’axe postérieur du corps du poisson zèbre, permettant l’étude vivante de la segmentation des vertébrés. Ce modèle d’explant fournit le contrôle sur l’élongation d’axe, l’altération des sources morphogènes, et l’imagerie vivante au niveau du tissu de résolution subcellulaire.
Abstract
Les embryons de vertébrés façonnent leur axe principal du corps comme des somites répétitives, les précurseurs des vertèbres, des muscles et de la peau. Les somites segmentent progressivement du mésoderme présomitique (PSM) à mesure que la queue de l’embryon s’allonge postérieurement. Les somites se forment avec une périodicité régulière et une échelle de taille. Le poisson zèbre est un organisme modèle populaire car il est génétiquement tractable et possède des embryons transparents qui permettent l’imagerie vivante. Néanmoins, au cours de la somitogenèse, les embryons de poisson sont enroulés autour d’un gros jaune arrondi. Cette géométrie limite l’imagerie en direct des tissus PSM dans les embryons de poissons zèbres, en particulier à des résolutions plus élevées qui nécessitent une distance de travail objective étroite. Ici, nous présentons une méthode de culture tissulaire 3D aplati pour l’imagerie vivante des explants de queue de poisson zèbre. Les explants de queue imitent des embryons intacts en montrant un ralentissement proportionnel de l’allongement de l’axe et un raccourcissement des longueurs de somite rostrocaudales. Nous sommes en outre en mesure de caler la vitesse d’allongement de l’axe grâce à la culture explant. Ceci, pour la première fois, nous permet de démêler l’entrée chimique des gradients de signalisation de l’entrée mécaniste de l’allongement axial. Dans de futures études, cette méthode peut être combinée avec une configuration microfluidique pour permettre des perturbations pharmaceutiques contrôlées dans le temps ou le dépistage de la segmentation des vertébrés sans aucun problème de pénétration des médicaments.
Introduction
La segmentation métamérique des organismes est largement utilisée dans la nature. Les structures répétées sont essentielles pour la fonctionnalité des organes latéraux tels que les vertèbres, les muscles, les nerfs, les vaisseaux, les membres ou les feuilles dans un plan corporel1. En raison de telles contraintes physiologiques et géométriques de la symétrie axiale, la plupart des embranchements de Bilateria- tels que les annélides, les arthropodes et les chordés- présentent une segmentation de leurs tissus embryonnaires (par exemple, ectoderme, mésoderme) antéro-postérieur.
Les embryons de vertébrés segmentent séquentiellement leur mésoderme paraxial le long de l’axe principal du corps en somites avec des intervalles, des comptes et des distributions de taille spécifiques à l’espèce. Malgré une telle robustesse parmi les embryons individuels au sein d’une espèce, la segmentation de la somite est polyvalente entre les espèces de vertébrés. La segmentation se produit dans un vaste régime d’intervalles de temps (de 25 min chez le poisson zèbre à 5 h chez l’homme), de tailles (de ~20 μm dans les somites de queue de poisson zèbre à ~200 μm dans les somites de tronc de souris) et de comptages (de 32 chez les poissons zèbres à ~300 chez les serpents de maïs)2. Plus intéressant encore, les embryons de poissons peuvent se développer dans une large gamme de températures (de ~ 20,5 ° C à 34 ° C pour le poisson zèbre) tout en gardant leurs somites intactes avec des distributions de taille appropriées en compensant à la fois les intervalles de segmentation et les vitesses d’allongement axiales. Au-delà de ces caractéristiques intéressantes, le poisson zèbre reste un organisme modèle utile pour étudier la segmentation chez les vertébrés en raison du développement externe, synchrone et transparent d’une plénitude d’embryons de frères et sœurs ainsi que de leurs outils génétiques accessibles. Du point de vue de la microscopie, les embryons de téléostéos se développent sur un jaune sphérique volumineux, étirant et arrondissant le tissu gazeux qui l’entoure (Figure 1A). En cet article, nous présentons une culture aplatie d’explant de tissu 3D pour des queues de poisson zèbre. Ce système d’explantation contourne les contraintes sphériques de la masse vitellin, permettant l’accès à l’imagerie vivante haute résolution d’embryons de poissons pour le modelage de somite.
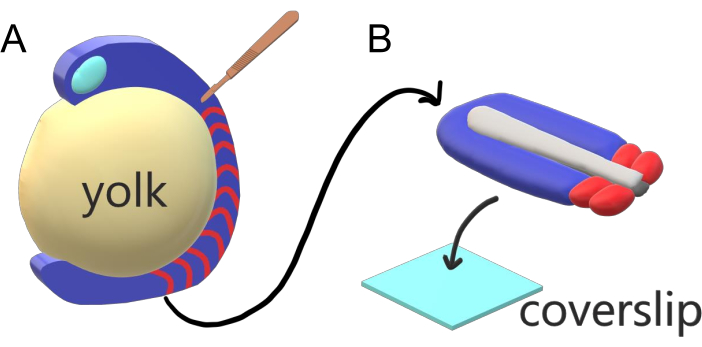
Figure 1: Système d’explantation à chambre coulissante pour les embryons de poisson zèbre. (A) Les embryons de poisson zèbre présentent des avantages pour l’imagerie vivante, tels que la transparence du tissu embryonnaire gastrulating (bleu), mais le tissu se forme autour d’une masse de jaune sphérique volumineuse (jaune) qui empêche l’imagerie proche de l’objectif et à haute résolution dans les embryons intacts. Les explants de queue peuvent être disséqués en commençant par un couteau microchirurgical (brun) coupé du tissu antérieur des somites (rouge) et en continuant à la frontière avec le jaune postérieurement. (B) Les explants de queue disséqués peuvent être placés sur une lamelle de couverture (bleu clair) dorsoventralement; garder le tissu neural (gris clair) sur le dessus et notochord (gris foncé) en bas. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Protocol
Representative Results
Discussion
Cet article présente un protocole détaillé d’une technique d’explant de culture de tissu que nous avons développée et employée récemment5 pour des embryons de poisson zèbre. Notre technique s’appuie sur les méthodes explant précédentes chez les poussins8 et les poissonszèbres 9,10,11 organismes modèles. Les explants de queue préparés avec ce protocole peuvent s…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nous remercions l’AECOM Zebrafish Core Facility et les Cincinnati Children’s Veterinary Services pour l’entretien du poisson, le Cincinnati Children’s Imaging Core pour l’assistance technique, Didar Saparov pour l’aide à la production vidéo et Hannah Seawall pour l’édition du manuscrit. La recherche rapportée dans cette publication a été soutenue par le National Institute of General Medical Sciences des National Institutes of Health sous le numéro de bourse R35GM140805 à E.M.Ö. Le contenu relève de la seule responsabilité des auteurs et ne représente pas nécessairement les opinions officielles des National Institutes of Health.
Materials
| 1 mL Sub-Q Syringe with PrecisionGlide Needle | Becton, Dickinson and Co. | REF 309597 | for dechorionating embryos and manipulations |
| 200 Proof Ethanol, Anhydrous | Decon Labs | 2701 | for immunostaining |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | for tissue dissection media |
| Calcium Chloride Anhydrous, Powder | Sigma-Aldrich | 499609 | for tissue dissection media |
| Dimethylsulfoxide | Sigma-Aldrich | D5879 | for immunostaining |
| Disposable Scalpel, #10 Stainless Steel | Integra-Miltex | MIL4-411 | for preparing tape slide wells |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | 886-86-2 | (optional) for anesthesizing tissues older than 20 somites stage |
| Fetal Bovine Serum (FBS) | ThermoFisher | A3160601 | additional for tissue culture media |
| Goat anti-Mouse IgG2b, Alexa Fluor 594 | Invitrogen | Cat#A-21145; RRID: AB_2535781 | secondary antibody for immunostaining |
| L-15 Medium with L-Glutamine w/o Phenol Red | GIBCO | 21083-027 | for tissue dissection media |
| Methanol | Sigma-Aldrich | 179337 | for immunostaining |
| Microsurgical Corneal Knife 2.85 mm Angled Tip Double Bevel Blade | Surgical Specialties | 72-2863 | for tissue dissection |
| Mouse monoclonal anti-ppERK | Sigma-Aldrich | Cat#M8159; RRID:AB_477245 | for ppERK immunostaining |
| NucRed Live 647 ReadyProbes Reagent | Invitrogen | R37106 | (optional) for live staining of cell nuclei |
| Paraformaldehyde Powder, 95% | Sigma-Aldrich | 158127 | for fixation of samples for immunostaining |
| Rat Tail Collagen Coating Solution | Sigma-Aldrich | 122-20 | (optional) for chemically activating slide chambers |
| Stage Top Incubator | Tokai Hit | tokai-hit-stxg | (optional) for temperature control during live imaging |
| Transparent Tape 3/4'' | Scotch | S-9782 | for preparing tape slide wells |
| Triton X-100 | Sigma-Aldrich | X100 | for immunostaining |
| Tween 20 | Sigma-Aldrich | P1379 | for immunostaining |
| Zebrafish: Tg(actb2:2xMCP-NLS-EGFP) | Campbell et al., 2015 | ZFIN: ZDB-TGCONSTRCT-150624-4 | transgenic fish with nuclear localized EGFP |
| Zebrafish: Tg(Ola.Actb:Hsa.HRAS-EGFP) | Cooper et al., 2005 | ZFIN: ZDB-TGCONSTRCT-070117-75 | transgenic fish with cell membrane localized EGFP |
References
- Assheton, R. . Growth in length: Embryological Essays. , (1916).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454 (7202), 335-339 (2008).
- Westerfield, M. . The Zebrafish Book: a guide for the laboratory use of zebrafish (Danio rerio), 3rd edition. , (1995).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (1700003), (2017).
- Simsek, M. F., Ozbudak, E. M. Spatial fold change of Fgf signaling encodes positional information for segmental determination in zebrafish. Cell Reports. 24 (1), 66-78 (2018).
- Dubrulle, J., Pourquié, O. fgf8 mRNA decay establishes a gradient that couples axial elongation to patterning in the vertebrate embryo. Nature. 427 (6973), 419-422 (2004).
- Diez del Corral, R., et al. Opposing FGF and Retinoid Pathways Control Ventral Neural Pattern, Neuronal Differentiation, and Segmentation during Body Axis Extension. Neuron. 40 (1), 65-79 (2003).
- Stern, H. M., Hauschka, S. D. Neural tube and notochord promote in vitro myogenesis in single somite explants. Developmental Biology. 167 (1), 87-103 (1995).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics. 228 (3), 464-474 (2003).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in molecular biology. 546 (11), 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Developmental Biology. 406 (2), 172-185 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).

